Cd(II)对多环芳烃降解菌Bacillus sp. P1产酶及酶促降解过程影响研究*
曾光明,刘少恒,牛秋雅,刘云国,胡新将
(1.湖南大学 环境科学与工程学院,湖南 长沙 410082;2.环境生物与控制教育部重点实验室(湖南大学),湖南 长沙 410082)
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是一类广泛存在于环境中的有机污染物,由于具有急慢性毒性作用,甚至可致畸、致癌、致突变[1],其对环境的污染和危害已经成为一个备受关注的问题.微生物降解PAHs是一种能够经济高效地减少PAHs污染的方式[2].该过程中,微生物分泌的各种胞外和胞内酶[3]对PAHs的开环降解过程起关键作用.而重金属会通过影响微生物的生理活动从而影响其酶的分泌过程,也会通过氧化[4]或者与巯基(-SH)结合[5]等方式影响酶的结构或活性,从而影响其酶促降解性能.因此,重金属对PAHs降解微生物产酶过程及酶促降解过程的影响可能是其影响微生物对PAHs降解能力的机制之一.而近年来,国内外学者对于重金属影响PAHs生物降解的研究主要集中在其对降解效率的影响方面[6],对于其影响降解效率的机理却少有深入研究.
菲(Phenanthrene)是一种PAHs污染环境中常见的污染物,且其兼具湾区结构和K区结构,是致癌PAHs的最小结构单元[7],常被作为研究PAHs生物降解的模式化物质.镉在污染环境中分布广泛,对人类及环境危害较大,是一种典型的重金属污染物.因此,本实验分别以菲和Cd(II)作为PAHs和重金属的代表性物质,研究Cd(II)对PAHs高效降解菌Bacillussp. P1在降解菲过程中产酶过程的影响及其对酶促降解性能的影响,以期为探明Cd(II)对Bacillussp. P1降解PAHs的影响机理提供依据.
1 材料与方法
蛋白的浓度可以表征体系中酶量的多少,测得含Cd(II)体系和无Cd(II)体系降解菌产生的蛋白浓度的差异可以表征Cd(II)对降解菌产酶总量的影响.邻苯二酚2,3-双加氧酶在细菌开环降解菲过程中起关键作用[8],测得含Cd(II)体系和无Cd(II)体系降解菌所产生的粗酶液中其酶活的差异可以表征Cd(II)对降解菌产酶的酶活影响.此外,酶促降解过程中菲降解率的变化是反应Cd(II)对酶促降解过程影响的直接参数.因此本研究分别从蛋白浓度的变化、粗酶液中邻苯二酚2,3-双加氧酶酶活的变化及酶促降解过程菲降解率的变化3个方面来考察Cd(II)对降解菌产酶过程的影响及其对酶促降解过程的影响.
1.1 菌种来源
从长期受PAHs污染的污泥中(以PAHs为唯一碳源)筛选出的细菌Bacillussp. P1[9],经PCR扩增其16S rDNA后鉴定,该菌种与Bacillusmalacitensisstrain CECT 5687的同源性高达100%.
1.2 Cd(II)对Bacillus sp. P1产酶的影响
1.2.1 胞外酶及胞内酶的提取
1)降解菌的培养条件
配制一定体积的牛肉膏蛋白胨液体培养基,分装入几个250 mL锥形瓶中,每瓶100 mL,以八层纱布封口,放入高压灭菌锅121 °C灭菌30 min.将高压灭菌后的锥形瓶置于无菌室,紫外灯照射灭菌20 min.在无菌条件下,将保存于斜面中的Bacillussp. P1菌种接种于三角瓶内,30 °C,150 r/min条件下好氧振荡培养48 h.
2)胞外酶、胞内酶的提取方式
将降解菌Bacillussp. P1的培养液在4 °C,9 000 r/min条件下离心,收集上清液,即为胞外粗酶液.将分离出的沉淀(菌体)置入0.05 M的磷酸盐缓冲液中反复振荡洗涤,9 000 r/min条件下离心,重复3次.将收集到的菌体再次置于0.05 M磷酸盐缓冲液中,制成菌悬液,将其置于0 °C冰水混合浴中,用超声波破碎仪(XO-1000D,南京舜玛)间歇破碎细胞10 min(300 W, 3 s/8 s).在4 °C下9 000 r/min离心10 min,上清液即为胞内粗酶液[10].
1.2.2 降解菌产酶的SDS-PAGE分析测定
本实验采用聚丙烯酰胺凝胶电泳(SDS-PAGE)法探究在降解菲的过程中Cd(II)对降解菌Bacillussp. P1所产生的酶的组成和数量的影响.主要试验方法如下:将12%的分离胶(H2O 3.3 mL,30%丙烯酰胺4.0 mL,1.5 mol/L Tris-HCl 2.5 mL,10%十二烷基苯磺酸钠0.1 mL,10%过硫酸铵0.1 mL,TEMED 6 μL)灌入两块玻璃板间,待凝胶形成后在分离胶上层灌入5%的浓缩胶(H2O 2.7 mL,30%丙烯酰胺0.67 mL,1.0 mol/L Tris-HCl 0.5 mL,10%十二烷基苯磺酸钠40 μL,10%过硫酸铵40 μL,TEMED 4 μL),并插入样品梳.待浓缩胶凝聚后,在电泳槽(Bio-Rad)中倒入电泳缓冲液,取出样品梳.在每个凹形凝胶样品槽中注入10 μL样品或标准蛋白marker.电泳结束后,将胶片用考马斯亮蓝染色,用脱色剂脱色后观察[11].使用Gelpro软件对蛋白条带进行分析.样品为分别从在仅含菲(60 mg/L)的无机盐培养基((MnSO40.0447 mg/L, ZnSO40.068 6 mg/L, (NH4)6MO7O24·4H2O 0.034 7 mg/L, K2HPO4129.15 mg/L, Na2HPO4167 mg/L, KH2PO443.5 mg/L, NH4Cl 25 mg/L, MgSO413.8 mg/L, CaCl236.4 mg/L, FeCl30.42 mg/L)中培养的菌和从在菲与Cd(II)共存的无机盐培养基(菲浓度为60 m/L;Cd(II)浓度分别为50, 100, 150,200,300 mg/L)中培养的菌中提取出的胞外(胞内)酶,经盐析和透析后所得.
1.3 Cd(II)对Bacillus sp. P1粗酶液中邻苯二酚2,3-双加氧酶酶活的影响
将Bacillussp. P1分别在仅含菲(60 mg/L)和菲与Cd(II)共存的无机盐培养基中(菲浓度为60 m/L;Cd(II)浓度分别为50, 100, 150,200,300 mg/L)培养,3 d后提取粗酶液.在375 nm (UV 2550,SHIMADZU)波长下测定邻苯二酚2,3-双加氧酶活性.每个测试样品中含2.4 mL磷酸盐缓冲液(0.05 M),0.4 mL 邻苯二酚(20 μM)及0.2 mL粗酶液[12].定义每分钟1 μmol底物转化所需的酶量为1个酶活力单位U.
1.4 Cd(II)对酶促降解菲的影响
pH及温度均是影响酶促降解过程的重要因素.过酸或过碱的环境都会影响酶促降解性能.温度过高或者过低也会影响酶促反应的活化能及酶蛋白的结构.本实验首先确定了酶促降解的较佳pH及温度条件,在上述条件下探究Cd(II)对酶促降解菲的影响.pH对酶促降解菲影响的试验方法如下:取系列反应瓶,分别加入20 mL超纯水,同时加入菲,使其在瓶中含量均为25 mg/L.用NaOH或HCl调节溶液pH分别为4.0,5.0,6.0,7.0,8.0和9.0.向每个瓶中加入2 mL粗酶液,在30 ℃下振荡反应30 min后取出.将样品用正己烷萃取3次,合并萃取液,用紫外分光光度计在254 nm波长下测定菲的吸光度,计算其降解率[13].同时设置加入高温灭活酶的对照组.
温度对酶促降解菲影响的试验方法如下:取系列反应瓶,分别加入20 mL超纯水,同时加入菲使得其在瓶中含量均为25 mg/L.向每个瓶中加入2 mL粗酶液,分别将其置于25,30,37及45 °C的环境中,振荡反应30 min后取出,通过前述同样的方法萃取、测定、计算菲的降解率.
Cd(II)浓度对菲酶促降解影响的试验方法如下:取6个反应瓶,分别往其中加入50 mL超纯水,同时加入菲使其在瓶中的含量分别为5 mg/L.向各瓶中(1号瓶除外)加入Cd(II),使1~6号瓶中的Cd(II)浓度分别为0,50,100,150,200,300 mg/L.再分别往各瓶中加入2 mL粗酶液后,调节pH及温度为1.4前述部分所确定的酶促降解的较佳pH及温度,振荡反应30 min.随后将瓶中所有试样分别用正己烷萃取3次,将萃取液在紫外分光光度计下254 nm波长处测定菲的吸光度,计算其降解率.本研究中所有体系均设置3个平行样.
2 结 果
2.1 Cd(II)对Bacillus sp. P1产酶的影响
Cd(II)对Bacillussp. P1产酶的影响如图1所示.图1(A)和图1(B)分别表示Cd(II)对Bacillussp. P1产胞外蛋白和胞内蛋白的影响.图中的a,b,c,d泳道分别表示在0,50,100,150 mg/L Cd(II)浓度下,细菌在降解菲过程中产生的蛋白的变化.经Gelpro软件分析可知,胞外及胞内蛋白的总浓度随Cd(II)浓度增加而逐渐减小,胞外、胞内蛋白条带总浓度分别由8.37×106,1.54×107降至5.49×106,6.01×106(Gelpro软件分析值).胞外、胞内蛋白中含邻苯二酚2,3-双加氧酶的33-45 kD蛋白条带的浓度也依次减小,分别由4.31×105,5.66×106降至2.39×105,4.78×104.此外,胞外蛋白中小分子蛋白(分子量<20 kD)受较高浓度(150 mg/L)Cd(II)影响较大,该区域条带几乎已完全丢失.
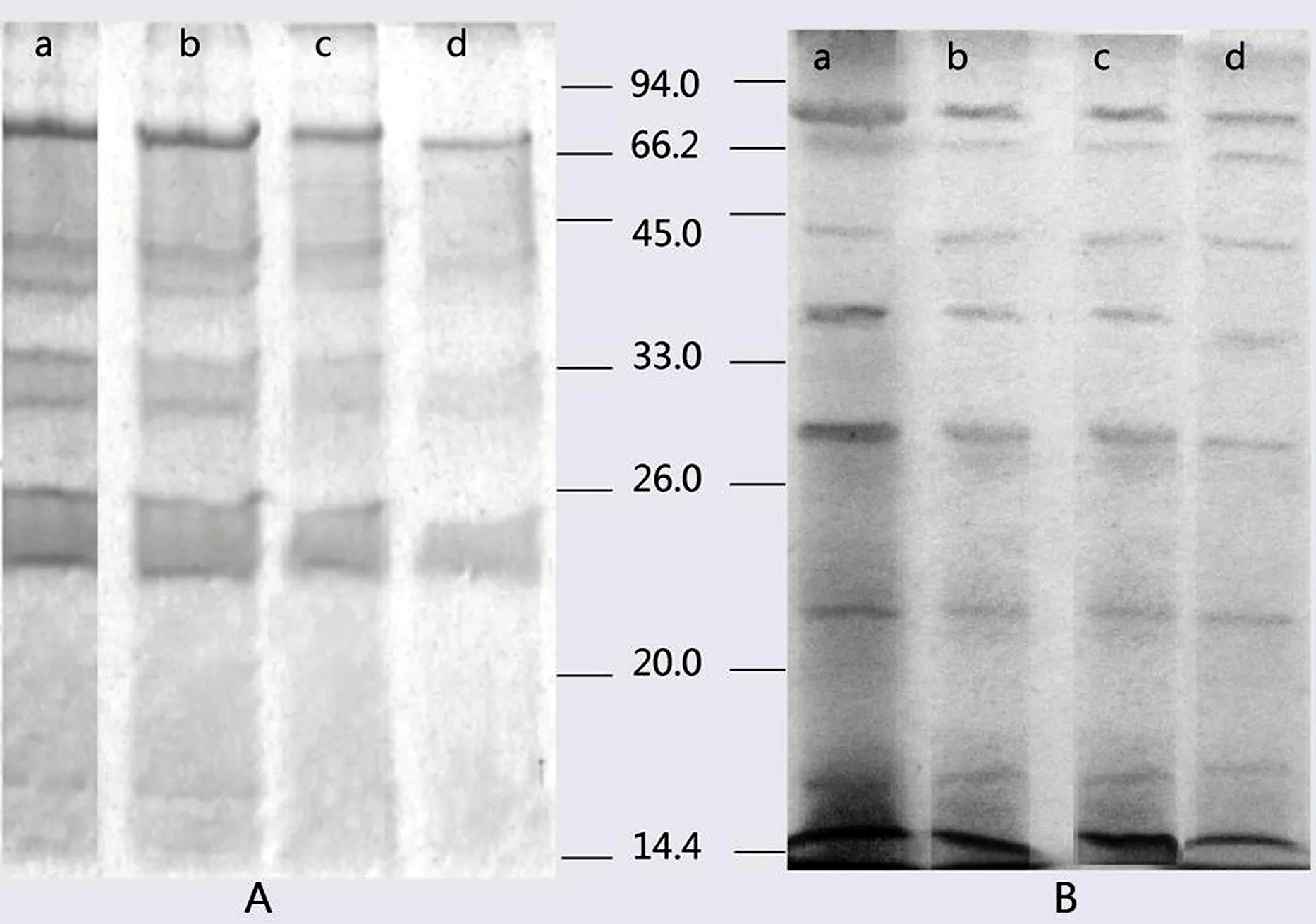
图1 Cd(II)对Bacillus sp. P1产生的蛋白的影响
2.2 Cd(II)对Bacillus sp. P1粗酶液中邻苯二酚2,3-双加氧酶的影响
Cd(II)对Bacillussp. P1粗酶液中邻苯二酚2,3-双加氧酶酶活的影响如图2所示.Cd(II)对Bacillussp.P1胞外及胞内粗酶液中邻苯二酚2,3-双加氧酶的酶活均有抑制作用,且在Cd(II)浓度为100~300 mg/L范围内,抑制作用均十分显著(p<0.05).当Cd(II)浓度由0 mg/L增大至300 mg/L,胞外及胞内酶中的邻苯二酚2,3-双加氧酶酶活分别由266.96,886.30 U/mg下降至38.93,290.26 U/mg.
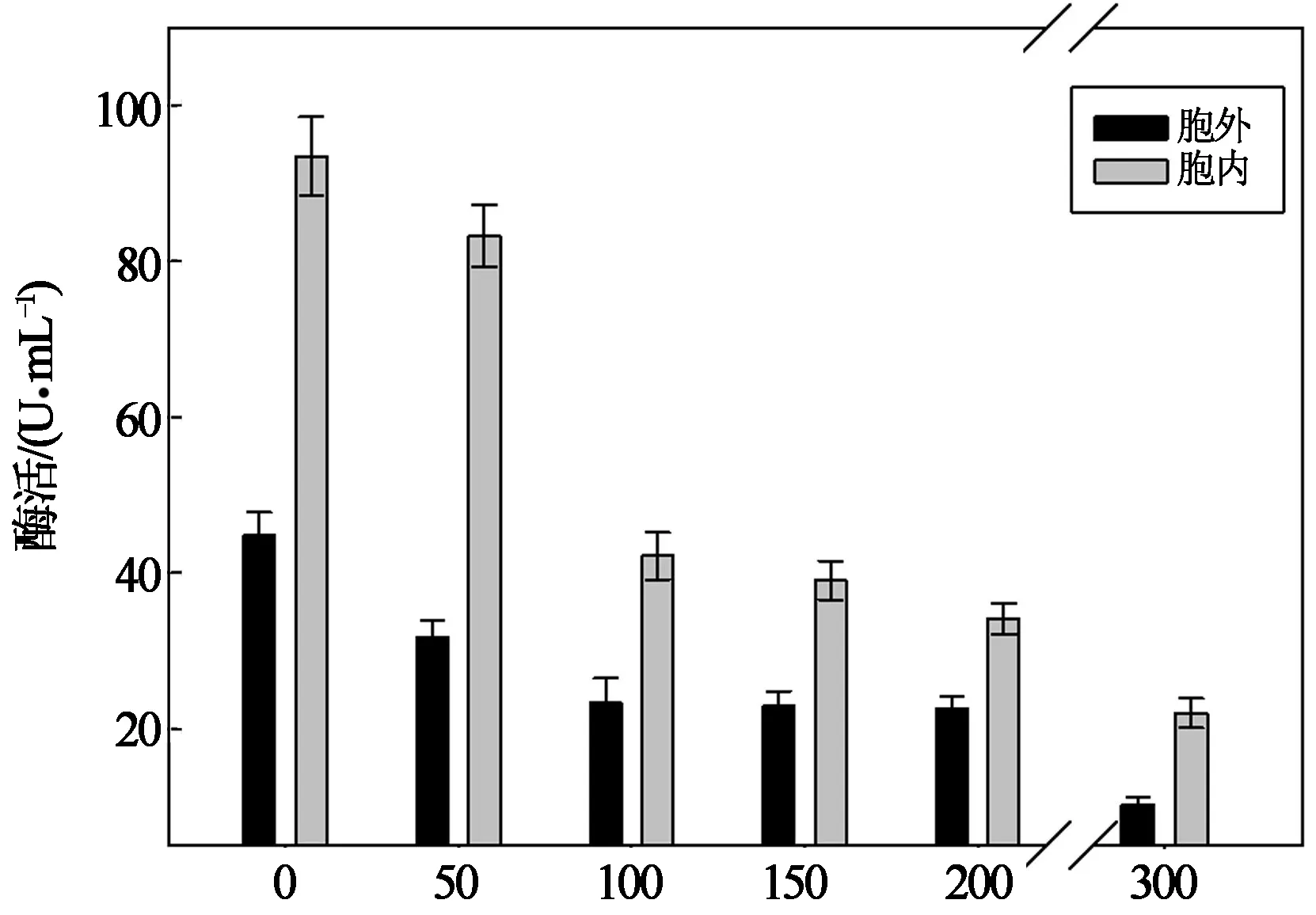
Cd(II)浓度/(mg·L-1)
2.3 Cd(II)对菲酶促降解过程的影响
在胞外、胞内酶酶促降解菲的过程中,随着pH增大,菲的降解率均呈先增大后减小的趋势.当pH为7时,胞外酶对菲的降解率达到最大值88.06%;当pH为6时,胞内酶对菲的降解率达到最大值97.21%.由图还可以看出,在试验的整个pH范围内,胞内酶酶促降解菲的效率均高于胞外酶酶促降解菲的效率,这表明,相同pH条件下,胞内酶酶促降解菲的能力强于胞外酶酶促降解菲的能力.此结论同时映证了图1和图2所反映的结果,表明细菌在降解菲的过程中,其分泌到胞外起作用的酶量少于胞内酶酶量.同时,胞内粗酶液中一些关键开环酶(如邻苯二酚2,3-双加氧酶)的酶活大于胞外粗酶液中关键开环酶的酶活.由此得知,Cd(II)影响粗酶液中酶量的多少及其中关键开环酶的酶活大小是其对菲的酶促降解过程产生影响的内在机制.
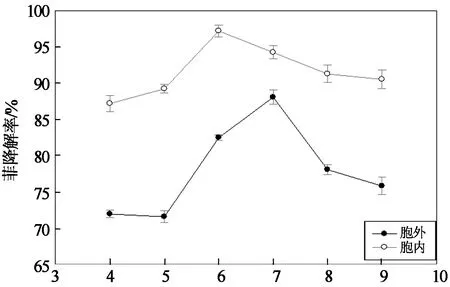
pH
温度对菲酶促降解过程的影响如图4所示.在37 ℃时,胞外酶和胞内酶的酶促降解能力最强,对菲的降解率分别为81.81%和99.81%.在一定温度范围内,酶保持较高降解活性,且酶促降解性能随温度的升高而增大.随温度增高,酶活性提高;同时,菲在水中的溶解性也会增大,使得其与酶的接触面积增大,提高了其降解率[14].然而过高的温度则会使蛋白质发生变性,从而降低酶的活性,菲的降解率逐渐降低.
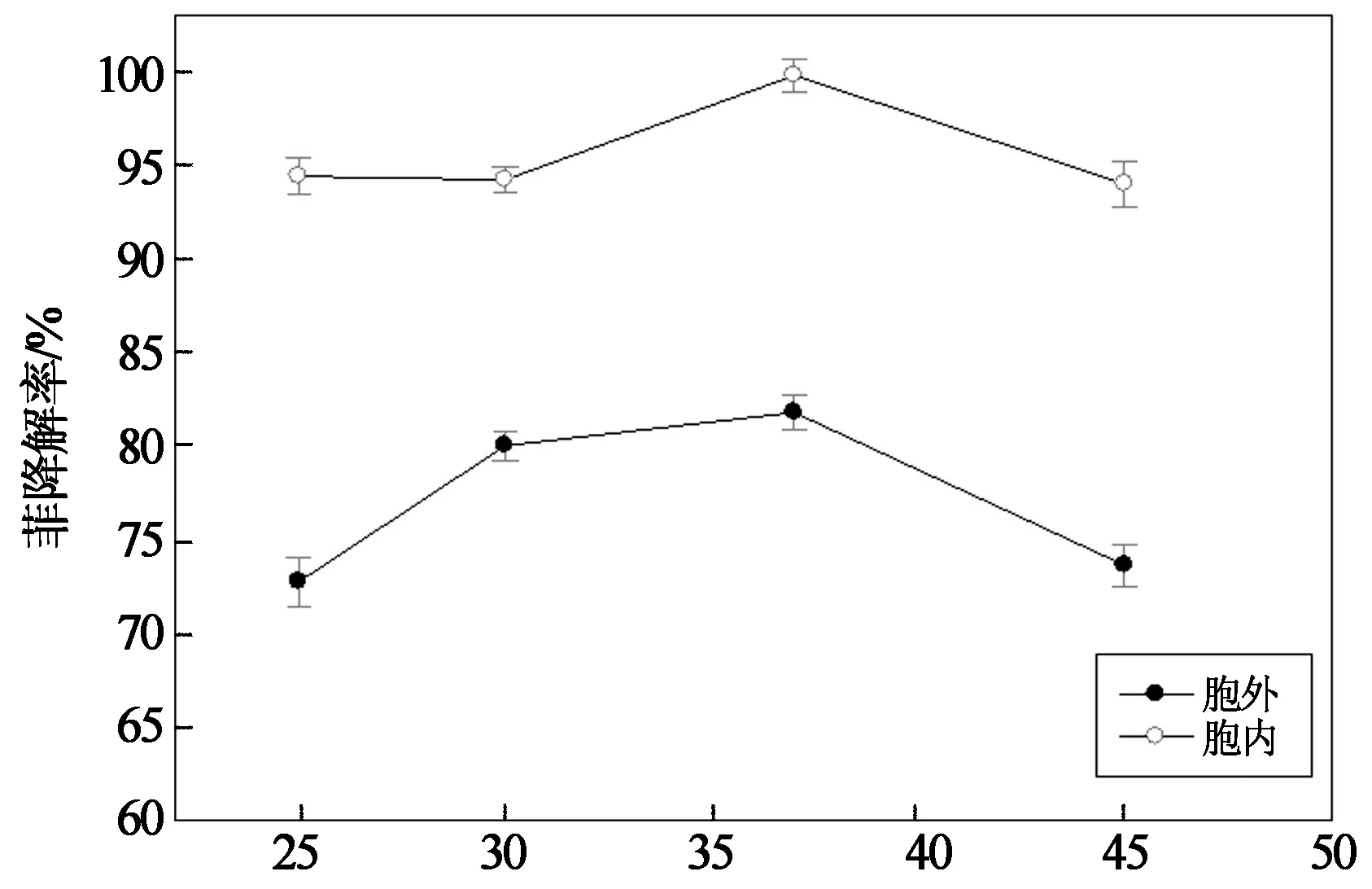
温度/℃
在确定菲酶促降解的较佳温度和pH的基础上,研究该条件下重金属对菲酶促降解过程的影响.Cd(II)对胞外和胞内酶酶促降解菲的影响如图5所示.由图可见,在各酶促降解体系中菲的降解率均高于64.58%,而高温灭活酶对照组(未在图中表示)中菲的降解率为2.83%,表明体系中菲减少的主要原因是酶的作用.在胞外和胞内酶降解菲的过程中,Cd(II)的出现均抑制了菲的降解,随着Cd(II)浓度从0 mg/L增大到300 mg/L,菲的降解率分别从79.86% 降至64.59%,87.96%降低至74.83%.且Cd(II)浓度为300 mg/L时,抑制作用最显著(p<0.05).
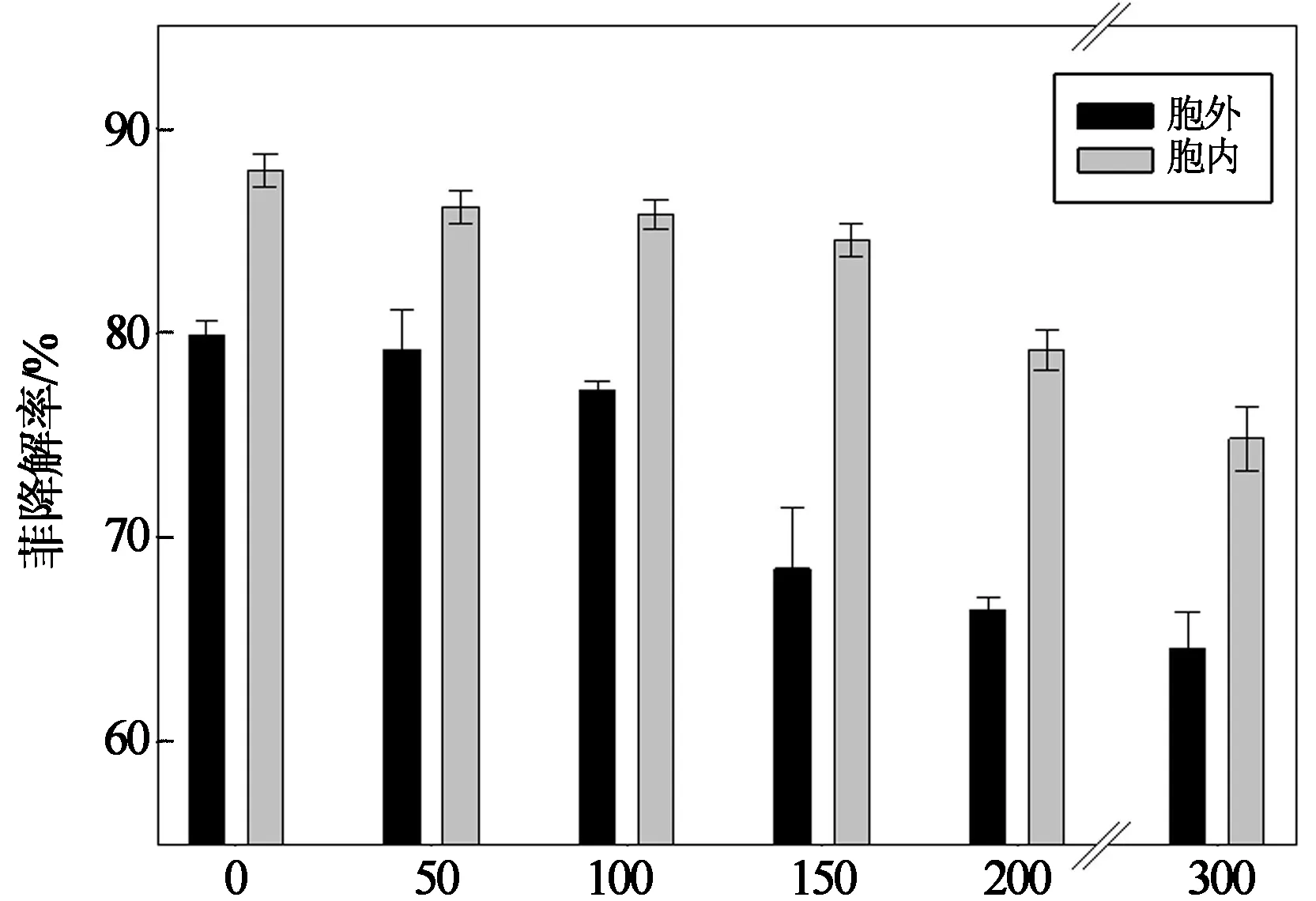
Cd(II)浓度/(mg·L-1)
3 讨 论
由于Cd(II)的作用,降解菌在降解菲过程中产生的胞外和胞内酶的浓度和活性均发生了改变,其中300 mg/L Cd(II)条件下胞内酶中关键开环酶邻苯二酚2,3-双加氧酶酶活(290.26 U/mg)比不存在Cd(II)条件下的(886.30 U/mg)降低了67.25%.这可能是由于:1)Cd(II)通过阻碍细胞分裂而抑制了降解菌的生长,降解菌数量的降低减少了体系中酶的产生总量[15].2)Cd(II)影响降解菌的生理生化过程从而影响其酶的产生及酶的组成和活性.有研究表明,Cd(II)能够刺激细胞产生活性氧基团ROS,导致细胞的过氧化状态形成,从而损害细胞膜[16];也有研究表明,Cd(II)能穿透细胞壁和细胞膜表面蛋白进入细胞内而影响细胞的内稳态[17].
Cd(II)对降解菌胞外、胞内酶酶促降解菲的过程具有抑制作用,且随Cd(II)浓度由0 mg/L增大到300 mg/L,抑制作用逐渐增强,胞外和胞内酶酶促降解菲的降解率分别由79.86%,87.96%降至64.59%,74.83%.酶促降解菲主要是通过形成酶-底物化合物或者通过降低反应过程中的活化能来催化菲的开环从而使之降解[18].无机盐培养基中的常量金属(Mg2+和 Ca2+等)会作为酶活性中心的一个必需组分,通过形成酶-金属-底物复合物来参与催化作用[19].而重金属Cd(II)会与环境中的这些常量金属竞争酶的结合位点从而使得催化作用降低,导致降解性能减弱.同时,重金属Cd(II)对酶产生毒害作用,它们能与蛋白中的巯基(-SH)结合,从而破坏其结构[20].
4 结 论
1)Cd(II)影响降解菌Bacillussp. P1在降解菲过程中酶的产生过程,导致其蛋白的组成、浓度及活性发生变化;此外,Cd(II)影响降解菌Bacillussp. P1所产生的酶的酶促降解能力.Cd(II)对降解菌产酶及酶促降解过程的影响是其影响多环芳烃降解菌降解能力的重要机制.
2)Cd(II)抑制降解菌的产酶过程.胞外和胞内酶的蛋白浓度均在Cd(II)出现后有所降低,且随着Cd(II)浓度的增加,其对酶产生的抑制作用逐渐增强.在无Cd(II)条件下和Cd(II)为300 mg/L条件下培养的降解菌胞外(胞内)粗酶液中邻苯二酚2,3-双加氧酶酶活分别为266.96 U/mg(886.30 U/mg),38.93 U/mg(290.26 U/mg).
3)Cd(II)抑制降解菌所产生的酶酶促降解菲的过程,随Cd(II)浓度从0 mg/L增加到300 mg/L,其酶促降解菲的能力逐渐减弱,胞外和胞内酶酶促降解菲的降解率分别由79.86%降至64.59%,由87.96%降低至74.83%.
[1]TEJEDA-AGREDANO M C, GALLEGO S, VILA J,etal. Influence of the sunflower rhizosphere on the biodegradation of PAHs in soil[J]. Soil Biol Biochem, 2013, 57: 830-840.
[2]XU F L, QIN N, ZHU Y,etal. Multimedia fate modeling of polycyclic aromatic hydrocarbons (PAHs) in lake Small Baiyangdian, Northern China[J]. Eco Model, 2013, 252(10): 246-257.
[3]DEBRUYN J M, MEAD T J, SAYLER G S,etal. Horizontal transfer of PAH catabolism genes in Mycobacterium: evidence from comparative genomics and isolated pyrene-degrading bacteria[J]. Environ Sci Technol, 2012, 46(1): 99-106.
[4]WANG J, CHEN C. Biosorbents for heavy metals removal and their future[J]. Biotechnol Adv, 2009, 27(2): 195-226.
[5]LORENZ N, HINTEMANN T, KRAMAREWA T ,etal. Response of microbial activity and microbial community composition, in soils to long-term arsenic and cadmium exposure[J]. Soil Biol Biochem, 2006, 38(6): 1430-1437.
[6]RIPPEY B, ROSE N, YANG H,etal. An assessment of toxicity in profundal lake sediment due to deposition of heavy metals and persistent organic pollutants from the atmosphere[J]. Environ Int, 2008, 34(3): 345-356.
[7]JANBANDHU A, FULEKAR M H. Biodegradation of phenanthrene using adapted microbial consortium isolated from petrochemical contaminated environment[J]. J Hazard Mater, 2011, 187(1/3): 333-340.
[8]曹晓星. 多环芳烃降解菌的共代谢及其相关酶的研究[D]. 厦门:厦门大学,2006:12-13.
CAO Xiao-xing. Study of co-metabolism and enzyems of polycyclic aromatic hydrocarbons-degrading bacteria[D]. Xiamen: Xiamen University, 2006:12-13. (In Chinese)
[9]牛秋雅,曾光明,牛一乐, 等. 生物强化堆肥降解菲[J]. 湖南大学学报:自然科学版,2009, 36(2): 85-88.
NIU Qiu-ya, ZENG Guang-ming, Niu Yi-le,etal. Removal of phenanthrene by acclimatizing activated sludge[J]. Journal of Hunan University: Natural Sciences, 2009, 36(2): 85-88. (In Chinese)
[10]吴蔓莉. 两株优势菌株对多环芳烃的降解机理研究[D]. 西安: 西安建筑科技大学,2010:25-26.
WU Man-li. Study of biodegradation mechanism of polycyclic aromatic hydrocarbon using two superior strains[D]. Xi’an: Xi’an University of Architecture and Technology, 2010:25-26. (In Chinese)
[11]汪家政. 蛋白质技术手册[M]. 北京: 科学出版社, 2000:77-110.
WANG Jia-zheng. Technical manual of protein[M]. Beijing: Science Press, 2000:77-110. (In Chinese)
[12]GUZIK U, GRE- I, WOJCIESZY-SKA D,etal. Isolation and characterization of a novel strain of Stenotrophomonas maltophilia possessing various dioxygenases for monocyclic hydrocarbon degradation[J]. Braz J Microbiol, 2009, 40(2): 285-291.
[13]吴曼莉,聂麦茜,王晓昌, 等. 金属离子对多环芳烃酶促降解的影响作用[J]. 水处理技术,2008, 34(8): 13-16.
WU Man-li, NIE Mai-qian, Wang Xiao-chang,etal. Study on enzymatic degradation and enhancement of coarse endoenzyme activityexcreted fromflavobacteriumsp FCN2[J]. Technology of Water Treatment, 2008, 34(8): 13-16. (In Chinese)
[14]BAMFORTH S M, SINGLETON L. Review: Bioremediation of polycyclic aromatic hydrocarbons: current knowledge and future directions[J]. J Chem Technol Biot, 2005, 80(7): 723-736.
[15]SU H L, CHOU C C, HUNG D J,etal. The disruption of bacterial membrane integrity through ROS generation induced by nanohybrids of silver and clay[J]. Biomaterials, 2009, 30(30): 5979-5987.
[16]KE L, LUO L J, WANG P,etal. Effects of metals on biosorption and biodegradation of mixed polycyclic aromatic hydrocarbons by a freshwater green algaSelenastrumcapricornutum[J]. Bioresour Technol, 2010, 101(18): 6950-6961.
[17]HOMA J, STÜRZENBAUM S R, MORGAN A J,etal. Disrupted homeostasis in coelomocytes of Eisenia fetida and Allolobophora chlorotica exposed dermally to heavy metals[J]. Euro J Soil Bio, 2007, 43: 273-280.
[18]PARK E S, SHIN J S. Free energy analysis of ω-transaminase reactions to dissect how the enzyme controls the substrate selectivity[J]. Enzyme and Microbial Technology, 2011, 49(4): 380-387.
[19]PURICH D L. Enzyme kinetics: catalysis & control[M]. US: Elsevier Press, 2010, 335-378.
[20]GUO H J, LUO S L, CHEN L,etal. Bioremediation of heavy metals by growing hyperaccumulaor endophytic bacteriumBacillussp. L14[J]. Bioresour Technol, 2010, 101(22): 8599-8605.

