关于次甲基蓝水溶液吸附法测定颗粒活性炭比表面积实验的探讨
张国艳 金为群 王岚
(吉林大学化学学院 吉林长春130012)
在大学物理化学实验的表面和胶体部分,有一个基础实验,即次甲基蓝水溶液吸附法测定颗粒活性炭的比表面积。在本科学生实验中,之所以用溶液吸附法测定活性炭的比表面积,是因为溶液吸附法使用的仪器简单,操作方便,同时可以让学生理解Langmuir单分子层吸附原理,因而比较实用。但是现存的实验教材对其内容的表述不尽相同,有些还存在一些问题,本文将对此进行讨论和分析。
1 次甲基蓝吸附取向和端基吸附的投影面积
1.1 次甲基蓝溶液吸附法
次甲基蓝是一个具有矩形结构的分子,在水溶液中形成一价有机阳离子型的季胺盐离子,X射线衍射实验证实其阳离子的大小为17.0×10-10m×7.6×10-10m×3.25×10-10m(图1)。
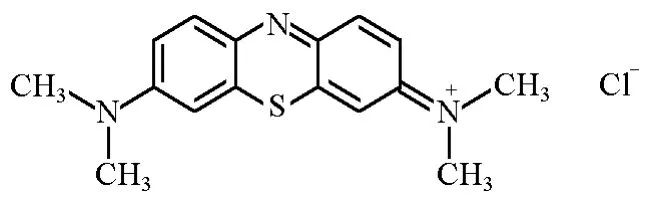
图1 次甲基蓝的分子结构
有研究表明,在大多数固体上,次甲基蓝进行单分子层吸附,即符合Langmuir型吸附。为此本实验控制原始溶液的质量分数为0.2%左右,以免出现多分子层吸附。又由于利用Langmuir理论计算比表面积需要用到单层饱和吸附量,所以平衡溶液的质量分数应该不小于0.1%。对于非石墨型的活性炭,1mg次甲基蓝所覆盖的面积是2.45m2[1]。
1.2 次甲基蓝吸附取向
对于非石墨型的活性炭,实验教材上既有次甲基蓝是以端基吸附取向的报道,也有可能不是平面吸附而是端基吸附的说法;近年来还有实验由BET比表面积测定仪测定已活化的活性炭的比表面积反推分子投影面积,证明次甲基蓝溶液在活性炭表面吸附可能不是端基吸附而是平面吸附取向[5]。我们认为这个说法值得商榷,原因有两点:(1)气体吸附法用来测量固体的比表面积,被吸附的分子应该包括能够到达固体表面的全部气体,无论外部还是内部。由于受气体分子大小的影响,通过BET法获得的吸附剂比表面积值不能反映吸附剂真实的内部表面积,只能称作表观比表面积,尤其是对于含有微孔结构样品的测定,会产生一定的误差。(2)根据S=Γ∞NAσ计算比表面积S,需要用到单层饱和吸附量Γ∞。BET理论模型认为吸附质在吸附剂表面的吸附不限于单层,可以是多层吸附。当吸附质达到饱和吸附量时,饱和吸附量要大于单层吸附容量[6-7]。所以BET理论所指的单层饱和吸附量只是一个理论值,其中公式参数C反映了吸附质与吸附剂之间作用的强弱,C值通常在50~300之间。当固体比表面积大于500m2·g-1时,如果C值超过300,则测试结果是可疑的。为了得到可靠的数据,明确次甲基蓝在活性炭上的吸附行为,应该结合X射线光电子能谱、原子力显微镜等手段展开更深入的实验研究。
1.3 次甲基蓝端基吸附的投影面积
根据S=Γ∞NAσ计算比表面积S,需要用到次甲基蓝分子的投影面积σ,所以次甲基蓝在固体表面的吸附取向与吸附位点对于应用次甲基蓝溶液吸附法测定固体比表面积的准确性方面有重要价值[2]。不同吸附剂或者同种吸附剂不同测试条件,吸附剂取向不同,投影面积就不同。次甲基蓝在固体上的吸附有3种取向,即平面吸附,投影面积为1.35×10-18m2;侧面吸附,投影面积为7.5×10-19m2;端基吸附。对于端基吸附,其投影面积在不同教材上数值不同,主要有两种情况:一种是39.5×10-20m2[3],另一种是39.5×10-19m2[4];但两种情况得到的1mg次甲基蓝覆盖的活性炭面积却都是2.45m2。对于非石墨型的活性炭,在单层吸附的情况下,根据实验结果推算,每个次甲基蓝分子的投影面积应该是39.5×10-20m2。
2 次甲基蓝标准溶液的配制
在实验教材中,配制次甲基蓝标准溶液主要有两种方案:一种是用移液管分别量取5mL、8mL、11mL 0.01%标准次甲基蓝溶液置于100mL容量瓶中,用蒸馏水稀释至100mL,即得到5×10-6、8×10-6和11×10-63种质量分数的标准溶液。然后以蒸馏水为空白溶液,分别测量这3种标准溶液的吸光度,并作图,得到吸光度-质量分数工作曲线[4]。另一种是用台秤分别称取 2g、4g、6g、8g、11g 的0.3126×10-3mol·dm-3标准次甲基蓝溶液于100mL容量瓶中,用蒸馏水稀释至刻度,然后测定其吸光度[8]。这种配制方法称重仪器应为分析天平,精度0.1mg。
配制次甲基蓝标准溶液的第一种方法有两点错误:(1)所取实验点过少,只有3个点。原则上,标准曲线的数据点一般不应少于5个。在操作过程中,可以根据被测点的浓度范围增加1~2个。对于吸光度和浓度这两个变量来说,它们在坐标平面图上的变化轨迹近似一直线,可以用最小二乘法确定回归直线方程,相关系数R的大小可以反映吸光度与浓度是否确实相关以及相关的程度。若R的绝对值越趋近于1,实验点就越靠近回归直线,吸光度与浓度的线性关系就越好,所得的回归方程才有实际意义。通常要求R值至少是3个9,即在0.9990~1.0000之间。(2)标准溶液的浓度不是在仪器的最佳线性范围,这个问题也出现在第2种配制方法以及后面测量稀释前的原始溶液和稀释后的平衡溶液的吸光度上。分光光度计的测量原理是Lambert-Berr定律,而当溶液的浓度过大时,由于分子间的相互干扰,这一定律不再成立,这就需要稀释待分析的样品溶液,使其浓度落在线性范围以内。使用WFJ72型可见分光光度计测量次甲基蓝溶液的吸光度,吸附波长应选择655nm,吸光值A至少要大于0.1,最佳的线性范围在0.3~0.7之间,多次测试的结果应该在均值1.0%之间变动。综上所述,我们建议取2mL、3mL、4mL、5mL、6mL的0.01%标准次甲基蓝溶液置于100mL容量瓶中来配制标准溶液。在实际操作中,由于次甲基蓝具有吸附性,用比色皿测量时应按照从稀到浓的顺序测定吸光度。
根据我们的实践经验,用改善后的实验方案得到的回归直线方程的相关系数很容易达到0.999,因而具有实际意义。
3 吸附时间和吸光度的关系
在以蒸馏水为空白溶液,分别测量吸附过夜平衡后次甲基蓝溶液和吸附1h平衡后次甲基蓝溶液的吸光度(A)时,有时会遇到一个异常情况,即吸附过夜平衡后次甲基蓝溶液的吸光度反而高于吸附1h平衡后次甲基蓝溶液的吸光度(表1)。
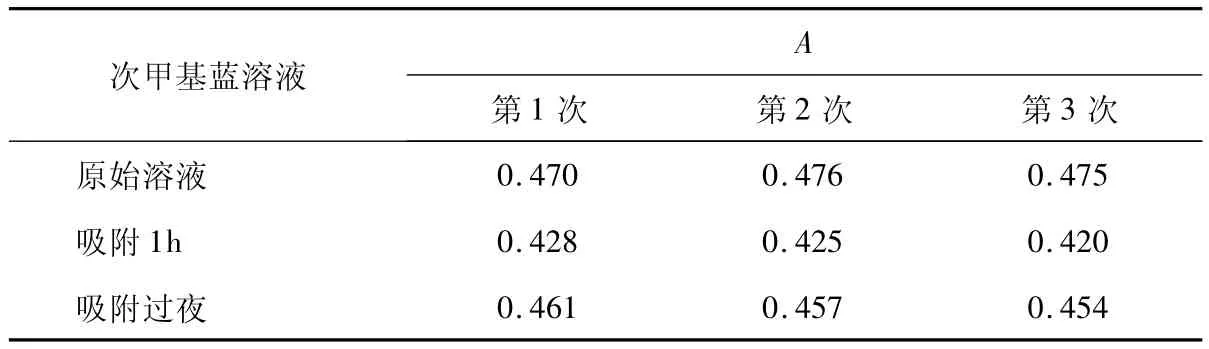
表1 吸附1h及吸附过夜平衡后次甲基蓝溶液的吸光度
从原理上讲,吸附过夜平衡后次甲基蓝溶液的吸光度应低于吸附1h平衡后次甲基蓝溶液的吸光度。产生矛盾的原因是实际操作中吸附过夜的次甲基蓝溶液是教师提前配置的。在本实验中,凡是能使质量和体积不准确的因素都会导致物质的浓度出现偏差。如果学生配制的用于吸附1h的次甲基蓝溶液不够准确,加上稀释引起的误差,就会导致实验出现错误的结论。如果学生在分析化学实验中严格按照规范进行训练,比如正确使用天平、移液管和容量瓶等,就可以避免这种现象的发生。
[1]DäArr G M,Ludwig U.Materiaux et Constructions,1973,6(33):233
[2]赵立艳,王学恺,郭玉国,等.物理化学学报,2003,19(10):896
[3]吕慧娟,吴凤清,杨桦.物理化学实验.长春:吉林大学出版社,1999
[4]刘寿长,张健民,徐顺.物理化学实验与技术.郑州:郑州大学出版社,2004
[5]华南平,倪春华.大学化学,2005,20(1):43
[6]卢晓英.现代仪器,2000,3:12
[7]北京大学化学系物理化学教研室.物理化学实验.第3版.北京:北京大学出版社,1995
[8]刘勇健,孙康.物理化学实验.徐州:中国矿业大学出版社,2005

