液滴尺寸与表面张力
刘引烽 房嫄 赵凯凯 李琛骏 杨小瑞 周海堤 王宇翔 朱逸莉 徐华根
(上海大学材料科学与工程学院高分子材料系 上海200444)
液体的滴数问题是界面化学在化学实验等实际工作中经常遇到的问题。一滴液滴的大小与液体的表面张力有关,因此一定体积的液体所具有的液滴数也与表面张力有关。学生在课程学习和复习迎考时,往往会从各种复习资料中搜集试题来加以练习和巩固。我们注意到,关于胶体化学或界面化学课程,常有关于滴数的考题。有些参考试题及其解答是正确的,有些则有误。本文通过对一个考题的分析来辨析一些基本概念。
在某大学物理化学考试试卷中有以下一道考题:在同一条件下,用同一滴管分别滴下同体积的3种液体——水、硫酸水溶液、丁醇水溶液,则它们的滴数为( )。
A.一样多 B.水的最多,丁醇水溶液最少
C.硫酸水溶液最多,丁醇水溶液最少 D.丁醇水溶液最多,硫酸水溶液最少资料中给出的答案是D,其原因分析是:因为硫酸溶液表面张力最大,可以托住的液滴质量最大,所以滴数最少;丁醇表面张力最小,可以托住的液滴质量最小,所以滴数最多。
这道考题能结合实际当然很好,但它的结论是正确的吗?我们将在下面进行分析。
表面张力与液滴大小密切相关。在表面张力的测定方法中,有一种就是采用滴重法来进行的。根据滴重法测定液体表面张力原理(Tate定律),对于表面张力为γ、半径为r、质量为m的液滴,应满足以下关系:
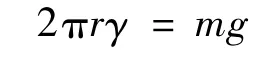
但由于液滴滴落时并非完美的球形,而是会被拉长成椭球并产生一定的液柱,部分液柱会残留于毛细管底部并不下落,因此,该式在应用时需要进行校正。校正后的方程应该是:
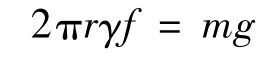
式中f是校正因子。于是,Tate方程可以写成:

对于不同的物质,每一滴的质量并不一样,它与液滴体积(V)和密度(ρ)有关,因此:

所以,液滴大小与液体表面张力和密度的关系为:

由式(3)可知,在密度、校正因子等因素一定的情况下,表面张力越大,在滴落前的瞬间,液滴的半径也越大。前面给出的考题正是想测试考生对表面张力与液滴大小关系的理解。但是,不同的液体,其密度是不同的;因此,若忽略密度的影响,则得到的结论就有可能与实际不符。接下来,我们就来看看密度的影响是否可以忽略。
考题中采用的是水溶液。对于不同物质、不同质量分数、不同温度下的水溶液,其密度和表面张力都是不同的。因此,要考虑表面张力和密度的共同影响,就必须结合实例进行分析。
首先分析NaCl水溶液的情况。NaCl水溶液的密度和表面张力的数据可查阅《日用化工理化数据手册》[1]、《物理化学手册》[2]或《海水利用手册》[3]等。以《物理化学手册》为例,可由其中的数据得到NaCl水溶液密度与NaCl质量分数的关系曲线(图1)以及表面张力随NaCl质量分数的变化曲线(图2)。席华在1997年发表的论文[4]中给出了NaCl水溶液的密度、表面张力和沸点与温度及NaCl质量分数间的经验关系式。其中NaCl水溶液的密度ρ与NaCl质量分数(w(NaCl))及温度(t)的关系为:
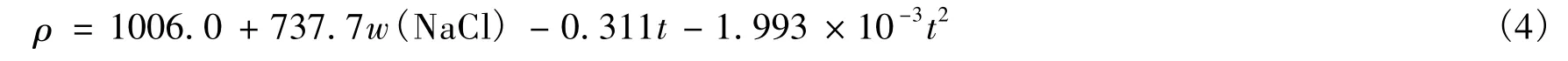
NaCl表面张力与NaCl质量分数及温度的关系式为:
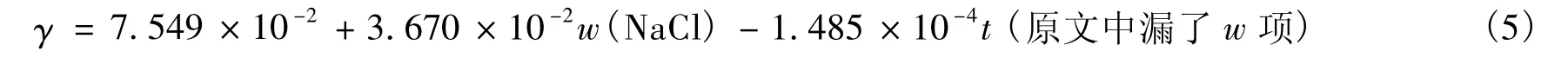
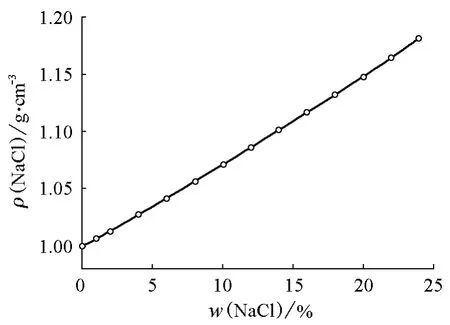
图1 NaCl水溶液密度随NaCl质量分数的变化关系
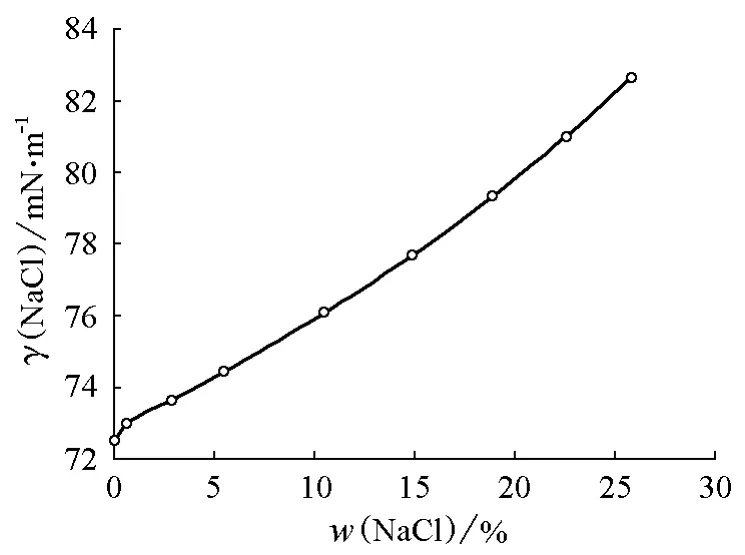
图2 NaCl水溶液表面张力随NaCl质量分数的变化关系
根据式(4)和式(5),得到NaCl水溶液在20℃、不同NaCl质量分数下的密度与表面张力数据,如表1所示。

表1 NaCl水溶液表面张力及密度随NaCl质量分数的变化计算值
假定校正因子不随液滴尺寸而变,则NaCl水溶液的液滴半径(r2)与纯水的水滴半径(r1)之比可表示为:

代入20℃下不同质量分数时NaCl溶液的密度与表面张力值,以及水的密度与表面张力值,就可以算出NaCl溶液液滴半径与水滴半径之比。由此我们得到二者液滴半径之比随NaCl质量分数的变化曲线,如图3所示,NaCl溶液液滴尺寸小于纯水的液滴尺寸,且随着NaCl质量分数增加,其液滴尺寸逐渐减小,并接近于线性变化。
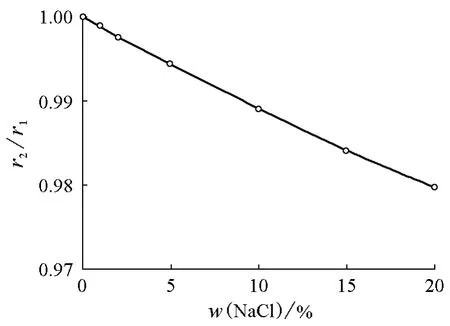
图3 NaCl液滴半径与纯水液滴半径之比随NaCl质量分数的变化关系
按理说,NaCl溶液表面张力大于纯水的表面张力,应该能托住更多的液滴,为什么会出现表面张力增大而液滴的半径反而降低的情况呢?
这就是密度的贡献。尽管随着NaCl质量分数增加,表面张力会更大,可以托起更多的液体,但这个“更多”是以重力而不是以体积来衡量的。由于溶液密度随质量分数增加而增加的幅度更大,因此,其液滴尺寸反而更小了。
产生这一现象的根本原因在于溶质NaCl是高表面张力物质。根据表面吸附原理,表面张力高的物质在表面因为是负吸附的关系,很少“停留”;因此,随着质量分数增大,溶液的表面张力增大并不多,但密度受质量分数的影响更大,因此密度增大使液体体积降低的程度超过了表面张力增大对液滴体积增大的贡献,这就造成了NaCl质量分数增大,液滴体积反而变小的结果。

图4 H2SO4水溶液密度随H2SO4质量分数的变化关系

图5 H2SO4水溶液表面张力随H2SO4质量分数的变化关系
下面再来看看硫酸溶液的情况。由文献可查得硫酸水溶液的密度及表面张力随质量分数变化的数据,但由于这些数据不在同一质量分数上,因此需要使用一些外推数据。图4和图5上的数据点是从手册直接查到的数据,由此可以直观地看出其变化趋势;然后通过其变化趋势在曲线上取点,可以估算出液滴半径随质量分数的变化(图6)。由图6可以看出其规律与NaCl溶液的规律是一致的,但液滴尺寸降低得比NaCl溶液更快。其他无机物溶液情况也大致如此。
盐酸水溶液的表面张力比较特殊,随质量分数增大,其表面张力是下降的(图7),而其密度是随着质量分数的增大而增加的。因此,其液滴半径随着质量分数的增大应该降低得更快。
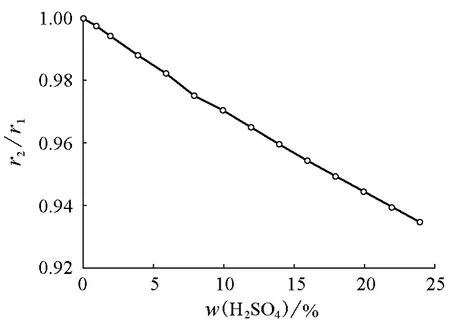
图6 H2SO4液滴半径(r2)与水滴半径(r1)之比随H2SO4质量分数的变化关系
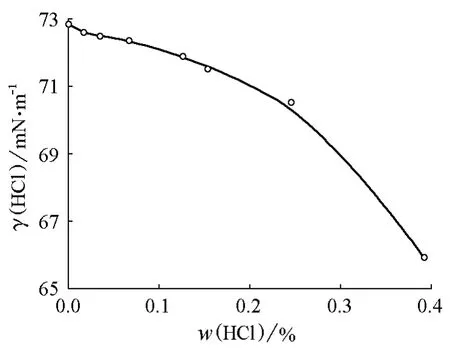
图7 HCl水溶液表面张力随HCl质量分数的变化关系
对于丁醇等有机物溶液,由于其表面张力低于水的表面张力,因此其水溶液表面张力将会下降。溶液中的丁醇质量分数越大,水溶液表面张力越低,也即随着丁醇质量分数的增大,表面张力能够托起的液体的量会逐渐减小。但由于丁醇密度也比水小,溶液的密度是随丁醇质量分数的增大而减小的,因此尚不能一概而论地认为其液滴体积也变小,还需要考虑密度的影响。
我们可以利用手册查找或自行实验获得丁醇水溶液表面张力与质量分数的关系,也可以利用Traube规则或希什科夫斯基经验公式来估算丁醇溶液表面张力随质量分数的变化,结合丁醇水溶液密度[6]数据来计算不同质量分数下丁醇水溶液液滴大小。计算结果如图8所示。可见,丁醇水溶液液滴半径随质量分数增大也是减小的,但不是直线关系。与硫酸溶液(图6)对比可知,丁醇液滴尺寸随质量分数的增加降低得更快、更明显。由此可知,在有机物水溶液中,密度的影响是次要的,表面张力因素更为重要。这是因为丁醇等有机物的表面张力比水低,在水溶液中将产生正吸附,有机分子将尽量停留在溶液表面,以降低体系的表面能。这种效应使溶液的表面张力下降非常明显,从而使液滴尺寸的下降也非常明显。
综上所述,在硫酸水溶液、HCl水溶液和丁醇水溶液的液滴半径均随溶液浓度增大而降低,其中有机物丁醇水溶液降低幅度最大,其次依次是硫酸溶液、NaCl溶液和HCl溶液。在考题的3种液体中,水的液滴是最大的,其次是硫酸溶液,最小的是丁醇水溶液。因此在相同体积的液体情况下,水的液滴数最少,丁醇的液滴数最多,习题解答给出硫酸溶液液滴数最少是不正确的。由于出题人没有给出密度的数值,考生无法考虑密度的影响,但单纯考虑表面张力因素的影响得到的结论与实际并不相符。
对于纯液体的情况又如何呢?我们以苯滴和水滴为例。查到苯和水的密度及表面张力数据,代入相关方程即可以获得苯的液滴半径与水滴半径之比的数值,如表2所示。

图8 丁醇水液滴与水滴半径之比随丁醇质量分数的变化关系
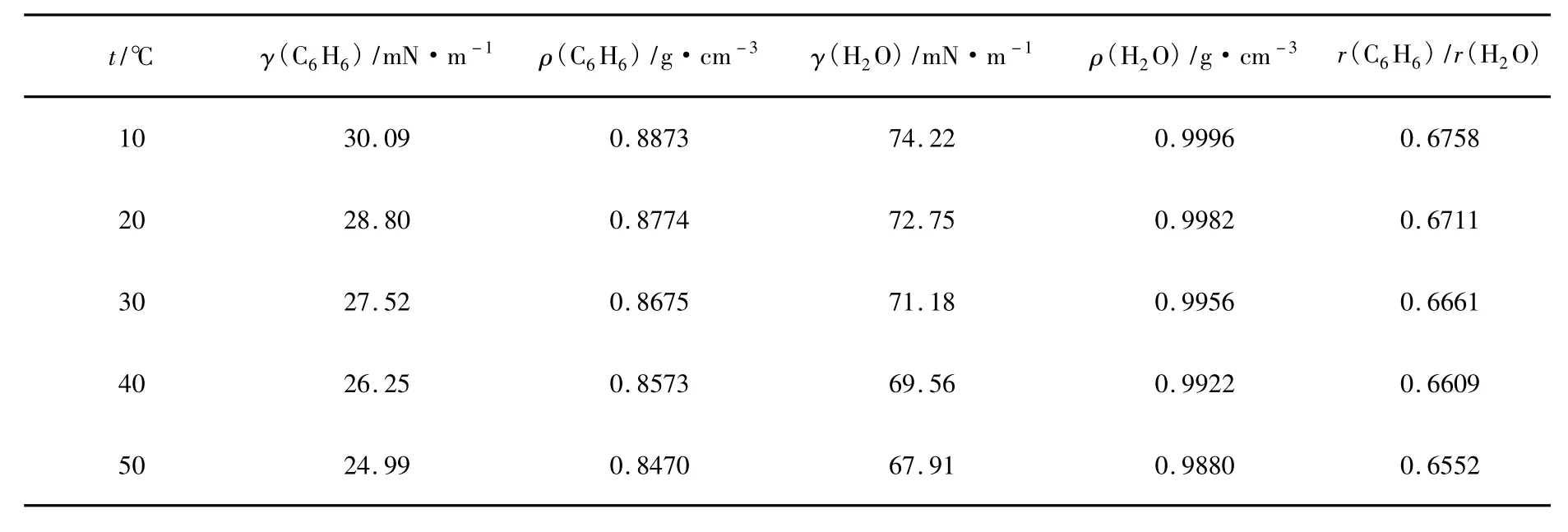
表2 不同温度下纯液体苯和纯水表面张力与密度的变化值[6]
由表2可见,各温度下,苯的液滴都比水滴小,这是因为苯的表面张力比水小很多,尽管其密度也低,但二者综合作用的结果是表面张力的作用占主导,密度的影响相对较小。
对大多数有机物而言,其表面张力与水相比要低很多,而密度与水相比差别较小,因此表面张力所起作用较大,液滴半径主要受表面张力影响。
回到文章开头的那道试题,其实只要将题目中的“同体积”条件改为“同质量”,则所给出的答案就是正确的。
[1]轻工部设计院.日用化工理化数据手册.北京:轻工业出版社,1988
[2]姚允斌,解涛,高英敏.物理化学手册.北京:上海科学技术出版社,1985
[3]日本海水学会.海水利用手册.东京:阿之玛堂印刷株式会社,1974
[4]席华.天津轻工业学院学报,1997(2):72
[5]Myhre C E L,Nielsen C J,Saastad O W. J Chem Eng Data,1998,43:617
[6]程能林.溶剂手册.北京:化学工业出版社,2008

