以结构为主线结合对比法进行杂环化合物教学*
王兰英 王云侠 李剑利
(西北大学化学与材料科学学院 陕西西安710069)
杂环化合物是数目最庞大的一类有机化合物。许多药物属于杂环化合物,对生命体系起着非常重要的作用。杂环化合物也是专业基础课程有机化学中的一部分重要内容。但一方面由于有机化合物中的杂环化合物种类繁多,数目庞大,内容庞杂,学生一看到杂环就很抵触;另一方面,目前在“少而精,博而通”的教学理念引导下[1],杂环化合物内容要在3~4学时内讲授完。再加上介绍杂环化合物章节的时候已经接近期末考试,此时学生急于复习考试,焦躁不安,听课效果很差。在这样的背景下,如何在短时间内教给学生学习方法,使抽象枯燥,难于理解、记忆和接受的内容变得生动有趣且易于接受和掌握,并让学生掌握杂环化合物的相关知识,提高课堂教学效果,是承担有机化学课程教学的教师值得思考和研究的课题。下面在笔者多年教学实践的基础上,谈谈加强和提高杂环化合物教学的一些理念和做法。
1 以结构决定性质的理念分析杂环化合物的通性
杂环化合物可分为有芳香性的和没有芳香性的。有芳香性的杂环化合物,即芳香杂环化合物,是杂环化合物章节主要讨论的内容。芳香杂环化合物种类繁多,数目庞大,可根据环大小、杂原子的多少、单环和稠环等来分类[2-5]。针对数目庞大的芳香杂环化合物,理出一条思路并找出一种方法进行行之有效的教学,是杂环化合物教学的关键。多年的科学研究和教学研究使我们清楚地知道,进行化学科学研究的一个基本理念或核心思想是“结构决定性质,性质是结构的表现形式”。因此,我们在授课时从结构入手,分析杂环及其衍生物的结构特点,并由此推测其基本性质和反应。这样就把种类繁多的杂环化合物的性质与反应有机地联系起来,从总体上把握住杂环化合物的本质,举例说明如下。
1.1 五元杂环吡咯、呋喃和噻吩的结构以及性质和反应
首先画出吡咯、呋喃和噻吩的结构(图1)。学生可以从图中看出环上的原子均为sp2杂化,没有杂化的p轨道侧面重叠、交盖形成了闭环共轭体系,属平面结构;再向学生强调环上杂原子N,O和S的p轨道上各有一对电子参与环的共轭,π电子数为6,符合4n+2规则,具有芳香性,与比较熟悉的典型的芳香族化合物苯类似。由此可推测五元杂环化合物吡咯、呋喃和噻吩的主要反应是亲电取代反应。
再将苯与五元杂环化合物吡咯、呋喃和噻吩的结构进行比较,苯属6个原子6个电子的π体系,而吡咯、呋喃和噻吩属于5个原子6个π电子的π体系,即五元杂环吡咯、呋喃和噻吩π电子云密度较苯大,所以五元杂环吡咯、呋喃和噻吩的亲电取代活性大于苯。
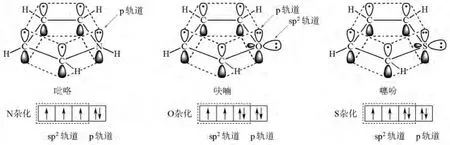
图1 吡咯、呋喃和噻吩的结构
接着我们和学生一起对吡咯、呋喃和噻吩中杂原子的电负性大小、半径大小进行分析:杂原子的吸电子诱导大小顺序为:O>N>S;给电子共轭为:N>O>S;综合结果:N贡献电子最多,O其次,S最少。因此,五元杂环化合物吡咯、呋喃和噻吩的电子云密度及亲电取代活性大小为:吡咯>呋喃>噻吩。
此外,由于吡咯环中N的没有杂化的p轨道上有一对电子参与了环的共轭,使N周围电子云密度降低,N—H的σ电子偏向N,所以吡咯环中N上的H有弱酸性,因此,吡咯能与强碱(如NaNH2,KNH2,RMgX)或碱金属(如Na、K)作用。
1.2 五元杂环咪唑、噁唑和噻唑的结构以及性质和反应
咪唑、噁唑和噻唑实际上就是吡咯、呋喃和噻吩的3号CH分别换成N后得到的(图2)。3个唑类化合物也有芳香性,能发生亲电取代反应,只是由于N的电负性比C大,造成这3个唑类化合物咪唑、噁唑和噻唑的π电子云密度分别小于五元杂环吡咯、呋喃和噻吩,那么相应的亲电取代反应活性也小。此外,学生还可从结构上看出,3个唑类化合物的3号N的sp2杂化轨道上有一对电子没有参与环的共轭,既可提供接受质子的位置,也可提供接受带正电的碳实体的位置,所以咪唑、噁唑和噻唑既具有碱性,又具有亲核性。此外,咪唑1号N的给电子共轭和3号N的吸电子诱导使得咪唑的酸性大于吡咯,因此,咪唑既具有酸性,也具有碱性;也因此咪唑分子间能形成氢键。
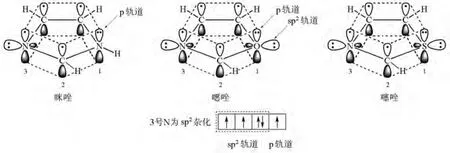
图2 咪唑、噁唑和噻唑的结构
1.3 六元杂环吡啶的结构以及性质和反应
吡啶的结构见图3,它与苯相似,具有芳香性,可以发生亲电取代反应;但由于N的吸电子作用,使其π电子云密度小于苯,其亲电取代反应活性也小于苯,类似于硝基苯,所以吡啶只能在3位和5位发生卤代、硝化和磺化,不易发生傅氏烷基化和傅氏酰基化反应。再由于N的吸电子共轭作用,使吡啶环2,4,6位的碳带部分正电荷,若吡啶环2,4,6位上有卤素,则卤素容易被亲核试剂取代,甚至吡啶环2位的负氢也可被强亲核试剂取代(Chichibabin反应)。若吡啶环2,4,6位上有烷基,则烷基的α-H具有活性,其活性与甲基酮的α-H相同,能在酸或碱催化下发生亲核反应(如与醛、酮发生亲核加成,与卤代烷发生亲核取代,与羧酸酯发生亲核加成-消除反应等)。从吡啶的结构中还可看出,吡啶N的sp2杂化轨道上有一对电子没有参与环的共轭,因此,既可与质子结合而显碱性,又可与带正电的碳实体结合而具有亲核性。
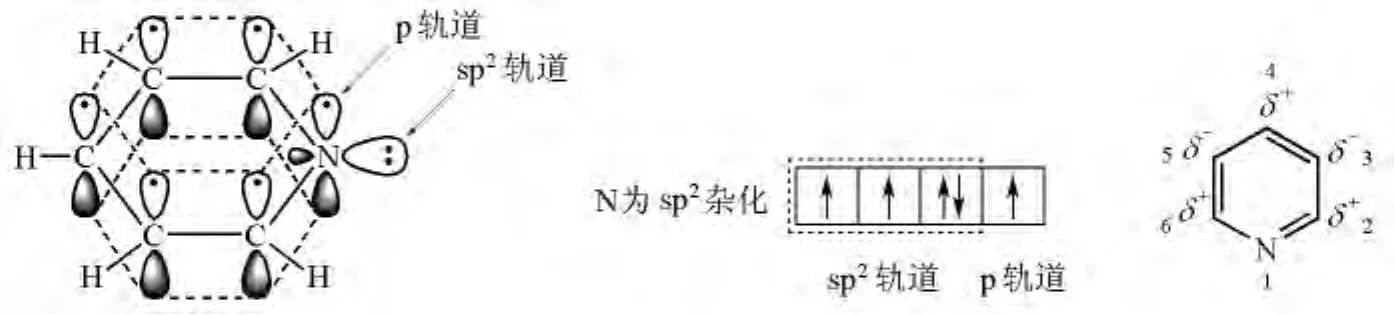
图3 吡啶的结构
1.4 杂环亲电取代反应中间体的结构以及亲电取代反应位置选择性[4-5]
用与推测取代苯发生亲电取代反应的区域选择性的相同方法,根据杂环亲电取代反应所得中间体结构,可以推出亲电取代反应主要发生在杂环上的位置(位置选择性)。例如:对于五元单杂环吡咯、呋喃和噻吩(图4),环中有两种碳,当亲电试剂进攻2位时,得到的中间体是由3个极限式结构共振杂化成的;而进攻3位得到的中间体则是由两个极限式结构共振杂化成的。参与共振杂化的极限式结构越多,电子或电荷离域范围越广,杂化体中间体正离子越稳定。稳定的中间体正离子的过渡态势能低,活化能小,反应速率快,因此五元单杂环亲电取代反应容易在2位发生。
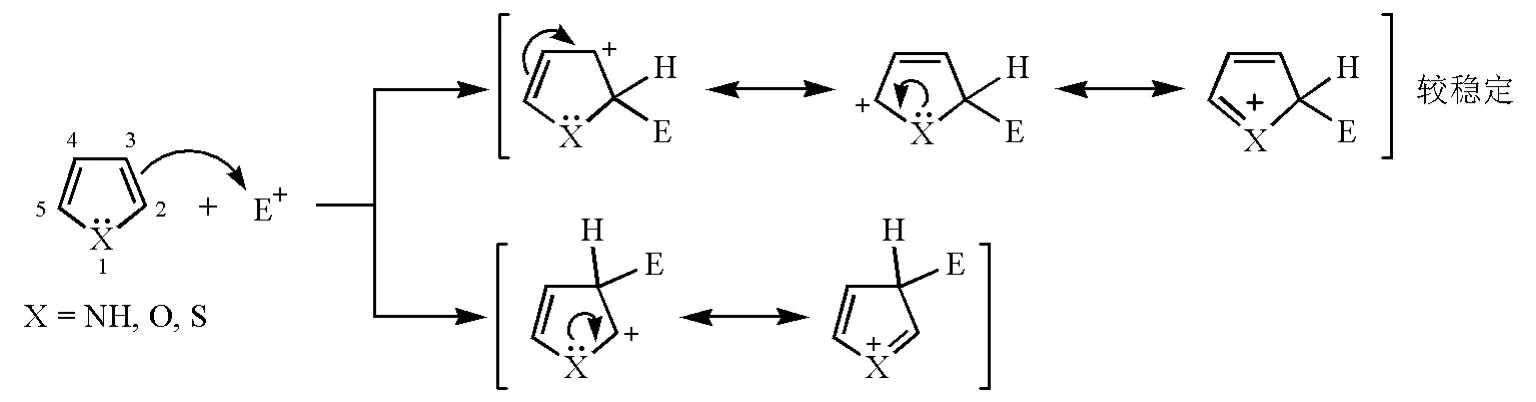
图4 五元单杂环化合物的亲电取代反应及其中间体结构

图5 苯并五元杂环化合物的亲电取代反应及其中间体结构
对于苯并五元杂环苯并呋喃、苯并噻吩和吲哚(图5),亲电试剂进攻电子云密度较大的五元杂环。当进攻2位时,得到带有完整苯环的稳定极限式结构只有一个;而进攻3位时,得到带有完整苯环的稳定极限式结构有两个。参与共振杂化的稳定的极限式结构越多,中间体正离子越稳定;但中间体正离子稳定性还与正电荷所在原子的电负性大小有关。氧原子电负性大,氧原子带正电荷很不稳定,氧原子相邻碳原子上带正电荷也不太稳定;氮原子电负性小,8电子的带正电荷的氮相对于8电子的带正电荷的氧来说是比较稳定的;而带正电荷的硫原子的稳定性介于带正电荷的氧和带正电荷的氮之间。因此,苯并呋喃在2位上发生反应;吲哚在3位上发生反应;苯并噻吩可以在2位和3位上发生反应,而主要是在3位上发生反应。
对于喹啉(图6),亲电试剂进攻电子云密度较大的苯环。当亲电试剂进攻5位或8位时,得到的中间体中有两个能保留吡啶环稳定的极限式结构;而进攻6位或7位时,中间体中只有一个能保留吡啶环稳定的极限式结构参与共振。前者的中间体正离子稳定,过渡态势能低,所以喹啉的亲电取代反应发生在5位和8位。

图6 喹啉的亲电取代反应及其中间体结构
同样,我们根据反应得到的中间体结构的稳定性可以推出:吡啶的亲电取代反应发生在3位和5位,亲核取代发生在2位、4位和6位;喹啉的亲核取代反应发生在电子云密度较小的吡啶环上,而且在2位和4位发生。
通过以上分析,学生可以根据杂环化合物的结构特点,对杂环化合物的性质、反应活性和反应的位置选择性有较系统的了解,为后面的深入学习打下良好的基础。
2 以对比法帮助学生理解杂环化合物的反应
对比法是将两个或两个以上的事物进行比较,找出其相同点和不同点,通过比较、鉴别,把不同的事物从内部有机地联系起来。在教学中运用对比法可以使学生在面对新知识的学习时,能有效摆脱陌生感,迅速找到轻松入门的途径,使抽象枯燥的难于理解、记忆和接受的内容变得生动有趣,一目了然且易于接受和掌握,提高学习效率;还可以加深学生对知识的理解,使概念明晰化,理论广延化,点状知识连续化,平面知识立体化。
在杂环化合物教学中,我们以结构为基础,采用对比法组织教学,以电子结构理论分析、引导学生通过熟悉的化合物结构来推测杂环化合物具有的化学反应性。现举例说明如下:
(1)与苯对比,分析五元杂环、六元杂环以及稠杂环的反应性。
通过分析杂环化合物与苯在结构上的差异,可知:①杂环化合物亲电取代活性顺序为:五元杂环吡咯、呋喃和噻吩>苯>吡啶,从而推出五元杂环吡咯、呋喃和噻吩能在较温和的条件下发生亲电取代反应,而六元杂环吡啶需在较强烈的条件下才能发生亲电取代反应。如噻吩在室温下即能与硫酸发生磺化反应,但在相同条件下苯却很难发生反应;吡咯在低温下,用比较温和的非质子硝化试剂(如硝酸乙酰酯)可以进行硝化,苯需要用混酸(如浓硝酸加浓硫酸)在50℃才能反应,而吡啶用混酸在300℃反应1天才能得到极少的3-硝化吡啶。相反,吡啶不容易发生亲电取代反应,但容易发生亲核取代反应。如吡啶与氨基钠反应生成2-氨基吡啶(即发生了2位负氢被氨基取代的亲核取代反应)。②苯环上电子云分布均匀,其一元取代产物只有一种。而杂环类化合物由于环中含有杂原子,导致其上的电子云分布不均匀,故反应产物不只一种。如苯硝化其一元取代产物只有硝基苯,而吡咯硝化除了得到主要产物2-硝基吡咯外,还得到少量的3-硝基吡咯。
通过比较五元杂环(吡咯、呋喃和噻吩)、六元杂环(吡啶)和苯的结构,学生可进一步推测稠杂环化合物的反应性。当五元杂环与苯环稠合形成杂环化合物时,由于五元杂环的电子云密度大于苯环,所以其亲电取代反应发生在五元杂环上;当六元杂环与苯环稠合形成杂环化合物时,六元杂环的电子云密度低于苯环,其亲电取代反应发生在苯环上,而其亲核取代反应发生在杂环上。如吲哚硝化发生在吡咯环上,得到3-硝基吲哚;喹啉硝化发生在苯环上,得到5-硝基喹啉和8-硝基喹啉;喹啉与氨基钠在液氨中反应,得到2-氨基喹啉和4-氨基喹啉。
(2)对不同杂环化合物进行对比,分析各个杂环化合物的反应性。
比较各杂环化合物结构上的差异,以找出各杂环化合物的反应特点。例如五元杂环吡咯、呋喃和噻吩,由于所含杂原子不同,使其电子云密度大小不同,根据1.1节分析,其亲电取代活性大小顺序为:吡咯>呋喃>噻吩;它们与三氟乙酐反应的相对反应速率是:吡咯5.5×107,呋喃1.4×102,噻吩1。又如:五元杂环吡咯、呋喃和噻吩的芳香性(稳定性)不同,由离域能大小(吡咯87.8kJ/mol,噻吩121.3kJ/mol,呋喃66.9kJ/mol)可知,吡咯和噻吩的芳香性较强,而呋喃的芳香性较弱,具有一定的共轭二烯的性质,与亲双烯体可发生典型的共轭二烯反应——Diels-Alder反应,吡咯、噻吩则不容易发生此反应。再如:吡咯与吡啶分子中都含有一个杂原子N,且都是sp2杂化,吡咯中氮原子上的一对电子处于没有杂化的p轨道上,参与了环的共轭,故不能与质子或带正电荷的实体碳结合,没有明显的碱性、亲核性;而吡啶氮原子上的一对电子处于sp2杂化轨道上,没有参与环的共轭,可与质子及带正电荷的实体碳结合,显示碱性和亲核性。
总之,可以在杂环化合物的教学中,以结构为主线,结合对比教学法进行讲授,使学生在有限的时间里掌握学习杂环化合物的方法,培养学生运用所学知识分析问题和解决问题的能力。
[1]黑恩成.化工高等教育,2010(2):1
[2]李艳梅,赵圣印,王兰英.有机化学.北京:科学出版社,2011
[3]胡宏纹.有机化学.第3版.北京:高等教育出版社,2006
[4]邢其毅,徐瑞秋,周政,等.有机化学.第2版.北京:高等教育出版社,2000
[5]VollhardtKPC,SchoreNE.有机化学:结构与功能.第4版.戴立信,席振峰,王梅祥等译.北京:化学工业出版社,2006

