干细胞Nanog蛋白在食管癌组织中的表达及意义
肖军兰 曾金林 湛曦 余燕琪
临床治疗食管癌方法较多,但比较传统,未显著改善患者的5年生存率[1-3]。本文回顾性分析2012年1月-2014年1月在本院接受治疗的70例食管癌患者,收集其临床资料、癌组织及癌周围正常组织的标本等资料,并分析干细胞Nanog蛋白在食管癌组织中的表达及其意义。现将情况报道如下。
1 资料与方法
1.1 一般资料 选择2012年1月-2014年1月在本院接受治疗的食管癌患者70例,收集其临床资料、癌组织及癌周围正常组织的标本等资料。所有患者均符合食管癌的临床诊断标准,所有患者均初发,手术前未接受化疗及放疗。其中男41例,女29例,年龄44~81岁,平均(62.65±5.24)岁。按照WHO组织学分型分级标准,将其分为19例高分化,26例中分化,25例低分化;39例有淋巴结转移,31例无淋巴结转移;TNM分期:Ⅰ期10例,Ⅱ期18例,Ⅲ期42例。
1.2 方法
1.2.1 采集标本 选择70例食管癌患者癌细胞组织标本、与癌组织边缘距离大于5 cm的癌周围组织标本。将两组标本用4%多聚甲醛固定,进行常规石蜡包埋。食管癌细胞系Eca-109及TE-1均采自细胞库。
1.2.2 食管癌组织Nanog蛋白检测 采用免疫组化PV二步法,用Nanog阳性蛋白染色精原细胞瘤进行阳性对照,使用PBS进行阴性对照[4]。具体操作方法如下:先进行常规脱蜡至水,使柠檬酸抗原微波修复之后,逐渐冷却;再分别滴加一抗和二抗孵育。其中一抗要用1:400稀释,二抗要用1:100稀释。待DAB显色之后,依次进行脱水、透明及封片。之后在高倍镜辅助下,选择不同视野,分别计数癌细胞200个,根据阳性细胞所占数量计算百分比:强阳性,即阳性细胞大于50%,为棕褐色;中度阳性,即阳性细胞在30~50%之间,为棕黄色;弱阳性,即阳性细胞低于30%,为浅黄色;阴性,即没有阳性细胞。
1.2.3 食管癌细胞系Eca-109及TE-1检测 应用免疫荧光技术[5]。具体措施为:将食道癌细胞置于培养基中进行培养,培养基含有10%胎牛血清,细胞在5% CO2、37 ℃的细胞培养液中进行培养,生长至80%融合时再传代。胰酶消化完毕后要摇均匀,接种后用5% CO2孵箱培养过夜,并用4%多聚甲醛固定牢固,其中一抗孵育过夜,二抗避光孵育2 h,再避光复染15 min。用PBS清洗后,进行荧光照相,利用高倍镜观察,随机选择12~18个视野,计数500个细胞中核表达阳性染色的细胞数量,从而准确计算核表达的阳性细胞率。
1.3 统计学处理 采用SPSS 18.0统计学软件对所得数据进行分析,计量资料以(±s)表示,比较采用t检验,计数资料采用 字2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 食管癌组织Nanog蛋白表达 癌周围正常组织Nanog蛋白主要呈现低水平表达,阳性反应主要存在细胞质内部;食管癌组织中的Nanog蛋白表达主要在细胞质内部,颜色为棕黄色,呈颗粒状,阳性率与组织恶性程度呈正比,即组织恶性程度越高,阳性率越高,Nanog蛋白在细胞核中的表达逐渐增多,尤其是在低分化细胞核中,其Nanog蛋白阳性率高达45.7%(32/70),癌周围正常组织仅为12.86%(9/70)。两者比较差异有统计学意义(P<0.05)。
2.2 食管癌组织Nanog蛋白表达和临床病理的关系 食管癌组织中的Nanog蛋白表达水平和食管癌病理分期、分化程度及淋巴结转移有明显关系(P<0.05),见表1。
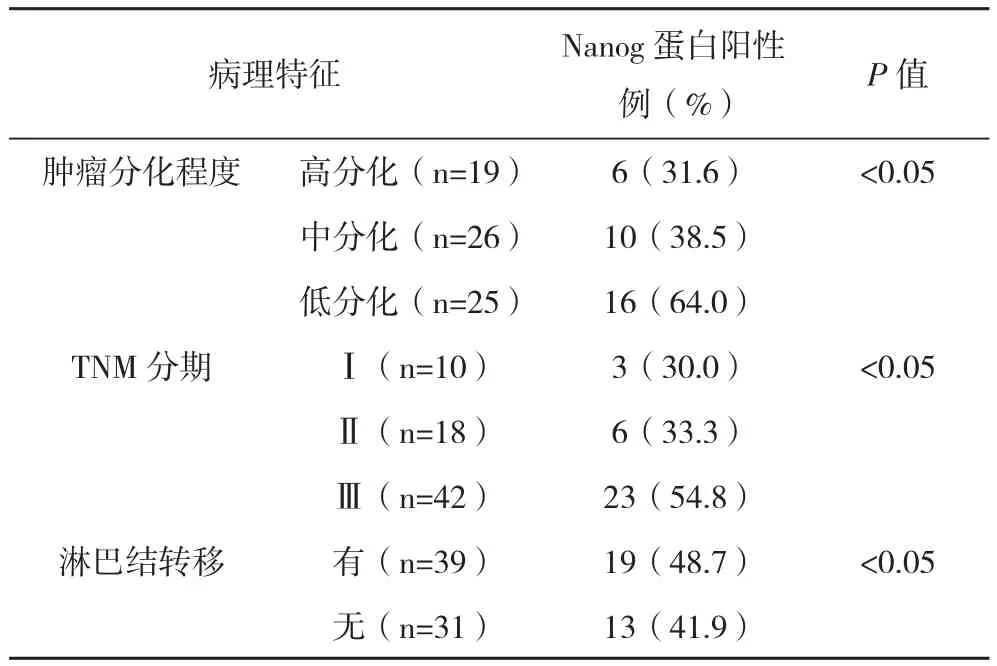
表1 食管癌组织Nanog蛋白表达和临床病理的关系
2.3 食管癌细胞系Nanog蛋白表达 食管癌细胞系Eca-109及TE-1的Nanog阳性蛋白表达水平较高,存在异质性,多数细胞以细胞质表达为主,少数则以细胞核表达为主,且细胞核表达阳性率为10%。
3 讨论
Nanog是胚胎干细胞中参与干细胞分化的转录因子,它作为维持干细胞增殖的关键基因、干细胞生物学标志,引起医学专家的很大重视[5-7]。有研究结果认为,Nanog蛋白在体细胞肿瘤、生殖细胞肿瘤中,均有表达,且对肿瘤的治疗、转移、复发及预后等产生重要影响[8]。经分析,Nanog蛋白过表达或许是时肿瘤组织产生耐药性的重要原因[9]。本次研究,通过检测Nanog蛋白在食管癌组织及癌周组织中的表达水平,结果表明Nanog蛋白在正常组织中的少量表达主要集中在食管黏膜基底层细胞中的细胞质表达,原因可能是基底层细胞具备干细胞的特点,属于增生层,而Nanog蛋白能够控制细胞增殖活动。食管癌组织Nanog蛋白呈高水平表达,其阳性率与组织恶性程度呈正比,病理分期和淋巴结转移增加、肿瘤分化程度降低,Nanog蛋白表达便会升高[10]。
大部分细胞Nanog蛋白表达主要集中在细胞质,少许在细胞核表达[11-13]。本研究检测结果显示,食管癌细胞系Eca-109及TE-1的Nanog阳性蛋白表达水平较高,以细胞质为主,含少量细胞核,说明肿瘤干细胞含有少量以核表达为主的细胞。
综上所述,干细胞Nanog蛋白在食管癌组织中的表达水平,和食管癌病变的发生、发展及转移情况有密切关系。
[1]苏鹏,刘洪峰,石磊芝.干细胞Nanog蛋白在食管癌组织中的表达及意义[J].山东医药,2013,57(33):26-27.
[2]郑娇娇,吴清明,陈建华,等.P162对食管癌细胞株Eca109的放射增敏作用及其对p75-(NTR)表达的影响[J].中国病理生理杂志,2013,29(1):103-107.
[3]赵生霞,黄燕燕,慕晓玲.食管癌Eca109单克隆细胞株的干细胞特性研究[J].石河子大学学报(自然科学版),2013,31(2):197-201.
[4]汪建林,孙志强,于静萍,等.食管癌细胞株中肿瘤干细胞样细胞的分离培养及生物学鉴定[J].南京医科大学学报(自然科学版),2013,58(10):1362-1367.
[5]张建华,宋铁牛,李斌,等.艰难梭菌A毒素对食管癌干细胞损伤的研究[J].中国现代医学杂志,2013,19(25):16-19.
[6]刘富磊,齐博,赵宝生,等.人脐带间充质干细胞裂解液在体外对食管癌EC9706细胞增殖与迁移的抑制作用[J].新乡医学院学报,2014,31(4):248-252.
[7]吴林,郑永平,孔晓霞,等.负载HPV18E7基因脐带血树突状细胞的体外抗食管癌研究[J].中华临床医师杂志(电子版),2010,4(12):2468-2473.
[8]李珂,龙辉,王洁莲,等.钼对人食管癌细胞ECA-109的化疗增敏作用及对食管癌干细胞p75-(NTR)的影响[J].世界华人消化杂志,2012,20(11):959-963.
[9]李步强,慕晓玲.食管肿瘤干细胞的研究进展[J].中国现代医药杂志,2011,13(3):124-125.
[10]陈琦,吴清明,程静,等.冬凌草甲素对食管癌干细胞放射增敏作用的研究[J].中国现代医学杂志,2012,18(29):57-60.
[11]朱孝中,刘德森,俞力超,等.人食管癌间充质干细胞对食管癌细胞株Eca-109侵袭性的影响[J].实用临床医药杂志,2012,16(22):18-20.
[12]解智慧,何炜,王峰,等.干细胞转录调控因子SOX2在食管鳞癌中的表达及其与临床预后的关系[J].西安交通大学学报(医学版),2013,54(3): 361-365.
[13]唐朝锋,马月琴.102例晚期食管癌患者紫杉醇联合顺铂治疗观察[J].中国医学创新,2011,8(1):160-161.

