Tc-DOTA-hTERT ASON甲状腺未分化癌小鼠模型SPECT显像分析
雷又鸣,朱高红,袁放,刘曦娇,宋彬,任炳秀
(1.昆明医科大学第一附属医院 干疗外科,云南 昆明 650032;2.昆明医科大学第一附属医院 核医学科,云南 昆明 650032;3.四川大学华西医院 放射科,四川 成都 610041)
Tc-DOTA-hTERT ASON甲状腺未分化癌小鼠模型SPECT显像分析
雷又鸣1,朱高红2,袁放3,刘曦娇3,宋彬3,任炳秀2
(1.昆明医科大学第一附属医院 干疗外科,云南 昆明 650032;2.昆明医科大学第一附属医院 核医学科,云南 昆明 650032;3.四川大学华西医院 放射科,四川 成都 610041)
目的探索以核医学方法对甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)细胞的端粒酶活性进行体内显像的可行性。方法采用甲状腺未分化癌细胞(ARO)建立荷瘤裸鼠模型,以 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-Tetraazacyclododecane-N,N′,N″,N‴-tetraacetic acid,DOTA)作为双功能螯合剂对人端粒酶逆转录酶反义寡核苷酸(human telomerase reverse transcriptase antisense oligonucleotide,hTERT ASON)进行99mTc间接标记,制备DOTA-hTERT ASON,并对肿瘤模型进行单光子发射计算机断层显像(single photon emission computed tomography,SPECT)显像。结果99mTc-DOTA-hTERT ASON对ARO移植瘤具有良好的靶向性,最佳显像时间为注射后2~8 h。结论99mTc-DOTA-hTERT ASON可对活体内ATC细胞的端粒酶进行检测,在ATC的诊断及治疗方面具有潜在的价值。
99mTc;甲状腺未分化癌;端粒酶;反义显像
端粒是位于染色体末端的DNA重复序列,其可解决染色体末端的复制问题。随着细胞的分裂,端粒会越来越短,当端粒缩短到危机期(M2期)时最终导致基因排列紊乱而致使端粒酶的激活或产生其它肿瘤发生所必需的突变使细胞永生化,从而导致癌变[7-10]。端粒酶包含有2个最重要的亚单位——端粒酶RNA元件(TRC:含有合成端粒重复序列的模板)和端粒酶逆转录酶(telomerase reverse transcriptase,TERT),端粒酶全酶通过TRC与端粒的重复序列相连接;研究表明,TERT的表达与端粒酶的活性密切相关,因此探测TERTmRNA的表达被认为是诊断肿瘤更为可靠的标志[11-12]。本研究利用99mTc标记的hTERT ASON对ATC的端粒酶活性进行活体内显像,以期为hTERT ASON介导的核素内照射治疗提供理论基础。
1 材料与方法
1.1 实验材料 全链硫代修饰的hTERT ASON(序列为:5’-TAGAGACGTGGCTCTTGA-3’)购 自 中 国 金 斯 瑞 公 司,99mTcO4-淋洗液购自北京原子高科股份有限公司,N-羟丁基硫代琥珀酰亚胺(N-Hydroxysulfosuccinimide Sodium,S-NHS)、1,4,7,10-四 氮 杂 环 十 二 烷-1,4,7,10-四 乙 酸 (1,4,7,10-Tetraazacyclododecane-N,N′,N″,N‴-tetraacetic acid,DOTA)均购自日本TCI公司,1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐[1-(3-Dimethylaminoptoply)-3-ethylcarbodimide hydrochloride,EDC]购自美国Sigma Aldrich公司,甲状腺未分化癌ARO细胞、人脐静脉内皮细胞均购自四川大学华西医院核医学实验室和再生医学中心,SPF级 BALB/c裸鼠(4~6周龄,18~20 g,雌性)购自四川大学实验动物中心(动物生产许可证号11)。
1.2 实验方法
1.2.1 DOTA-hTERT ASON的制备:将4.0mg DOTA、2 mg EDC、2 mg S-NHS溶于 200μL pH 5.5 PBS中,室温下振荡30min,生成中间体 DOTA-NHS酯[13],再以 DOTA∶ASON分子比226∶1,逐滴加入1.6 mL pH 8.5 PBS(含22.6 nmol ASON)中,室温下振荡反应4 h,将反应液移入透析管(分子截留量:3.5 kd)中,以pH 7.0 PBS透析9 h,每3 h换液1次,分装纯化后的DOTA-hTERT ASON,-20℃冰箱保存。
1.2.2 DOTA-hTERT ASON的99mTc标记:1mL生理盐水溶解MDP氯化亚锡,取10μL加入33μg DOTA-ASON,充分混匀,最后加入新鲜99mTc O4-淋洗液370MBq(10mCi)60℃振荡反应45min,采用纸层析法及G25葡聚糖凝胶色谱柱分别测定99mTc-DOTA-ASON的放化纯度(radiochemical purity,RCP)及标记率。
1.2.3 体外实验检测99mTc标记的DOTA-hTERTASON的稳定性:室温下在99mTc标记的DOTA-hTERT ASON中加入新鲜人血清,在37℃,5%CO2孵箱中,分别于0.5、1、2、4、8、12 h检测探针的RCP。
1.2.4 细胞培养及细胞学摄取实验:甲状腺未分化癌ARO细胞、人脐静脉内皮细胞培养于含10%小牛血清高糖DMEM培养基中,37℃,5%CO2条件下培养。取对数生长期细胞,以1×106/孔种植于24孔细胞培养板中,培养24 h后,弃培养基,每孔加入20μL 99mTc-DOTA-ASON(37MBq/mL)和200μL培养基继续培养。分别于0.5、1、2、4、6 h终止培养,测定细胞摄取率[细胞摄取率(%)=Cuptake/(Crest+Cuptake)×100%]。方法如下:将含有分子探针的培养基收集于一支试管中,标记为剩余管,然后以PBS液洗涤3次,并将洗涤液移入剩余管中,在γ放射免疫计数仪上测定计数(Crest);用0.25%胰蛋白酶消化贴壁细胞,将细胞移入另一试管中,标记为摄取管,用PBS洗涤3次,将洗涤液收集于摄取管中,测定计数(Cuptake)。同时台盼蓝染色,在倒置显微镜下观察细胞的增殖状况。
1.2.5 肿瘤模型的建立:取对数生长期肺腺癌ARO细胞,用0.25%胰蛋白酶消化,离心洗涤2次,用无血清DMEM培养液制成细胞悬液,于雌性裸鼠右侧腋下注射0.2mL(约含5×106个瘤细胞)。待肿瘤直径达8~10mm时进行实验。
1.2.6 SPECT显像:10只荷瘤小鼠随机分成实验组和封闭对照组,各5只。实验组:通过尾静脉分别注射0.2 mL 99mTc-DOTA-ASON 7.4 MBq;封闭对照组:同时注射5倍未标记的DOTA-ASON及同等活度的99mTc-DOTA-ASON。分别于注射后0.5、1、2、4、6、8、12 h行 SPECT静态显像,使用锥孔准直器,矩阵128×128,Zoom 1.33,每帧采集5min。
1.2.7 病理组织学检测:所有显像完成后48 h,将动物处死,取肿瘤及邻近组织用福尔马林固定48 h后用石蜡包埋,制成5μm厚的切片,进行端粒酶免疫组织化学染色,检测端粒酶活性。
1.3 统计学方法 所有计量资料均经SPSS13.0处理,正态计量资料用“±s”表示,等级资料采用秩和检验,组间比较用单因素方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 99mTc-DOTA-ASON的标记及体外稳定性 99mTc-DOTA-ASON的RCP可达90%以上,标记率可达85%。在室温下、生理盐水中、37℃新鲜人血清中12h内99mTc-DOTA-ASON的RCP可保持在90%以上(见图1)。

图1 99mTc-DOTA-ASON在不同温度及介质中的时间—放射化学纯度(RCP)曲线Fig.1 The time-radiochemical purity(RCP)curve of 99mTc-DOTA-ASON at different temperatures and mediums
2.2 细胞摄取实验 ARO及HUVEC对反义探针的摄取高峰时间均为2~4 h(见图2),但ARO对探针的最高摄取率为(8.8±0.3)%,明显高于HUVC细胞的(5.9±0.4)%(P<0.001)。
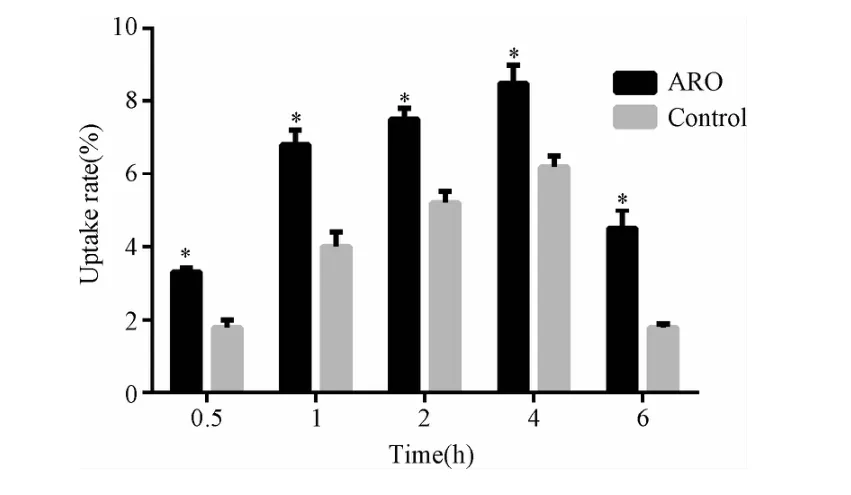
图2 ARO及HUVC(control)在不同时间内对99mTc-DOTA-ASON的摄取率*P<0.001,与正常对照组比较Fig.2 The uptake rate of99mTc-DOTA-ASON on ARO and HUVC(control)in different times*P<0.001,compared with control group
2.3 99mTc-DOTA-ASON在荷ARO肿瘤裸鼠体内分布体内分布结果显示(见图3):在注射后0.5 h肿瘤内放射性计数较高,为(1.76±0.31)%ID/g,随即有所下降并在 4h达到最高值(1.80±0.29)%ID/g,且在8 h内保持在较高的水平,而骨骼、肌肉摄取较低,血液清除较快(图3A),反义探针主要通过肾脏排泄,部分经胃肠排泄(图3B);此外胃肠本身对反义探针也有一定的摄取(图3A)。
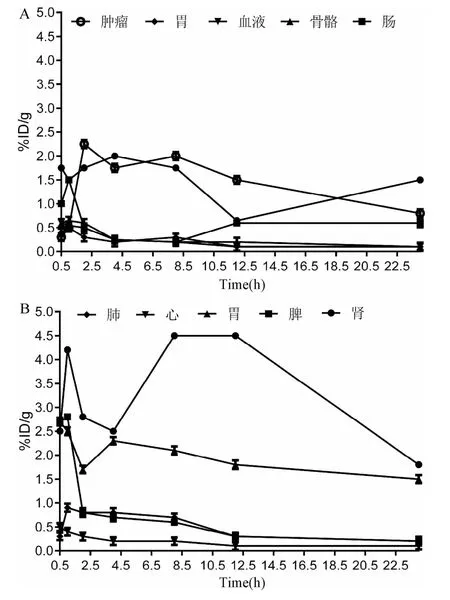
图3 99mTc-DOTA-ASON在荷ARO肿瘤裸鼠体内分布Fig.3 The distribution of99mTc-DOTA-ASON in vivo of bearing-ARO-cancer hairlessmice
2.4 99mTc-DOTA-ASON荷瘤裸鼠γ显像 经尾静脉注射后SPECT显像结果见图4,对照组肿瘤显影明显浅淡(左),T/NT值(1.2±0.2)明显低于实验组(1.8±0.2,n=5,P<0.05);实验组肿瘤显影较清晰(右),并持续至8 h,肿瘤(target,T)与周围软组织(nontarget,NT)本底放射性计数比可达2.0。以上结果进一步表明,99mTc-DOTA-ASON可被ARO肿瘤细胞所摄取,且摄取能力可被DOTA-ASON所抑制。
2.5 病理学分析 标本取于显像后48 h,端粒酶免疫组化结果显示:ARO细胞端粒酶活性呈阳性(图5),而实验组(左)的端粒酶阳性强度明显低于空白对照组(右),表明反义探针在活体内可被肿瘤摄取,并能抑制端粒酶的活性。
3 讨论
放射性核素示踪技术作为一种高灵敏的体内外分析技术,被广泛用于分子影像学的研究,尤其在报告基因显像方面具有独到的优势,Meng Liu等[14-15]利用 99mTc间接标记 hTERT ASON对表达端粒活性的肿瘤模型成功显像表明在活体内对肿瘤的端粒酶进行无创性的检测是可行的,并为放射性核素标记反义寡核苷酸靶向治疗端粒阳性肿瘤提供了基础技术,本研究所标记的反义探针在标记率、体外稳定性、体内分布及细胞摄取率方面与文献报道基本一致,但制备本探针所需反应条件相对比较简单,且DOTA更适合于标记顺磁性材料钆(Gd3+)及正电子核素铜(64Cu)[16-17]。而进行MRI及PET方面的研究,可使图像具有更高的解剖及空间分辨率。在体内分布结果中,胃、肠等有相对较高的放射性摄取,主要与胃肠上皮细胞具有自我更新能力有关[18],此结果提示在端粒酶反义显像与治疗时需要注意保护胃肠粘膜等具有自我更新能力的组织或器官。目前,反义探针的摄取机制仍不清楚,可能与细胞非特异摄取或通过特定的蛋白通道有关[19-20],因此如何提高肿瘤细胞对反义探针的摄取率尚需进一步的研究。体外实验表明[21],在有质粒介导的条件下可明显提高反义探针的摄取,但在体内是否如此,仍需进一步证实。
端粒长度的维持是所有恶性肿瘤的共同特征,研究表明约85~90%的恶性肿瘤通过激活端粒酶的方式来维持其端粒的稳定性[22],因此端粒酶业已成为肿瘤治疗的另一靶点,并已取得了令人鼓舞的结果[23-24]。据报道[25-26],端粒酶在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)中约87%高表达,在滤泡状癌(follicular thyroid carcinoma,FTC)中为 100%,髓样癌(medullary thyroid carcinoma,MTC)为100%,而 ATC未见报道,可能系与该病理类型较少见及病理诊断较难有关,本实验利用99mTc-DOTA-hTERT ASON对ARO动物模型显像的成功,为ATC的放射性核素治疗提供了新的思路,同时也提示ATC也可能是端粒酶高表达的肿瘤,尽管目前尚无相关的报道。
ATC虽然占甲状腺恶性肿瘤的比例较少,但其致死率却超过所有甲状腺恶性肿瘤的50%,因此,对ATC的早期诊断以及综合治疗是改善患者生存质量、延长患者生存时间的关键,目前对ATC治疗的研究已取得了一定的成果[27-29],相信随着研究的不断深入,在ATC治疗方面会取得更多实质性的突破。
[1] Lo CY,Lam KY,Wan KY.Anaplastic Carcinoma of the Thyroid[J].The American Journal of Surgery,1999,179(3)337-339.
[2] Venkatesh YS,Ordonez NG,Schultz PN,et al.Anaplastic carcinoma of the thyroid:a clinicopathologic study of121 cases[J].Cancer,1990,2(66):321-330.
[3] Ito Y,Miyauchi A,Jikuzono T,et al.Risk factors contributing to a poor prognosis of papillary thyroid carcinoma;Validity of UICC/AJCC TNM classification and stage grouping[J].World J Surg,2007,54(31):838-848.
[4] Tennvall J,Lundell G,Hallquist A,et al.Combined doxorubicin,hyperfractionated radiotherapy,and surgery in anaplastic thyroid carcinoma[J].The Swedish Anaplastic Thyroid Cancer Group.Cancer,1994,4(74):1348-1354.
[5] Busnardo B,Daniele O,Pelizzo MR,et al.A multimodality therapeutic approach in anaplastic thyroid carcinoma:study on 39patients[J].J Endocrinol Invest,2000,5(23):755-761.
[6] Haigh PI,Ituarte PHG,Wu HS,et al.Completely resected anaplastic thyroid carcinoma combined with adjuvant chemotherapy and irradiation is associated with prolonged survival[J].Cancer,2001,12(91):2335-2342.
[7] Andrea GB,Michel O,Maria F,et al.Extension of Life-Span byntroduction of Telomerase into Normal Human Cells[J].Science,1998,10(279):349-352.
[8] Peter N,Chris A,Beate B,et al.Senescence and epigenetic dysregulation in cancer[J].The International Journal of Biochemistry&Cell Biology,2002,16(34):1475-1490.
[9] Lisa YP,David A.Cancer stem cells and telomerase as potential biomarkers in veterinary oncology[J].The Veterinary Journal,2010,5(185):15-22.
[10]Kenkichi M,William CH.Telomerase and tumorigenesis[J].Cancer Letters,2003,13(194):163-172.
[11]Feng JL,Funk WD,Wang SS,et al.The RNA component of human telomerase[J].Science,1995,7(269):1236-1241.
[12]Sabita N,Saldanha,Lucy GA,et al.Analysis of telomerase activity and detection of its catalytic subunit[J].Htert.Analytical Biochemistry,2003,8(315):1-21.
[13]Lee HY,Li ZB,Chen K,et al.PET/MRIDual-Modality Tumor Imaging Using Arginine-Glycine-Aspartic(RGD)-Conjugated Radiolabeled Iron Oxide Nanoparticles[J].JNucl Med,2008,49(8):1371-1379.
[14]Liu M,Wang RF,Zhang CL,et al.Noninvasive imaging of human telomerase reverse transcriptase(hTERT)messenger RNA with 99mTc-Radiolabeled antisense probes in malignant Tumors[J].JNucl Med,2007,10(48):2028-2036.
[15]Parasuraman P,Jesse O,Pritha R,et al.Visualization of telomerase reverse transcriptase(hTERT)promoter activity using a trimodality fusion reporter construct[J].JNucl Med,2006,47(2):270-277.
[16]Derek WB,Helen S,et al.Impact of tumor-specific targeting on the biodistribution and efficacy of siRNA nanoparticles measured by multimodality in vivo imaging[J].PNAS,2007,104(39):15549-15554.
[17]Luo K,Liu G,He B,et al.Multifunctional gadolinium-based dendritic macromolecules as liver targeting imaging probes[J].Biomaterials,2011,32(10):2575-2585.
[18]Kim NW,Piatyszek MA,Prowse KR,etal.Specific association of human telomerase activity with immortal cells and cancer[J].Science,1994,266(5193):2011-2015.
[19]Gauchez AS,Du Moulinet D’Hardemare A,Lunardi J,et al.Potential use of radiolabeled antisense oligonucleotides in oncology[J].Anticancer Res,1999,19(45):4989-4997.
[20]Jansen B,Zangemeister-Wittke U.Antisense therapy for cancer:the time of truth[J].Lancet Oncol,2002(3):672-683.
[21]Wang RF,Liu M,Zhang CL,et al.Uptake kinetics of hTERT antisense molecular probe by cells and its biological properities[J].Joural of Pekine University(Health Sciences),2009,41(4):437-441.
[22]Chen CH,Chen RJ.Prevalence of Telomerase Activity in Human Cancer[J].JFormos Med Assoc,2011,110(5):275-289.
[23]Akira A,Yuko O,Yoshihiro Y,et al.A Novel Telomerase Template Antagonist(GRN163)as a Potential Anticancer Agent[J].Cancer Res,2003,63(14):3931-3939.
[24]Shalmica RJ, Zhu CH,Vera P,et al.Antiadhesive effects of GRN163L—an oligonucleotide N3’-P5’thio-phosphoramidate targeting telomerase[J].Cancer Res,2007,67(3):1121-1129.
[25]Makoto K,Kaiyo T,Ken-Ichi N,et al.Telomerase activity and telomere length in benign and malignant human thyroid tissues[J].Cancer Letters,2000,159(2):175-181.
[26]Kazuo Y,Frank V,Adi FG,et al.Telomerase activity in benign and malignant thyroid diseases[J].Surgery,1997,122(6):1141-1145.
[27]Kebebew E,Greenspan FS,Clark OH,et al.Anaplastic thyroid carcinoma.Treatment outcome and prognostic factors[J].Cancer,2005,103(7):1330-1335.
[28]Busnardo B,Daniele O,Pelizzo MR,et al.A multimodality therapeutic approach in anaplastic thyroid carcinoma:study on 39 patients[J].J Endocrinol Invest,2000,23(7):755-761.
[29]De Crevoisier R,Baudin E,Bachelot A,et al.Combined treatment of anaplastic thyroid carcinoma with surgery, chemotherapy, and hyperfractionated accelerated external radiotherapy[J].Int JRadiation Oncology Biol Phys,2004,30(60):1137-1143.
(编校:吴茜)
SPECT targeting imaging of anap lastic thyroid carcinoma bearing nudem ice using 99m Tc-DOTA-hTERT ASON
LEIYou-ming1,ZHU Gao-hong2,YUAN Fang3,LIU Xi-jiao3,SONG Bin3,REN Bin-xiu2
(1.Department of Surgery,First Affiliated Hospital of Kunming Medical University,Kunming 650032,China;2.Department of Nuclear Medicine,First Affiliated Hospital of Kunming Medical University,Kunming 650032,China;3.Department of Radiology,West China Hospital of Sichuan University,Chengdu 610041,China)
ObjectiveTo develop a method of detecting the telomerase activity of anaplastic thyroid carcinoma(ATC)in vivo with nuclear medicine imaging.MethodsHuman telomerase reverse transcriptase antisense oligonucleotide(hTERT ASON)was labeled with technetium-99m(99mTc)though a bifunctional chelator1,4,7,10-Tetraazacyclododecane-N,N′,N″,N‴-tetraacetic acid(DOTA);and then tumor bearing BALB/c nude mousemodels were established with anaplastic thyroid carcinoma ARO cell line;finally,the radiolabeled antisense probes were injected into model mouses through tail vein and planer scan was performed through single photon emission computed tomography(SPECT)at different time point after injection,48 hrs after imaging all animals were sacrificed and immunohistochemical staining was used to detect the activity of telomerase of ARO tumors.Results99mTc-DOTA-hTERT ASON can home to ARO tumors and the tumors can be clearly displayed at2-8h after injection and the highest tumor to nontarget ratio(T/NT)can reach 2.0;telomerase is highly expressed in ARO tumors and can be depressed by DOTA-hTERT ASON.Conclusion99mTc-DOTA-hTERT ASON can be used as a potential probe in detecting telomerase activity of ATC cells in vivo and diagnosing and treating patientswith ATC aswell.
Technetium-99m;anaplastic thyroid carcinoma;telomerase;antisense imaging
R-33;R653
A
1005-1678(2014)05-0167-04
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)是一种预后极差的高度恶性肿瘤,约占甲状腺恶性肿瘤的2%~5%,中位生存时间3~7个月,约有50%的患者在确诊时已经有远隔转移[1-3],因此对ATC患者进行积极治疗是提高患者生活质量的关键,同时对延长患者的生存期也有一定的作用[4-6]。然而,ATC对化疗敏感性差而局部放疗常需大剂量才能达到控制病灶发展的效果,放射性核素内照射治疗作为一种有效的辅助治疗手段,具有靶向性好、安全性高等优点,但目前为止,仍无相关放射性核素治疗ATC的报道,其主要原因是ATC对常规治疗用放射性药物均无特异性摄取,ATC核素治疗已成为甲状腺恶性肿瘤内照射治疗研究的热点之一。
云南省联合基金项目(2010CD149)
雷又鸣,男,硕士,主治医师,研究方向:肿瘤学,E-mail:283073084@qq.com。

