5-氮杂胞苷逆转P16基因甲基化对血管瘤细胞增殖和凋亡的影响
付桂莉,郑源泉,卢静静,黄美莲,李延
(1.武汉市儿童医院 皮肤科,湖北 武汉 430016;2.华中科技大学同济医学院附属协和医院 皮肤科,湖北 武汉 430022)
5-氮杂胞苷逆转P16基因甲基化对血管瘤细胞增殖和凋亡的影响
付桂莉1,郑源泉1,卢静静1,黄美莲1,李延2
(1.武汉市儿童医院 皮肤科,湖北 武汉 430016;2.华中科技大学同济医学院附属协和医院 皮肤科,湖北 武汉 430022)
目的研究5-氮杂胞苷逆转P16基因甲基化对血管瘤细胞增殖和凋亡的影响。方法采用BSP法检测未处理组和5-氮杂胞苷处理组EOMA小鼠血管瘤细胞P16基因启动子甲基化情况,RT-PCR和Western Blot分别检测P16基因mRNA和蛋白质表达,采用流式细胞仪检测细胞增殖、细胞周期和细胞凋亡,比较2组P16基因启动子甲基化、mRNA和蛋白质表达、细胞增殖、细胞周期和凋亡的差异。结果5-氮杂胞苷处理组EOMA小鼠血管瘤细胞P16基因启动子第1~13CG位点甲基化率均为0%,明显低于未处理组细胞;处理组P16基因mRNA和蛋白质表达均显著高于未处理组细胞(P<0.05);处理组细胞吸光度、S期、G2/M期和PI显著低于未处理细胞(P<0.05),G0/G1期和凋亡率显著高于未处理组细胞(P<0.05)。结论血管瘤细胞P16基因处于高甲基化和表达沉默状态。5-氮杂胞苷可逆转血管瘤细胞P16基因启动子甲基化状态,使沉默的P16基因重新获得表达而抑制血管瘤细胞增殖并促进其凋亡。
血管瘤;5-氮杂胞苷;P16;甲基化;细胞增殖;凋亡
1 材料与方法
1.1 细胞与试剂 EOMA小鼠血管瘤细胞株购于美国典型培养物保藏中心(ATCC),胎牛血清(FBS)和 DMEM购自Hyclone公司,MTT试剂购于碧云天公司,DNA提取试剂盒购自Takara;甲基化检测试剂盒购自北京天漠公司;5-氮杂胞苷购于Sigma;引物合成及测序由华大基因公司完成。
1.2 细胞培养和5-氮杂胞苷处理 EOMA小鼠血管瘤细胞培养基为10%FBS和DMEM,培养条件为37℃,5%CO2无菌培养箱。将细胞是否采用5-氮杂胞苷处理分为未处理组和处理组。取对数增长期EOMA小鼠血管瘤细胞,处理组加入5-氮杂胞苷储存液(终浓度为50 umol/L),孵育12h后用培养基清洗3次,更换新鲜培养基培养。
1.3 P16基因启动子甲基化检测 采取亚硫酸盐测序法(Bisulfite Sequencing PCR,BSP)检测处理和未处理组EOMA小鼠血管瘤细胞P16基因启动子甲基化,检测目标为P16基因启动子CpG岛区域,包括13个CG位点。甲基化引物采用Methyl Primer Express Software v1.0设计,上游引物序列为 5’-TGGGGTTTTTATAATTAGGAAAGAATAGTT-3’,下游引物序列为5’-AAAACTAAACTCCTCCCCACCTACC-3’。反应体系为 25μL,反应条件为95℃预变性10min,95℃变性45 s,61℃退火30s,72℃延伸30 s,循环30个周期后,最后72℃延伸10min结束。扩增后的产物采用测序仪测序,测序结果采用BiQ Analyzer v2.0分析。

图1 5-氮杂胞苷未处理组(a)和处理组(b)EOMA小鼠血管瘤细胞P16基因启动子甲基化检测结果Fig.1 P16 gene′s promotermethylation in 5-azacytidine untreated EOMA cells(a)and treated EOMA cells(b)
1.4 P16基因表达检测 分别提取处理和未处理组EOMA小鼠血管瘤细胞总RNA和总蛋白,采用RT-PCR法检测P16基因mRNA表达,选择GAPDH为内对照;采用Western blot法检测P16基因蛋白质表达,选择β-actin为内对照。
1.5 细胞增殖检测 采用MTT法检测处理和未处理组细胞增殖情况,检测处理前(D0)和处理D1~D7后酶标检测仪检测490 nm下的吸光值(A),吸光值=所测吸光度-空白对照组吸光度。以吸光值为纵坐标,时间(D)为横坐标,绘制细胞增殖曲线。
1.6 细胞周期和凋亡检测 采用流式细胞仪检测处理和未处理组的EOMA小鼠血管瘤细胞周期及细胞凋亡情况,其中增殖指数
2 结果
2.1 5-氮杂胞苷处理对P16基因启动子甲基化的影响 未处理组EOMA小鼠血管瘤细胞P16基因启动子第1CG位点甲基化率为60%、第2~13CG位点甲基化率为80.0%;5-氮杂胞苷处理组EOMA小鼠血管瘤细胞P16基因启动子第1~13CG位点甲基化率均为0.0%,明显低于未处理组细胞(见图1)。
2.2 5-氮杂胞苷处理对P16基因mRNA和蛋白表达的影响 RT-PCR结果显示:处理组EOMA小鼠血管瘤细胞P16基因mRNA显著高于未处理组细胞(P<0.05,见图2)。Western结果显示:未处理组EOMA小鼠血管瘤细胞P16基因蛋白质处于低表达水平状态,显著低于5-氮杂胞苷处理组细胞(见图3)。
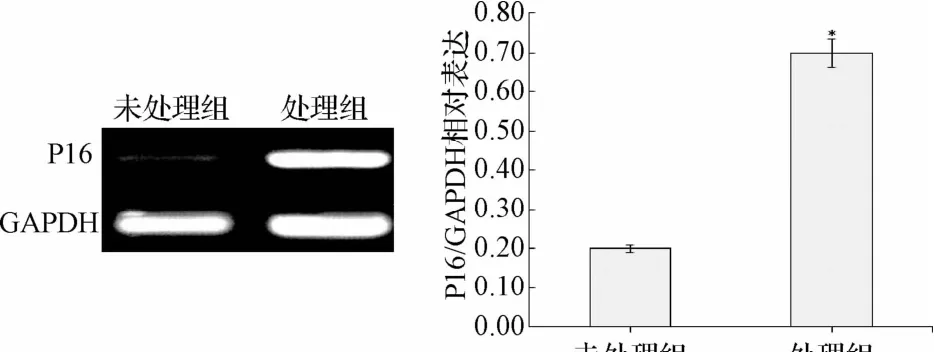
图2 未处理和处理组细胞P16基因mRNA表达*P<0.05,与未处理组相比Fig.2 P16 genemRNA expressions in 5-azacytidine treated and untreated EOMA cells*P<0.05,compared with untreated group

图3 未处理和处理组细胞P16基因蛋白质表达*P<0.05,与未处理组相比Fig.3 Protein expressions of p16 gene in 5-azacytidine treated and untreated EOMA cells*P<0.05,compared with untreated group
2.3 5-氮杂胞苷处理对EOMA小鼠血管瘤细胞增殖的影响 未处理组EOMA小鼠血管瘤细胞呈对数增殖状态,处理组细胞D1-D7吸光值显著低于未处理组细胞D1-D7细胞吸光值(P<0.05,见图4)。
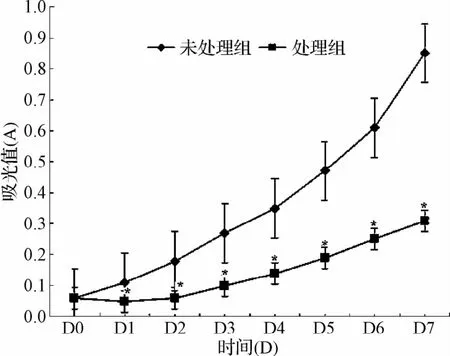
图4 未处理和处理组EOMA小鼠血管瘤细胞增殖曲线Fig.4 Curves of EOMA cell proliferation in 5-azacytidine treated and untreated EOMA cells*P<0.05,与未处理组对比,compared with 5-azacytidine untreated group
2.4 5-氮杂胞苷处理对EOMA小鼠血管瘤细胞细胞周期和凋亡的影响 5-氮杂胞苷处理组 EOMA小鼠血管瘤细胞G0/G1期和凋亡率显著高于未处理组细胞(P<0.05),S期、G2/M期和PI显著低于未处理组细胞(P<0.05,见表1)。

表1 5-氮杂胞苷处理对EOMA小鼠血管瘤细胞周期和凋亡的影响Tab.1 Effect of 5-azacytidine on cell circle and apoptosis of EOMA cell
3 讨论
基因表达异常主要与基因突变和表观遗传学有关,其中基因表观遗传学修饰是新发现的与DNA碱基突变无关的转录前基因表达调控机制,包括CG甲基化和组蛋白乙酰化修饰等,其中甲基化修饰是最常见的表观遗传学调控机制[5]。DNA甲基化修饰是在甲基转移酶催化作用下,C结合甲基形成mC,甲基化的mCpG与DNA甲基结合蛋白结合能间接阻遏转录起始元件与DNA启动子区域结合从而调控基因表达[6],基因甲基化异常时会导致正常细胞的增殖失去调控进而发生癌变,越来越多的研究表明其与肿瘤的发病机制密切相关[7]。血管瘤的发病机制目前尚未完全明确,基因甲基化灭活是其中最重要的发病机制,获得证实的基因包括 KDR[8]、survivin基因[9]和 Tie2受体[10]等。P16是一种抑癌基因,属于细胞周期素依赖蛋白激酶的负调控因子,可阻止细胞周期从G1期向S期转换从而发挥调控细胞周期的作用,其表达异常与多种肿瘤的发病机制密切相关[11-12]。国内外的研究已经证实P16基因启动子含有CpG岛[13],其甲基化灭活参与多种肿瘤的发生及发展,基于该事实,推测P16基因启动子CpG岛区域甲基化可能在血管瘤中具有同样的角色。本研究采用BSP法检测正常EOMA小鼠血管瘤细胞P16基因启动子甲基化状态,第1CG位点甲基化率为60%、第2~13CG位点甲基化率为80.0%,表明血管瘤细胞中P16基因启动子处于高甲基化状态,证实其与血管瘤的发病机制密切相关。
甲基化中无基因碱基序列改变,故理论上甲基化修饰是可逆的,逆转基因的甲基化理论上可使沉默的基因重新表达而发挥功能。5-氮杂胞苷是目前常用的广谱去甲基化药物,可使甲基化的mC恢复为未甲基化的C,使甲基化失活的基因重新获得表达[14-15]。本研究中,5-氮杂胞苷处理后的EOMA小鼠血管瘤细胞P16基因启动子第1~13CG位点甲基化均为0%,mRNA和蛋白质表达显著高于未处理细胞,证实5-氮杂胞苷可完全逆转P16基因启动子甲基化状态并获得重新表达;进一步发现,5-氮杂胞苷处理后的细胞吸光度、S期、G2/M期和PI显著低于未处理细胞,G0/G1期和凋亡率显著高于未处理细胞,这些证据表明5-氮杂胞苷对P16基因启动子的去甲基化可使P16基因重新获得表达而发挥调控细胞周期作用,模拟了P16基因启动子甲基化导致血管瘤发生的机制。基于以上证据,推测5-氮杂胞苷等逆转基因启动子甲基化的药物是潜在的肿瘤基因靶向治疗药物,值得进一步研究。
[1] Xiao P,Chen JR,Zhou F,et al.Methylation of P16 in exhaled breath condensate for diagnosis of non-small cell lung cancer[J].Lung cancer,2014,83(1):56-60.
[2] Khor GH,Froemming GR,Zain RB,et al.DNA methylation profiling revealed promoter hypermethylation-induced silencing of p16,DDAH2 and DUSP1 in primary oral squamous cell carcinoma[J].Int JMed Sci,2013,10(12):1727-1739.
[3] 李基伟,吴学东,潘云,等.儿童血管瘤内皮细胞 Cyclin D1、p16、CDK4的表达及其意义[J].中国现代医学杂志,2013,23(20):55-59.
[4] Wu WC,Hsu CH,Kuan JC,et al.Predicting the progress of colon cancer by DNA methylation markers of the p16 gene in feces-Evidence from an animal model[J].Genetics and molecular biology,2013,36(3):323-328.
[5] Yan H,Sun J.Methylation status ofWWOX gene promoter CpG islands in epithelial ovarian cancer and its clinical significance[J].Biomedical reports,2013,1(3):375-378.
[6] Avraham A,Cho SS,Uhlmann R,et al.Tissue specific DNA methylation in normal human breast epithelium and in breast cancer[J].PloS one,2014,9(3):e91805.
[7] Kupcinskaite-Noreikiene R,Skieceviciene J,Jonaitis L,et al.CpG Islandmethylation of the MLH1,MGMT,DAPK,and CASP8 genes in cancerous and adjacent noncancerous stomach tissues[J].Medicina,2013,49(8):361-366.
[8] 杨恩,刘铭,彭强,等.血管瘤血管内皮生长因子受体KDR基因异常甲基化的研究[J].临床小儿外科杂志,2012,11(4):268-271.
[9] 熊耕.婴幼儿血管瘤survivin基因启动子甲基化的研究[D].泸州医学院,2013.
[10] 马斌.血管生成素受体Tie2在婴幼儿血管瘤中的表达和甲基化变异[D].泸州医学院,2013.
[11] Park K,Cho KJ,Lee M,etal.Importance of FOXP3 in prognosis and its relationship with p16 in tonsillar squamous cell carcinoma[J].Anticancer research,2013,33(12):5667-5673.
[12] Kawakami H,Okamoto I,Terao K,et al.Human papillomavirus DNA and p16 expression in Japanese patients with oropharyngeal squamous cell carcinoma[J].Cancermedicine,2013,2(6):933-941.
[13] Kim H,Jekarl DW,Kim M,et al.Prevalence of p16 methylation and prognostic factors in plasma cell myeloma at a single institution in Korea[J].Annals of laboratorymedicine,2013,33(1):28-33.
[14] 裴晋红,柴文林,郭改娥,等.5-氮-2'-脱氧胞苷对非霍奇金淋巴瘤p73基因甲基化的逆转作用[J].中国生化药物杂志,2012,33(4):433-435.
[15] Borodovsky A,Salmasi V,Turcan S,et al.5-azacytidine reduces methylation,promotes differentiation and induces tumor regression in a patient-derived IDH1 mutant glioma xenograft[J].Oncotarget,2013,4(10):1737-1747.
(编校:吴茜)
Effects of 5-azacytidine's demethylation for P16 gene on the proliferation and apoptosis of hemangioma cell
FU Gui-li1,ZHENG Yuan-quan1,LU Jing-jing1,HUANGMei-lian1,LIYan2
(1.Department of Dermatology,Wuhan Children's Hospital,Wuhan 430016,China;2.Department of Dermatology,Union Hospital,Tongji Medical college,Huazhong University of Science and Technology,Wuhan 430022,China)
ObjectiveTo study the effects of 5-azacytidine's demethylation for P16 gene on hemangioma cell's proliferation and apoptosis.MethodsBisulfite sequencing PCR was applied to detect P16 gene′s promotermethylation status in 5-azacytidine treated and untreated EOMA cell line.RT-PCR and western blotwere used to detect the P16 genemRNA and protein expressions.Flow cytometrywas used to detect cell proliferation,cell cycle and cell apoptosis.The differences of P16 gene′s promotermethylation status,mRNA and protein expressions,cell proliferation,cell cycle and apoptosis in two groupswere compared.ResultsThemethylation rates in 1stand 13th CGswere0%after5-azacytidine treatment in EOMA hemangioma cell line,which were lower than in untreated cells.ThemRNA and protein expressions increased after 5-azacytidine treatment,which were significantly higher than in untreated cells.The absorbance,S phase and G2/Mphase and PIafter 5-azacytidine treatmentwere lower than untreated cells,while the G0/G1 phase and apoptosis rates were higher.ConclusionThe P16 gene promoter is hypermethylated in hemangioma cells with silent gene expressions.5-azacytidine could reverse P16 gene′s promotermethylation and silent gene expressions,which inhibit hemangioma cell's proliferation and promote apoptosis.
Hemangioma;5-azacytidine;P16;methylation;cell proliferation;apoptosis
R733.7
A
1005-1678(2014)04-0015-04
P16是细胞周期素依赖蛋白激酶的负性调控因子,可阻止细胞周期从G1期向S期转换而发挥调控细胞周期的作用,其表达异常与多种肿瘤的发生发展及转归密切相关[1-2]。研究表明,血管瘤组织中P16基因表达显著低于正常组织[3],而基因表达下降与表观遗传学沉默有关[4],推测其可能与P16基因启动子高甲基化有关。本研究旨在探讨5-氮杂胞苷处理和未处理血管瘤细胞对其P16基因启动子甲基化状态、基因表达和细胞周期凋亡的变化,研究P16基因去甲基化与血管瘤细胞增殖、凋亡的关系。
国家自然科学基金青年科学基金项目(30901287)
付桂莉,女,硕士,主治医师,研究方向:E-mail:157047064@qq.com。

