芝麻酚对小鼠骨髓c-kit阳性细胞辐射损伤的保护作用研究
路璐,张俊伶,李德冠,孟爱民
(中国医学科学院北京协和医学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192)
泸州市12所非基层医疗机构实施基本药物制度的成效分析…………………………………………………… 江启蓉,冯碧敏(184)
芝麻酚对小鼠骨髓c-kit阳性细胞辐射损伤的保护作用研究
路璐,张俊伶,李德冠,孟爱民
(中国医学科学院北京协和医学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192)
目的探讨芝麻酚对小鼠骨髓c-kit阳性细胞辐射损伤的保护作用,进一步探讨其可能的作用机制。方法经免疫磁珠细胞分选法获得小鼠骨髓c-kit阳性细胞,设空白对照组、单加药组和照射剂量1 Gy、4 Gy的照射加药组。后2组均加入终浓度为10-8~10-3mol/L的芝麻酚,照射加药组在照射前30min加药,加药后继续培养18 h。采用生物发光法检测小鼠骨髓c-kit阳性细胞的细胞活力,甲基纤维素半固体培养法检测克隆形成能力,流式细胞术检测细胞凋亡水平。结果与对照组比较,1 Gy和4 Gy射线照射后小鼠c-kit阳性细胞的细胞活力分别下降59.52%和79.35%(P<0.05),集落形成数量分别下降40.38%和87.69%(P<0.05);在10-8~10-6mol/L浓度范围内,芝麻酚可显著提高小鼠c-kit阳性细胞细胞活力和集落形成数量,但对细胞凋亡无影响。结论芝麻酚对小鼠骨髓c-kit阳性细胞辐射损伤的保护作用可能是通过提高造血祖细胞的增殖能力。
芝麻酚;c-kit阳性细胞;骨髓;辐射损伤;辐射防护;
1 材料与方法
1.1 材料
1.1.1 实验动物:C57BL/6小鼠50只,雄性,SPF级,8~10周龄,体质量18~22 g,购自北京维通利华实验动物有限公司,合格证号:SCXK(京)2009-0017,由中国医学科学院生物医学工程研究所动物实验中心提供,SPF级条件饲养。
1.1.2 主要试剂及仪器:芝麻酚购自美国 Sigma公司;Celltiter-GloTM细胞活力检测试剂盒购自美国Promega公司;甲基纤维素半固体培养基M3534购自加拿大Stem Cell Technologies公司;StemSpan Serum-Free Expansion Medium(SFEM)购自加拿大Stem Cell Technologies公司;FITC Annexin V/PI凋亡检测试剂盒购自美国BD公司;CD117 Microbeads购自德国MiltenyBiotec公司。137Csγ-射线照射源,剂量率为 1.01 Gy/min(Autocell40,加拿大原子能有限公司);多功能酶标仪(Infinite M200,瑞士);流式细胞仪(美国BD Accuri C6)。
1.2 方法
1.2.1 小鼠骨髓c-kit阳性细胞培养:富集小鼠脱颈处死,75%乙醇浸泡5min,无菌条件下取股、胫骨,用含2%胎牛血清的PBS冲洗骨髓细胞,用尼龙膜过滤后进行细胞计数;1500 r/min离心5 min,弃去上清后按照每109个细胞用200μL PBS悬起;按照每108个细胞加入20μL的CD117磁珠,冰上孵育15min;向细胞悬液中加入5 mL PBS,1 500 r/min离心 5min,洗涤1次;按照109细胞1mLPBS悬起细胞;LS柱子安装到磁架上,加入3mL PBS,重力作用自然流尽润柱。加入小鼠细胞悬液,过柱子后用3mL的PBS洗涤3次;将柱子从分离器上拿下,放到无菌管中,加入2mL PBS迅速吹打下所要细胞,再用1mL PBS吹打1次,离心、重悬、计数。
1.2.2 芝麻酚和辐射处理细胞:用无水乙醇溶解芝麻酚,使用带有0.22μm滤膜的滤器过滤除菌。用SFEM培养基依次10倍稀释芝麻酚溶液,分别稀释成2×10-3、2×10-4、2×10-5、2×10-6、2×10-7、2×10-8mol/L。将细胞悬液调整到 1×106/mL的浓度,细胞悬液以每管1.8mL的量分配至8支5mL EP管当中,然后加入含有不同剂量药物的SFEM培养基1.8mL使芝麻酚终浓度分别为 10-3、10-4、10-5、10-6、10-7、10-8mol/L,细胞终浓度为5×105个/mL。将细胞悬液接种至96孔板,每孔180μL,每组6个平行孔。37℃孵育30min后将种好的96孔板接受不同剂量137Csγ-射线(0Gy、1 Gy、4Gy)照射。
1.2.3 小鼠骨髓c-kit阳性细胞细胞活力的测定:用化学发光法进行细胞活力测定[11]。细胞在37℃,5%CO2的细胞培养箱中培养18 h后,将96孔板室温放置30min,加入生物发光试剂Celltiter-GloTM20μL,振荡2min后,转入白色测定板室温避光放置10min,用多功能酶标仪检测发光信号,以相对荧光强度(relative light units,RLU)作为细胞活力单位。
1.2.4 小鼠骨髓c-kit阳性细胞凋亡水平检测:根据1.2.2实验结果选择芝麻酚终浓度为 10-6、10-7、10-8mol/L的细胞,细胞终浓度为5×105个/mL,将细胞悬液种6孔板,每孔2mL,每组3个平行孔,加药后在37℃CO2细胞培养箱内孵育30min进行137Csγ-射线(0 Gy、1 Gy、4 Gy)照射细胞,之后 37℃,5%CO2的细胞培养箱培养18h,吹打收集悬浮细胞至2 mL EP管内,洗涤细胞,加入300μL Binding Buffer悬浮细胞;再加入5μL Annexin V-FITC混匀,室温避光孵育15 min;上机前5 min加5μL PI染色,流式检测。空白对照组同时设置阴性对照、Annexin V、PI单染组。
1.2.5 小鼠骨髓c-kit阳性细胞克隆形成能力检测:用SFEM培养基调整c-kit+细胞浓度为1×104个/mL(对照组)、2×104个/mL(1 Gy照射组)和 1×105个/mL(4 Gy照射组)[12-13],加0.2mL稀释好的细胞悬液至2mL甲基纤维素半固体培养基中,充分混匀后加入24孔板,每孔0.5mL,每组6个平行孔。轻摇培养板,使培养基均匀分布。将培养板放入湿盒,置入37℃,5%CO2培养箱中培养7 d。培养第7天在倒置显微镜下进行观察。低倍观察集落形成情况,细胞数≥50为阳性集落。
1.3 统计学方法 采用SPSS 19.0对数据进行统计分析,正态计量资料用±s”表示,多组间比较采用方差分析,组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 芝麻酚对小鼠骨髓c-kit阳性细胞细胞活力的影响芝麻酚在浓度 10-8、10-7、10-6、10-5mol/L时能够促进 c-kit+细胞增殖,细胞活力分别为空白对照组(芝麻酚浓度0mol/L,细胞活力100%)细胞活力的109.8%、109.8%、107.8%和104.1%;但在10-4mol/L和 10-3mol/L时能明显抑制 c-kit+细胞增殖(P<0.05,见图1)。
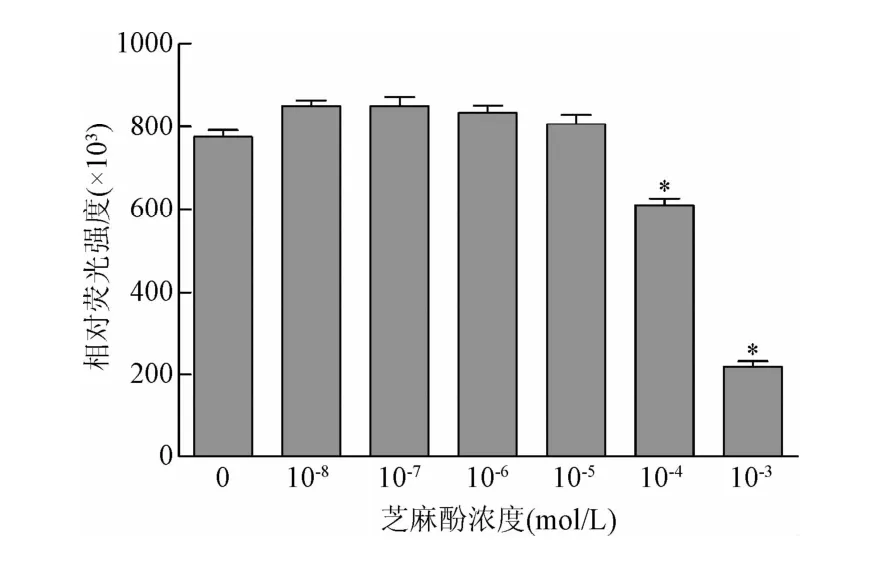
图1 不同浓度芝麻酚对骨髓c-kit+细胞活力的影响*P<0.05,与空白对照组相比Fig.1 Effects of different concentrations of sesamol on the viability of bonemarrow c-kit+cells*P<0.05,compared with blank control group
2.2 芝麻酚对小鼠骨髓c-kit阳性细胞辐射损伤的保护作用 与对照组比较,照射1Gy或4 Gy后骨髓细胞活力分别下降59.52%和79.35%,提示照射会导致造血系统骨髓c-kit+细胞功能活力下降。与对照组比较,芝麻酚对照射后骨髓c-kit+细胞活力有一定的保护作用:有效保护浓度在10-8~10-6mol/L,是细胞毒性剂量10-3的1/1 000~1/10 000(见表1)。
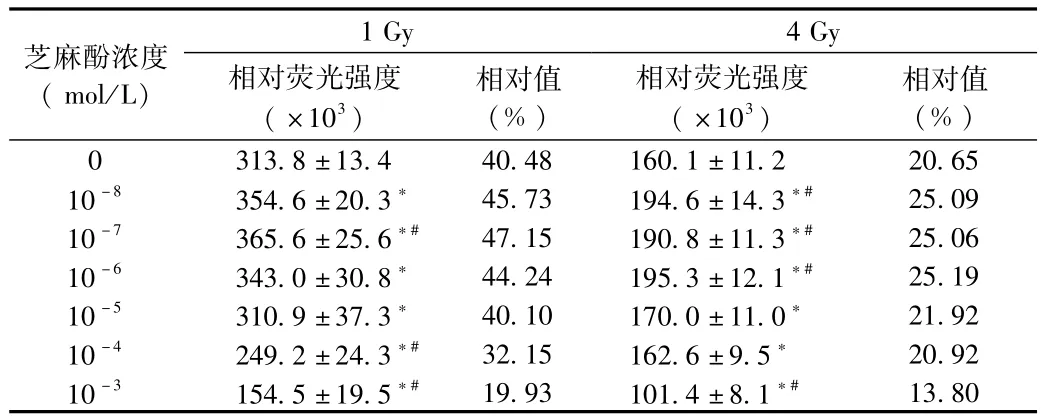
表1 不同浓度芝麻酚及1 Gy、4 Gy照射对骨髓c-kit+细胞活力的影响Tab.1 Effects of different concentrations of sesamol and 1 Gy,4 Gy irradiation on the viability of bonemarrow c-kit+cells
2.3 芝麻酚对小鼠骨髓c-kit阳性细胞细胞凋亡的影响辐射损伤保护作用结果显示 10-8、10-7、10-6mol/L浓度芝麻酚能够保护小鼠骨髓c-kit阳性细胞辐射损伤,因此以下实验芝麻酚浓度均选用10-8、10-7、10-6mol/L。与对照组比较,1 Gy、4 Gy照射后18 h,小鼠骨髓c-kit阳性细胞早期和晚期凋亡率均显著增加(P<0.05),芝麻酚药物组对骨髓c-kit阳性细胞细胞凋亡率没有明显作用(见图2、表2)。
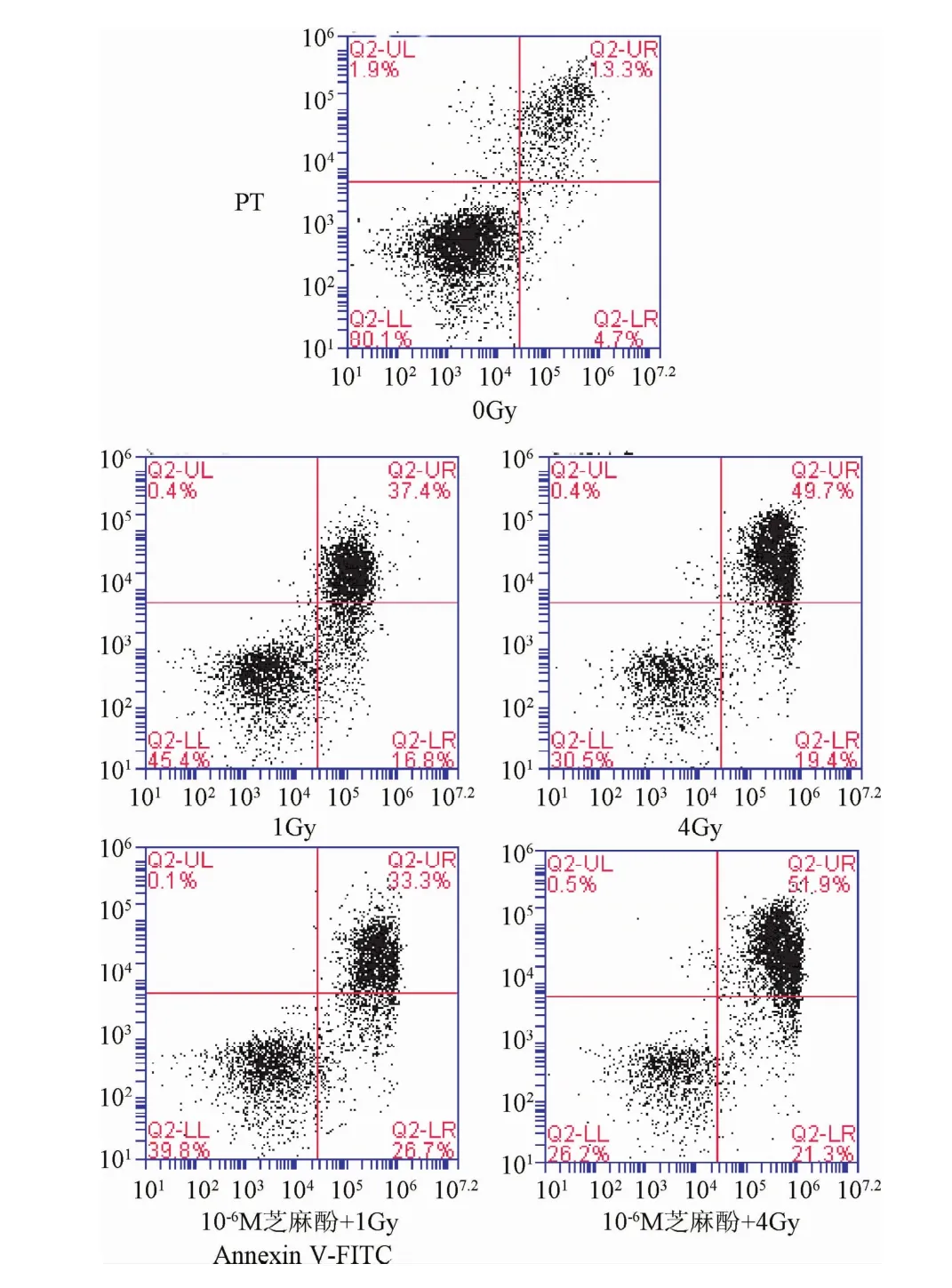
图2 流式检测小鼠骨髓c-kit阳性细胞细胞凋亡Fig.2 Representative image ofmice bonemarrow c-kit positive cells apoptosis by flow cytometry
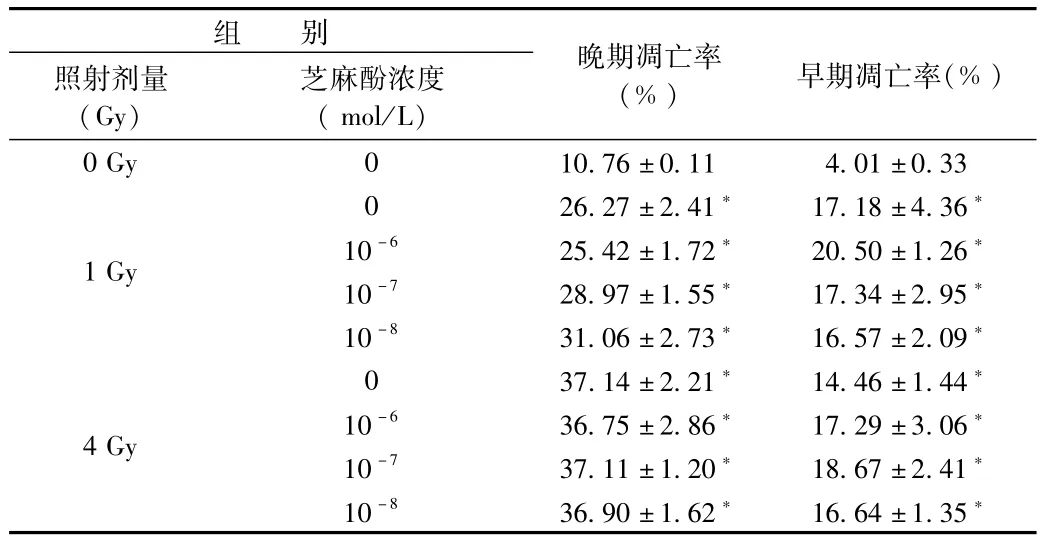
表2 不同浓度芝麻酚对1 Gy、4 Gy照射骨髓c-kit+细胞细胞凋亡的影响Tab.2 Effects of different concentrations of sesamol and 1 Gy,4 Gy irradiation on apoptosis of bonemarrow c-kit+cells
2.4 芝麻酚对小鼠骨髓c-kit阳性细胞粒单系克隆形成能力的影响 1 Gy剂量照射组的集落形成数量较对照组下降40.38%(P<0.05),4 Gy剂量照射组的集落形成数量较对照组下降87.69%(P<0.05),表明本实验构建的辐射损伤模型是成功的。在1 Gy照射时,10-7mol/L芝麻酚组较照射组集落形成数量提高了29.03%(P<0.05);在4Gy照射时,10-7和10-6mol/L芝麻酚组较照射组集落形成数量分别提高了56.25%和40.00%,差异均具有统计学意义(P<0.05,见图 3)。
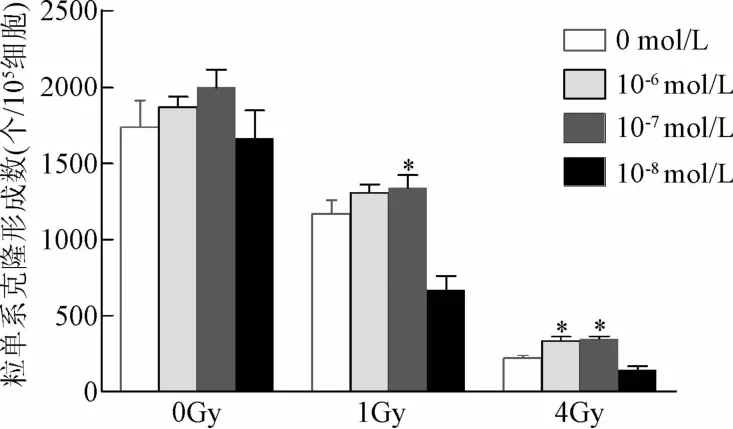
图3 芝麻酚及照射对小鼠粒单系克隆形成能力的比较*P<0.05,与空白对照组相比Fig.3 Comparison of the effects of sesamol and irradiation on mice CFU-GM*P<0.05,compared with blank control group
3 讨论
造血干细胞是存在于造血组织中的一群特殊细胞,具有自我更新以及分化生成造血系统中各类成熟血细胞的原始细胞的能力。自我更新能力的差异导致了造血干细胞(haematopoietic stem cells,HSCs)功能的异质性,进而被分成3个不同亚群:长期造血干细胞(long term haematopoietic stem cells,LT-HSCs)、短期造血干细胞(short term haematopoietic stem cells,ST-HSCs)和多能祖细胞(multipotential predecessors,MPPs)[14]。造血系统是辐射损伤敏感靶器官,中低剂量射线照射易引起造血祖细胞损伤,进而导致急性骨髓抑制[15-16]。因此,造血系统中造血祖细胞对辐射较为敏感,有效的低毒性药物能够减轻辐射引起的造血祖细胞损伤。本研究旨在观察芝麻酚对骨髓c-kit阳性细胞辐射损伤的体外保护作用,在正常骨髓中,约50%CD34+祖细胞(包括定向的红系、粒单系和巨核细胞系)表达c-kit(CD117)。c-kit表达被认为是骨髓造血干细胞较早分化阶段的特征性标志[17]。故实验选取骨髓c-kit+细胞作为研究对象。实验结果显示:芝麻酚对 c-kit+细胞毒性作用较小,在浓度为10-8~10-5mol/L时细胞活力水平变化不大,仅在浓度>10-4mol/L时候有明显的细胞毒性作用。
1Gy、4 Gy剂量照射前加入芝麻酚孵育30min,与未加芝麻酚组比较,细胞活力明显增加,说明芝麻酚对小鼠骨髓c-kit+细胞辐射损伤有一定保护作用。观察到这一作用后,本研究继续探讨保护作用的可能机制。集落形成实验是功能实验,检测骨髓造血祖细胞增殖能力,c-kit+细胞集落形成能力的结果显示,使用芝麻酚后c-kit+细胞集落形成能力显著增加,说明芝麻酚能够有效提高造血祖细胞的增值能力,与本实验室之前体内研究结果一致[10]。射线照射会引起c-kit+细胞发生细胞凋亡,但芝麻酚对细胞凋亡未见明显的改善作用。
芝麻酚对小鼠骨髓c-kit+细胞辐射损伤有一定的保护作用,其最直接的作用是提高骨髓c-kit+细胞粒单系克隆形成能力。尽管芝麻酚对射线引起的细胞直接损伤没有明显的保护作用,但能够减轻射线对祖细胞增殖的抑制作用,更深层次的作用机制还需进一步研究。
[1] Wang Y,Liu L,Pazhanisamy SK,et al.Total body irradiation causes residual bonemarrow injury by induction of persistent oxidative stress in murine hematopoietic stem cells[J].Free Radic Biol Med,2010,48(2):348-356.
[2] Wang Y,Schulte BA,LaRue AC,etal.Total body irradiation selectively inducesmurine hematopoietic stem cell senescence[J].Blood,2006,107(1):358-366.
[3] Shao L,Feng W,Li H,et al.Total body irradiation causes long-term mouse BM injury via induction of HSC premature senescence in an Ink4a-and Arf-independent manner[J].Blood,2014,123(20):3105-3115.
[4] Meng A,Wang Y,Van Zant G,et al.Ionizing radiation and busulfan induce premature senescence in murine bone marrow hematopoietic cells[J].Cancer Res,2003,63(17):5414-5419.
[5] 邹仲敏,孙慧勤,罗成基.6 Gyγ射线诱导骨髓造血细胞凋亡[J].中华放射医学与防护杂志,1998,18(6):390-392.
[6] Okada S,Nakauchi H,Nagayoshi K,etal.In vivo and in vitro stem cell function of c-kit-and Sca-1-positive murine hematopoietic cells[J].Blood,1992,80(12):3044-3450.
[7] Kanimozhi P,Prasad NR.Antioxidant potential of sesamol and its role on radiation-induced DNA damage in whole-body irradiated Swiss albinomice[J].Environ Toxicol Pharmacol,2009,28(2):192-197.
[8] Jnaneshwari S,Hemshekhar M,Thushara RM,et al.Sesamol ameliorates cyclophosphamide-induced hepatotoxicity by modulating oxidative stress and inflammatorymediators[J].Anticancer AgentsMed Chem,2013 Dec 24.[Epub ahead of print]
[9] 邬志薇,蒋霞,童星,等.芝麻酚清除自由基及对辐照大鼠抗氧化能力的影响[J].中华放射医学与防护杂志,2013,33(1):37-39.
[10] 路璐,李德冠,张俊伶,等.芝麻酚对4Gy137Csγ射线照射小鼠造血功能的影响[J].中国生化药物杂志,2014,34(1):26-28.
[11] Noah JW,SeversonW,Noah DL,etal.A cell-based luminescence assay is effective for high-throughput screening of potential influenza antivirals[J].Antiviral Res,2007,73(1):50-59.
[12] Zhang H,Wang YA,Meng A,et al.Inhibiting TGFβ1 has protective effect on mouse bone marrow suppression following ionizing radiation exposure in vitro[J].JRadiat Res,2013,54(4):630-636.
[13] 张俊伶,路璐,李德冠,等.N-乙酰半胱氨酸对辐射致小鼠骨髓单个核细胞损伤的保护作用[J].天津医药,2014,42(1):54-57.
[14] Shao L,Luo Y,Zhou D.Hematopoietic stem cell injury induced by ionizing radiation[J].Antioxid Redox Signal,2014,20(9):1447-1462.
[15] Greenberger JS,Epperly M.Bone marrow-derived stem cells and radiation response[J].Semin Radiat Oncol,2009,19(2):133-139.
[16] 王月英,吴红英,李德冠,等.不同剂量137Csγ射线照射对小鼠造血系统的影响[J].国际放射医学核医学杂志,2013,37(1):1-4.
[17] Ikuta K,Eissman IL.Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation[J].Proc Natl Acad Sci USA,1992,89(4):1502-1506.
(编校:吴茜)
Protective effects of sesamol on radiation injury mouse bonemarrow c-kit+cell
LU Lu,ZHANG Jun-ling,LIDe-guan,MENG Ai-min
(Institute of Radiation Medicine,Chinese Academy of Medical Science and Peking Union Medical Collage.
Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine,Tianjin 300192,China)
ObjectiveTo investigate the protective effect of sesamol on radiation injury mouse bone marrow c-kit+cell,and further explore its possiblemechanism.MethodsMouse bonemarrow c-kit+cellswere collected by immunomagnetic cellsortingmethod.Therewere2 groups in the study:single dosing group and radiation plus drug group(doses of irradiation included 1Gy and 4Gy),and 10-8~10-3mol/L sesamolwere co-cultured with mouse bonemarrow c-kit+cell half hour before irradiation exposure,cells were then cultured for 18 hours under the conventional culture conditions(37℃ and 5%CO2).The viability ofmouse bone marrow c-kit+cells were measured by bioluminescence.The ability of colony-forming units were detected by CFU-GM and apoptotic rate of c-kit+cellswere detected by Annexin V/PIantiapoptotic assay.ResultsCompared with control group,after 1Gy and 4Gy irradiated,cell viability ofmouse bonemarrow c-kit+cellswere decreased 59.52%and 79.35%,respectively(P<0.05),the number of colony-forming were decreased 40.38%and 87.69%,respectively(P<0.05).Cell viability of c-kit+cells and the number of colonies formed were significantly increased with sesamol concentration between 10-8~10-6mol/L,butnot improve apoptosis rate.ConclusionSesamol has protective effect on irradiation-induced injury in mouse bonemarrow c-kit+cells,themechanism ofwhichmay be related to the ability of hematopoietic progenitor cells proliferation.
sesamol;c-kit+cell;bonemarrow;radiation injury;radiation protection
R551
A
1005-1678(2014)04-0001-04
造血细胞是一个增殖活跃的细胞群,当受到放射线损伤时,即会发生造血功能障碍,其主要原因之一是杀伤了维持造血功能的造血干/祖细胞[1-4],机体造血主要依靠造血祖细胞来扩增[5]。c-kit是造血祖细胞表达干细胞因子的受体[6]。
芝麻酚(sesamol,SM)化学名称为 3,4-亚甲二氧基苯酚,原由芝麻油提取分离而得,具有一定的损伤防护作用。研究发现,芝麻酚可有效降低受照小鼠外周血淋巴细胞DNA损伤[7],通过调节氧化应激和炎症介质改善环磷酰胺诱导的大鼠肝毒性[8],提高60Coγ射线照射大鼠的抗氧化能力[9],本实验室先前研究结果显示芝麻酚可以提高小鼠骨髓细胞粒单系克隆形成能力[10]。但芝麻酚在体外对造血细胞是否也有保护作用并不清楚。本文旨在探讨芝麻酚对小鼠骨髓c-kit+细胞辐射损伤后的影响。
国家自然科学基金资助项目(81372928);协和青年基金和中央高校基本科研业务费专项资金(3332013044);中国医学科学院放射医学研究所学科发展专项基金(1340)
路璐,女,硕士,助理研究员,研究方向:造血和免疫辐射损伤防治,E-mail:lulu@irm-cams.ac.cn。

