黏膜特异性多肽修饰载胰岛素口服纳米粒的制备及其体内外评价
刘智强,陈旭东,龙方懿,祝慧凤△
(1.西南大学 药学院,重庆 400715;2.万州区龙驹镇中心卫生院,重庆 404000;3.四川大学 华西药学院, 四川 成都 610041)
黏膜特异性多肽修饰载胰岛素口服纳米粒的制备及其体内外评价
刘智强1,陈旭东2,龙方懿3,祝慧凤1△
(1.西南大学 药学院,重庆 400715;2.万州区龙驹镇中心卫生院,重庆 404000;3.四川大学 华西药学院, 四川 成都 610041)
目的构建黏膜细胞特异性多肽(CSK)修饰的载胰岛素(insulin,INS)口服纳米粒(CSK-INS-NPs),并对其体外性质以及体内降血糖效果进行评价。方法用复乳法制备CSK修饰的载胰岛素聚乳酸羟基乙酸(poly lactic-co-glycolic acid,PLGA)纳米粒,对其理化性质和包封率进行考察。通过体外人克隆结肠腺癌细胞(Caco-2)摄取实验考察CSK修饰的纳米粒的细胞穿透能力和跨膜能力。构建糖尿病模型大鼠评价口服纳米粒的降血糖能力。结果制备得到的CSK-INS-NPs粒径为(134.4±15)nm,粒径多分散系数小于0.3,胰岛素的包封率(EE%)为71%。体外Caco-2细胞摄取实验表明,细胞对CSK-INS-NPs摄取量是INS-NPs的2.8倍。相比于INS-NPs,CSK-INS-NPs能够更加高效的穿透Caco-2细胞层。糖尿病大鼠的降糖实验表明,在10 h内,口服CSK-INS-NPs能够降低血糖浓度,且保持稳定。结论CSK能够促进载胰岛素纳米粒跨越Caco-2细胞膜,CSK-INS-NPs是一种潜在的高效口服胰岛素载体给药系统。
胰岛素;纳米粒;降糖作用;多肽
糖尿病是一种与胰腺胰岛相关的免疫性疾病,体现为胰岛p细胞分泌功能发生障碍而导致胰岛素分泌缺乏,使血液中葡萄糖不能被肝脏、肌肉等组织转化为糖原。权威杂志Diabetes Care报道[1]:2000年全球糖尿病患者约为1.71亿人,患病率为2.8%;估计到2030年,将增至3.66亿人,患病率达到4.4%。美国糖尿病协会2005年统计,美国糖尿病患者已超过200万,约占美国总人口的7.0%[2]。而我国目前糖尿病患者约4000万,患病率已高达3.2%,并且正以每年新增120万患者的速度递增[3-4]。
胰岛素是脊椎动物胰脏p细胞分泌的多肤类激素,具降血糖作用,迄今为止仍为胰岛素依赖型糖尿病患者的首选药物,临床主要以注射给药为主。患者长期注射胰岛素会产生许多不良反应,如胰岛素浮肿、低血糖反应、肥大性脂肪营养不良、皮下脂肪萎缩、注射部位炎症,硬结等。因此开发非注射给药的胰岛素制剂成为了糖尿病治疗研究的一个热点。目前已有包括吸入剂、植入剂、透皮吸收制剂[5]等多种剂型的胰岛素给药方式,然而这些剂型的销售和治疗效果都不理想。有研究表明,胰岛素经口服途径给药最接近正常生理状态下的胰岛素分泌模式,但胰岛素为亲水性物质,透过生物膜能力差,三维空间结构脆弱,对环境敏感,在胃肠道中易被降解,口服生物利用度极低,仅注射途径的0.5%[6]。本文研究了一种新型的胰岛素口服PLGA纳米粒给药系统,PLGA是FDA批准可用于纳米载药系统的缓释药用材料,PLGA纳米粒可有效保护胰岛素免受胃肠道酶降解,增加其黏膜吸收[7-8],同时,纳米粒采用多肽CSK修饰后能够高效的穿透Caco-2细胞结构,实现胰岛素的口服靶向和控释给药。
1 材料与方法
1.1 材料 雄性SD大鼠(许可证号:20136281703,武汉大学动物实验中心),Caco-2细胞(购自ATCC),人重组胰岛素冻干粉(徐州万邦),DMEM高糖培养液(Gibco),胎牛血清(Gibco),Hank’s缓冲液(Gibco),胰酶(含EDTA,Gibco)。异硫氰酸荧光素(FITC,Sigma),链脲佐菌素(STZ,Sigma),聚乳酸羟基乙酸(PLGA,山东省医疗器械研究所),其他试剂为分析纯。
1.2 方法
1.2.1 细胞培养:Caco-2细胞用DMEM高糖培养液培养,培养液中含10%胎牛血清、100 U/mL的青霉素、100 mg/L的链霉素。细胞置于37℃,饱和湿度,5%CO2的培养箱中培养,取对数生长期用于实验。
1.2.2 FITC标记胰岛素的制备:参照文献方法[9],取FITC溶解于丙酮,胰岛素溶于pH 7.2的含EDTA磷酸缓冲液,将FITC溶液加入胰岛素溶液中,避光下置磁力搅拌器搅拌12 h,得到产物。将产物过葡萄糖凝胶柱,得到纯化后的FITC标记胰岛素。
1.2.3 CSK修饰载胰岛素PLGA纳米粒的制备:参照文献方法[10]合成CSK-PEG 2000-PLGA。称取适量 FITC-INS溶解于含0.5%PVA的水溶液中,PLGA和CSK-PEG 2000-PLGA溶解于乙酸乙酯中,然后将水相缓缓注入有机相中,同时磁力搅拌,加完后超声得胰岛素初乳溶液(w/o)。将制备的初乳与含有浓度 20%的poloxmaer 188的外水相混合,同法超声,即得胰岛素复乳(w/o/w)。室温减压旋转蒸发至乙酸乙酯挥发完全,可得乳光明显的胶体分散系,即得 CSK-INS-NPs。
1.2.4 载胰岛素纳米粒粒径、电位和包封率的测定:取CSK-INS-NPs 溶液适量用马尔文激光粒度仪测定其粒径、PDI 和电位。CSK-INS-NPs 超高速离心,取上清液用高效液相色谱法测定其胰岛素的含量。采用C18色谱柱,以乙腈∶水(0.2 mol/L Na2SO4,磷酸调pH至2.3)=28∶72为流动相,纳米粒胰岛素包封率的计算公式为:包封率=(投药量-上清液胰岛素质量)/投药量×100%
1.2.5 Caco-2细胞对CSK-INS-NPs的摄取考察:培养 Caco-2细胞接种于24孔板中,当孔板中细胞完全贴壁且处于对数生长期时加入一定量载FITC标记胰岛素纳米粒样品和FITC标记胰岛素,混合均匀后于CO2培养箱中孵育2 h和4 h后,弃去培养基,加入适量PBS清洗3次,加入1 mL 1% triton-100裂解细胞,4℃避光裂解0.5 h以上,待裂解完全后,取各组样品各200µL在 Ex=498 nm、Em=520 nm 用荧光分光光度计测定的荧光强度。
为了定性考察Caco-2细胞的摄取情况,将给药培养4 h 后的细胞加入适量PBS清洗3次,加4%多聚甲醛固定15 min,弃去多聚甲醛,用冰PBS保存。置激光共聚焦荧光倒置显微镜观察细胞摄取情况。
1.2.6 CSK-INS-NPs的跨膜转运实验:将Caco-2细胞以2×105cells/cm2接种于Transwell聚碳酸脂膜上,培养3周后,用WPI细胞跨膜电阻仪测定跨膜电阻值(TEER),当TEER值大于400 Ω·cm2时,可用作跨膜转运实验。跨膜转运实验时,上腔A面加入纳米粒溶液,对照组为胰岛素溶液,下腔B面均为PBS缓冲液。定时取出下腔B面溶液,用荧光分光光度法测定其中FITC标记胰岛素含量。
1.2.7 糖尿病大鼠的降血糖研究:取雄性健康SD大鼠实验前禁食24 h,SD雄性大鼠腹腔注射60 mg/kg链脲佐菌素,1周后用血糖仪测定大鼠血糖,血糖浓度大于14 mmol·L-1大鼠为高血糖模型大鼠。将建模成功的SD大鼠30只随机分成5组,分别为口服生理盐水组、口服胰岛素溶液组(50 IU/kg)、口服INSNPs(50 IU/kg)、口服CSK-INS-NPs(50 IU/kg)和注射胰岛素组(5 IU/kg)。在2 h、4 h、6 h、8 h和10 h用血糖仪检测大鼠的血糖值。
1.3 统计学方法 全部数据用SPSS 17.0统计软件进行处理。正态计量数据“x±s”表示。两组间均数比较采用t检验,多组间比较采用单因素方差分析(One-Way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 CSK-INS-NPs的粒径、PDI、电位和胰岛素包封率制备的纳米粒粒径与电位结果如表1所示,不同纳米粒的的粒径均小于200 nm,PDI小于0.3,zeta电位为-14 mV左右,胰岛素的包封率达到70%以上。
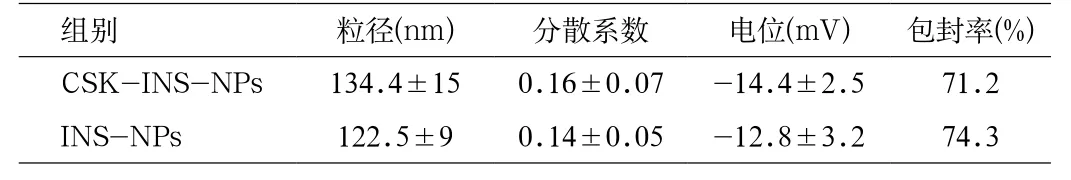
表1 不同载胰岛素纳米粒的粒径、电位和包封率(n=3)Tab.1 The size, zeta potential and entrapment ef fi ciency of insulin(n=3)
2.2 CSK增强Caco-2细胞对纳米粒的摄取 Caco-2细胞与CSK-INS-NPs共同孵育后的荧光定量结果见图1,结果显示Caco-2细胞对CSK-INS-NPs的摄取效率分别是INSNPs和胰岛素水溶液的2.8倍和6.5倍。

图1 Caco-2 细胞对不同胰岛素的摄取情况Fig.1 The uptake of different insulin by Caco-2 cells
Caco-2细胞摄取的定性观察结果见图2,结果显示,CSKINS-NPs组、INS-NPs组和胰岛素水溶液组荧光依次减弱。

图 2 共聚焦显微镜Caco-2细胞对标记FITC胰岛素的摄取Fig.2 The confocal laser scanning microscopy (CLSM) images show the internalization of fluorescent insulin in cells
2.3 CSK增强纳米粒跨膜转运能力 通过检测下腔B面均为PBS缓冲液的荧光强度,可以观察到胰岛素的跨膜量随着时间的增加而增大,跨膜能力CSK-INS-NPs组>INS-NPs组>胰岛素水溶液组(见图3)。
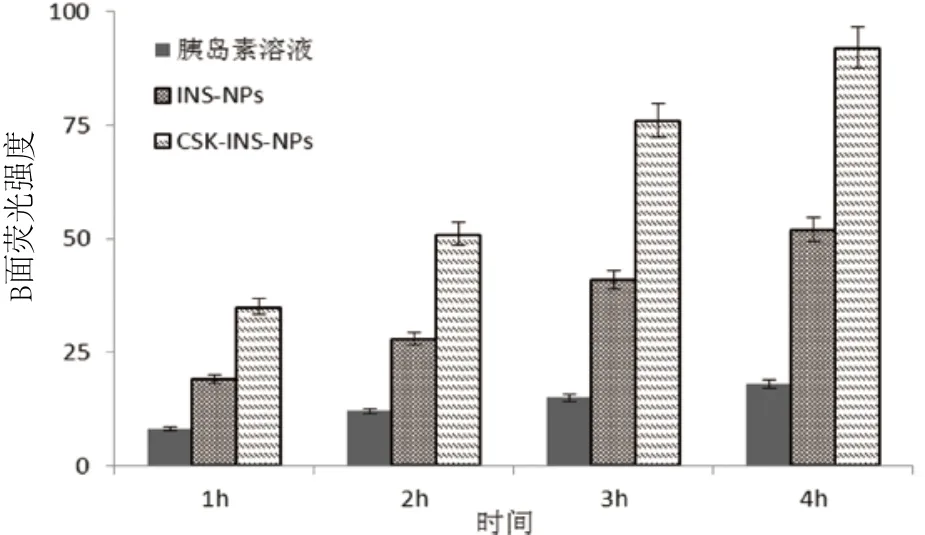
图3 随时间变化过膜胰岛素的量Fig.3 The ratio of insulin across the Caco-2 cell monolayer
2.4 CSK-INS-NPs具有稳定持续降血糖作用 糖尿病大鼠的降血糖实验表明,与生理盐水组相比,注射胰岛素和口服胰岛素均具有降血糖作用,在给药后10 h内,注射胰岛素组大鼠血糖水平有一个明显的下降再回升的过程,在2 h后血糖水平降到最低,在8 h后恢复到给药前的水平,口服胰岛素溶液组血糖水平略微下降迅速回到给药前水平。而口服CSK-INS-NPs组在10 h内血糖水平稳定,10 h后血糖浓度为给药前71%(见图4)。

图4 给药后的大鼠血糖变化曲线Fig.4 The blood glucose level of initial
3 讨论
纳米粒是有可生物降解的聚合材料构成的直径在10~1000nm的粒子,纳米粒作为药物载体可以减缓或消除体液中酸、碱和酶对包封于载体内药物的作用,提高药物的生物稳定性,避免药物在达到病灶部位前被破坏;聚合材料降解缓慢可以实现药物缓释[11],延长药物作用时间,减少给药剂量和毒副作用;通过控制纳米粒粒径,可克服体内物理屏障,使药物靶向输送至病灶器官或组织的毛细血管,并透过毛细血管上的孔隙进入血管内或组织[12]。另外,对聚合材料进行表面修饰可以实现纳米粒的主动靶向。CSK肽是一段序列为CSKSSDYQC的具有生物活性的多肽。CSK是通过噬菌体展示技术得到的与肠内皮细胞具有高度亲和性的多肽,它可以高效的与肠内皮细胞结合,穿过内皮细胞层,进入毛细血管[10-16]。本研究将胰岛素包载到纳米粒中,并将CSK连接到纳米粒表面,实现了胰岛素口服缓释给药同时,利用CSK与肠内皮细胞的高度亲和性实现纳米粒的高效吸收。
本研究采用化学方法把FITC标记胰岛素,通过FITC荧光定量考察Caco-2细胞对CSK-INS-NPs的摄取。细胞摄取实验结果显示,CSK-INS-NPs与Caco-2细胞能够高效结合,介导入胞。在考察纳米粒Caco-2细胞单层膜的跨膜转运实验过程中,各组跨膜电位均保持稳定,没有降低,这表明,各给药组均是通过细胞内吞途径跨膜,而不是破坏细胞之间的间隙。降血糖实验表明,CSK-INS-NPs在10 h后还能持续稳定的发挥降血糖作用,使血糖浓度维持在给药前75%左右,注射胰岛素组血糖在2 h迅速降低,在8 h后恢复到给药前水平。而口服胰岛素溶液组血糖浓度只是略微下降后迅速回升。因此,CSK-INS-NPs是一种高效缓释胰岛素口服给药系统。
综上所述,本研究制备了肠内皮细胞靶向性的多肽CSK修饰的PLGA纳米粒,解决了胰岛素口服给药容易被胃蛋白酶破坏,不能跨越生物膜等问题。该纳米粒与Caco-2细胞具有良好的亲和性,能够通过网格蛋白以及内吞小穴介导的细胞内吞作用穿过肠内皮细胞层。由于PLGA聚合材料能够实现药物缓释,能够持续稳定发挥降血糖作用。另外,相较于注射给药,口服载胰岛素纳米粒还能够减少给药次数。因此,CSK修饰的载胰岛素纳米粒是一种潜在的高效的胰岛素口服给药系统。
[1] Rathmann W.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030[J].Diabetes Care.2004,27(10):2568-2569.
[2] American Diabetes Association.National diabetes fact sheet,2005.
[3] 张如根,黄珊.十一世纪,糖尿病教育面临的挑战[J].实用糖尿病杂志,2004,1(4):48-50.
[4] 常向云,范玲,孙侃.糖尿病的治疗现状与糖尿病教育[J].医学与哲学(临床决策论坛版),2006,27(3):16-19.
[5] Cevc CX.Transdermal drug delivery of insulin with ultradeformable carriers[J]. Clin Pharmacolinet,2003,42(5):461-474.
[6] Ikesue K.Degradation of Proteins by guinea Pig intestinal enzymes[J].Int J Pharm,1993,95(1):171-179.
[7] Lowe PJ.Calcitonin and insulin in isobutylcyanoacrylate nanocapsules:Protection against Proteases and effecton intestinal absorption in rats[J].J Pharm Phannacol,1994,46(7):547-552.
[8] JanesKA.Polysaccharide colloidal Particles as delivery systems for macro molecules[J].Adv Drug Del Rev,2001,47(1):57-83.
[9] Hentz NG.Synthesis and characterization of insuln-lluorescein derivatives for bioanalyticalapplications[J].Anal Chem,1997,69(24):4994-5000.
[10] Yun J.Goblet cell-targeting nanoparticles for oral insulin delivery and the influence of mucus on insulin transport[J].Biomaterials,2011,33(5):1573-1582.
[11] Juliana M.Chan.PLGA lecithin PEG core shell nanoparticles for controlled drug delivery[J].Biomaterials,2009,30(8):1627-1634.
[12] Li Z.Lipid-polymer hybrid nanoparticles:synthesis,characterization and applications[J].Nano LIFE,2010,1(1):163-173.
[13] Schwarze SR.In vivo protein transduction:Delivery of a biologically active p rotein into the mouse[J].Science,1999,285(5433):1569-1572.
[14] Chen H.Lactoferrin-modified procationic liposomes as a novel drug carrier for brain delivery[J].Eur J Pharm Sci,2010,40(2):10-18.
[15] Frankel AD.Cellular up take of the tat protein from human immunodeficiency virus[J].Cell,1988,55(6):1189-1193.
[16] Kang SK.Identification of a peptide sequence that improves transport of macromolecules across theintestinal mucosal barrier targeting goblet cells[J].J Biotechnol,2008,135(2):210-216.
CSK-conjugated PLGA nanoparticles enhance oral delivery of insulin
LIU Zhi-qiang1,CHEN Xu-dong2, LONG Fang-yi3,ZHU Hui-feng1△
(1.College of Pharmaceutical science and Traditional Chinese Medicine, Southwest University, Chongqing 400715, China; 2. Center Hospital of Longju, Wanzhou 404000, China;3. Department of Pharmacology and Biopharmaceutics, West China School of Pharmacy, Sichuan University, Chengdu 610041, China)
ObjectiveTo investigate the effects of CSK-conjugated PLGA nanoparticles on oral delivery of insulin in vitro and in vivo.Method CSK-INS-NPs were prepared by double-emulsion. Nanoparticle size、zeta potential and entrapment efficiency were measured. The efficiency of cellular uptake on Caco-2 cells in vitro was evaluated. The hypoglycemic effects were evaluated by monitoring the glucose levels in diabetic rats。ResultsThe average sizes was(134. 4 ± 15)nm and their PDI values were less than 0.3.The insulin entrapment ef fi ciency was around 71%. The cellular uptake of CSK-INS-NPs by Caco-2 cells was 2.8 times higher than INS-NPs. The CSK-INS-NPs transferred more insulin across the Caco-2 cell monolayer than INS-NPs and insulin solution did. In vivo experiments,the CSK-INS-NPs could reduce the blood glucose level of diabetic rats after oral administration in 10 h.Conclusion Compared with insulin solution,CSK-INS-NPs enhanced the insulin through Caco-2 cell monolayer by transcellular pathway and may be a potential delivery system for Oral Delivery of Insulin.
insulin; nanoparticles; hypoglycemic effect; peptide
R 945
A
1005-1678(2014)01-0079-03
刘智强,硕士在读,研究方向:胰岛素口服给药系统的研究,Email:527236911@qq.com;祝慧凤,通信作者,女,博士,副教授,硕士生导师,研究方向:中药药理及新药研发工作,E-mail: zhfbsci@126.com。

