E G C G改善A P P/P S 1转基因小鼠认知功能及减轻海马胰岛素抵抗的机制研究
贾宁,韩锟
(辽宁医学院 附属第一医院 神经内科,辽宁 锦州 121001)
E G C G改善A P P/P S 1转基因小鼠认知功能及减轻海马胰岛素抵抗的机制研究
贾宁,韩锟△
(辽宁医学院 附属第一医院 神经内科,辽宁 锦州 121001)
目的探讨EGCG没食子酸酯(epigallocatechin-3-gallate, EGCG)减轻APP/PS1转基因小鼠海马胰岛素抵抗并改善认知功能机制。方法24只12月龄雌性APP/PS1小鼠随机均分为模型组(Tg)、EGCG低剂量组(Tg/EGCG-L)、高剂量组(Tg/EGCG-H),同月龄雌性C 57 BL/6 J小鼠作为对照组(NT)。采用Morris水迷宫检测各组小鼠学习、记忆能力,Western blot和免疫组织化学方法检测各组小鼠海马TNF-α/JNK信号及IRS-1 pSer 312的表达。结果与NT组比较,Tg组小鼠寻找平台的逃避潜伏期及平均路程显著延长(P<0.05),海马TNF-α/JNK信号异常活化、IRS-1 pSer 312表达明显升高(P<0.05).EGCG各治疗组较Tg组各异常指标均显著改善(P<0.05)。结论EGCG可减轻APP/PS1转基因小鼠海马胰岛素抵抗,改善认知功能,其机制可能与其降低TNF-α/JNK信号通路的活化相关。
表没食子儿茶素没食子酸酯;APP/PS1转基因小鼠;TNF-α/JNK信号;胰岛素抵抗
越来越多的证据支持阿尔茨海默病(Alzheimer’s disease,AD)本质上是一种代谢性疾病,与脑胰岛素抵抗导致的信号通路紊乱密切联系,包括调控神经元存活,能量生成,基因表达和突触可塑性,这一系列变化将最终损害记忆和认知的神经系统[1-2]。在外周组织炎症与胰岛素抵抗密切相关,许多炎症分子包括TNF-α等,能够使胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)丝氨酸位点发生异常磷酸化,阻断了正常的信号下传,导致胰岛素抵抗的发生[3-4]。最新研究[5-6]显示AD患者尸检脑组织及动物模型脑IRS-1 pSer636,312水平升高,提示存在中枢胰岛素抵抗。目前有效的预防或延迟AD中这一神经病理改变发生、发展的治疗手段仍非常有限。与其对胰岛素或其它合成药物感兴趣,我们更关注于研究一个大量存在于绿茶中的自然多酚类化合物,表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)。已有研究证实在外周胰岛素抵抗组织EGCG通过抗氧化、抗炎机制降低IRS-1 pSer 307水平从而减轻胰岛素信号阻断[7-10]。本实验我们首次通过给予
APP/PS1双转基因小鼠EGCG治疗4周,观察学习、记忆能力及海马IRS-1 pSer 312水平的变化,同时探讨其发生机制。
1 材料
EGCG(纯度95%,批号:E 4143),Sigma公司;兔抗IRS-1 pSer 312抗体(批号:ab 66154),Abcam;兔抗TNF-α抗体(批号:3707 S)、兔抗JNK抗体(批号:9258 P)、兔抗p-JNK抗体(批号:4668 P),Cell Signaling Technology;鼠抗GAPDH抗体(批号:KC-5G4),KangChen biotechnology;辣根酶标记羊抗兔或羊抗鼠IgG,北京中杉金桥有限公司;RIPA组织/细胞裂解液,碧云天生物技术研究所;PVDF膜,Millipore公司;蛋白Marker,Fermentas公司;ECL发光试剂盒,Pierce公司;超敏SP浓缩试剂盒,北京中杉金桥生物技术有限公司;DAB显色试剂盒,武汉博士德生物工程有限公司。
Morris水迷宫,江苏正华机电科技有限公司;生物研究显微镜,日本Olympus BX 51;数码照相机,日本NikonE 4500;电子天平,美国Ohaus;低温离心机、垂直电泳仪、凝胶图像分析系统,美国Bio-Rad;石蜡切片机,德国Leica。
SPF级12月龄雌性APPswe/PSldE 9(APP/PS 1)双转基因小鼠24只,相同月龄同背景C 57 BL/6 J小鼠8只,体质量25~30 g,中国医科大学实验动物部提供,许可证号:SYXK(辽)2008-0005。
2 方法
2.1 动物分组及给药 APP/PS1小鼠随机分为3组,每组8只。参照文献[11]给药方法如下:模型组(transgenic,Tg):每天灌胃0.15 mL的双蒸水1次;EGCG低剂量组(Tg/EGCG-L):每天1次按2 mg/kg灌胃0.04%的EGCG 0.15 mL;EGCG高剂量组(Tg/EGCG-H):每天1次按6 mg/kg灌胃0.12%的EGCG 0.15 mL。C 57 BL/6 J小鼠作为对照组(nontransgenic type,NT):每天灌胃0.15 mL的双蒸水1次。各组小鼠均连续灌胃4周。
2.2 各组小鼠学习、记忆功能测定 给药第3周末,采用Morris水迷宫测试小鼠定位航行等学习记忆能力。水迷宫实验期间,各组小鼠每日仍连续给药直至第4周末。实验平台设于水面下约1.5 cm,将小鼠于象限边缘1/2弧度处头朝池壁入水,同时摄像机开始记录。小鼠找到平台后,让其在平台上站立10 s。经60 s未找到平台者,则由实验者用手牵引其到平台上,放置10 s,再放回笼中。每只小鼠每天训练3次,时间间隔30 min。记录小鼠入水至找到平台并站立于其上所需时间,作为逃避潜伏期(tatency),用秒(s)表示,并记录从小鼠入水至找到平台通过路径的总长度(path length),用米(m)表示。若小鼠在60 s内未找到平台,则记录为60 s。实验共进行5 d。数据采集及图像分析均由图像自动监视和处理系统完成。
2.3 Western blot检测TNF-α/JNK 信号蛋白表达 行为学检测结束后,各组小鼠断头处死,迅速取出大脑放在冰盘上,从中间矢状缝切开,一半放入4%多聚甲醛中固定,常规制备石蜡切片,用于免疫组织化学染色;另一半迅速剥离海马于-70℃液氮罐中储存用于Western blot使用。取各组小鼠的海马组织,RIPA buffer裂解,考马斯亮蓝G 250测定总蛋白含量。SDS-PAGE分离蛋白,湿转蛋白质至PVDF膜,5%脱脂奶粉室温封闭2 h;一抗(TNF-α,1∶1000;JNK,1∶1000;p-JNK,1∶1000;GAPDH,1∶5000)4℃孵育过夜;辣根酶标记羊抗兔或羊抗鼠IgG(1∶2000)室温孵育60 min;暗室中ECL显影;Bio-Rad凝胶电泳图像分析仪进行采图,Quantity One软件包分析。对蛋白条带进行灰度值(分别以目的蛋白的整合密度值比内参GAPDH的整合密度值)分析。
2.4 SP法免疫组化检测IRS-1 pSer 312表达 常规免疫组化步骤进行。每组实验小鼠随机选取5张海马CA3区脑组织切片用光学显微镜(×400)观察每个视野中阳性蛋白表达,用计算机图像分析系统分别测定各组小鼠每张切片内表达阳性蛋白神经元的整合光密度值,并取各组平均值以反映海马CA3区神经元内阳性蛋白表达的相对含量。
2.5 统计学方法 采用SPSS 13.0统计软件进行数据处理分析,测定结果以“±s”表示。组间比较采用单因素方差分析。以P<0.05表示差异具有显著性意义,P<0.01为差异有极显著性意义。
3 结果
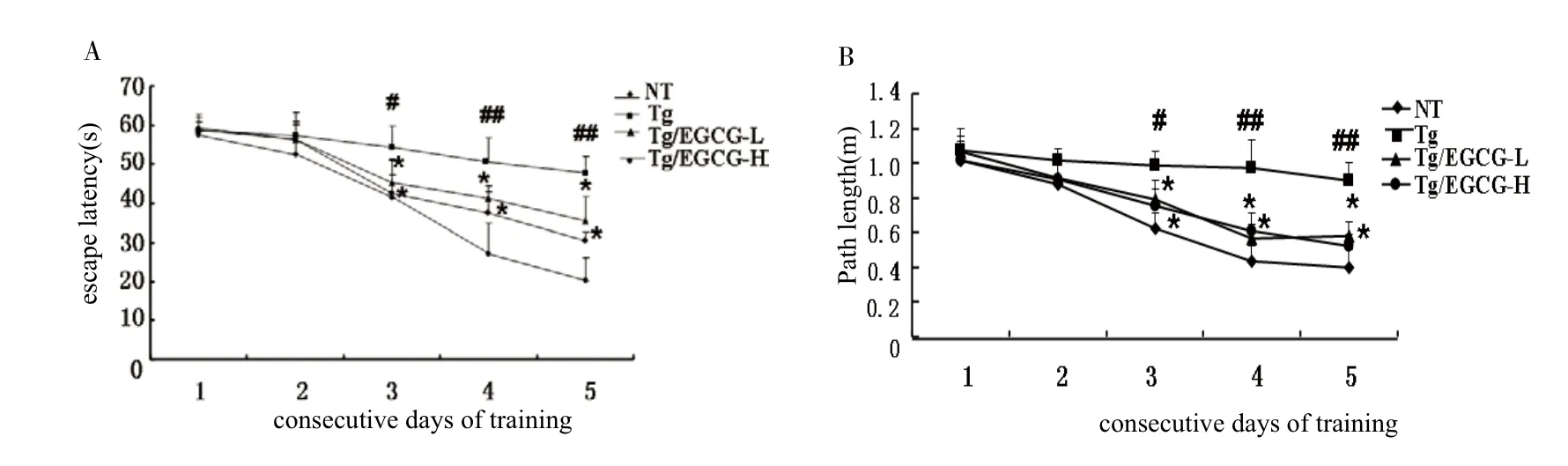
图1 EGCG 对 APP/PS 1 转基因小鼠 Morris 水迷宫定位航行试验中寻找平台逃避潜伏期(A)和寻找平台平均路程(B)的影响#P<0.05,##P<0.01,与NT组相比;*P<0.05,与Tg组相比Fig.1 Effect of EGCG on the escape latency(A)and swimming distance(B)of the navigation training in Morris water maze test with APP/PSl mice#P<0.05,##P<0.01,compared with NT group;*P<0.05 compared with Tg group
3.1 EGCG对APP/PS1转基因小鼠学习、记忆能力的影响 分析整理实验数据,得到各组小鼠在连续测试5天期间搜索隐蔽平台的逃避潜伏期(见图1 A)和搜索的平均路程(见图1 B)的趋势图。结果显示,随着训练时间的延长,各组小鼠搜索平台的潜伏期及找到平台所经过的路程随游泳次数增多呈下降趋势。试验第3天,与NT组相比,Tg组小鼠寻找平台的逃避潜伏期和寻找平台的平均路程均显著延长(P<0.05),实验第4天和第5天与NT组相比差异性极显著(P<0.01)。这提示APP/PSl小鼠与同月龄相同遗传背景的C 57 BL/6 J小鼠相比具有明显的学习记忆障碍。与Tg组相比,在隐蔽平台试验的第3~5天,Tg/ EGCG-L组与Tg/EGCG-H组小鼠寻找平台的逃避潜伏期和平均路程均显著缩短(P<0.05),结果表明 EGCG 可以有效改善APP/PS1转基因小鼠的学习与记忆障碍。
3.2 Western blot 检测各组小鼠海马 TNF-α/JNK 信号的表达 结果显示(见图2),Tg组小鼠海马TNF-α蛋白表达较NT组明显增加(P<0.05),EGCG各治疗组TNF-α蛋白表达较Tg组明显减少(P<0.05);Tg组小鼠海马p-JNK蛋白表达较NT组明显增加,总JNK蛋白各组表达水平不变,Tg组p-JNK/总JNK蛋白比值较NT组明显增加(P<0.01)。EGCG各治疗组p-JNK蛋白表达较Tg组减少,p-JNK/总JNK蛋白比值较Tg组明显减少(P<0.05)。以上结果提示EGCG可有效降低APP/PS1小鼠海马内TNF-α/JNK信号通路的异常活化。

图2 Western blot 方法测定 EGCG 对 APP/PS 1 小鼠海马 TNF-α/JNK 信号蛋白表达的影响#P<0.05,##P<0.01,与NT组相比;*P<0.05,与Tg组相比Fig.2 Effect of EGCG on the expression of TNF-α/JNK signaling in the hippocampus of APP/PS 1 transgenetic mice detected by Western blot#P<0.05,##P<0.01 compared with NT group;*P<0.05 compared with Tg group
3.3 免疫组化检测EGCG对APP/PS1小鼠海马IRS-1 pSer 312蛋白表达的影响 染色后,观察海马CA3区IRS-1 pSer 312的表达情况。结果发现(见图3),NT组未见明显IRS-1 pSer 312 阳性反应细胞;Tg组可见大量棕黄色的胞浆着色的IRS-1 pSer 312蛋白阳性细胞;EGCG各干预组可见中等量棕黄色的IRS-1 pSer 312蛋白阳性细胞,胞浆着色,较Tg组淡染。统计分析显示Tg组小鼠海马IRS-1 pSer 312蛋白表达与NT组相比明显增加,其整合光密度值显著升高(P<0.05);Tg/EGCG-L组和Tg/EGCG-H组小鼠治疗4周,IRS-1 pSer 312蛋白表达较Tg组明显减少,其整合光密度值明显降低(P<0.05)。提示EGCG治疗可有效减低APP/PS1小鼠脑内IRS-1 Ser 312磷酸化水平。
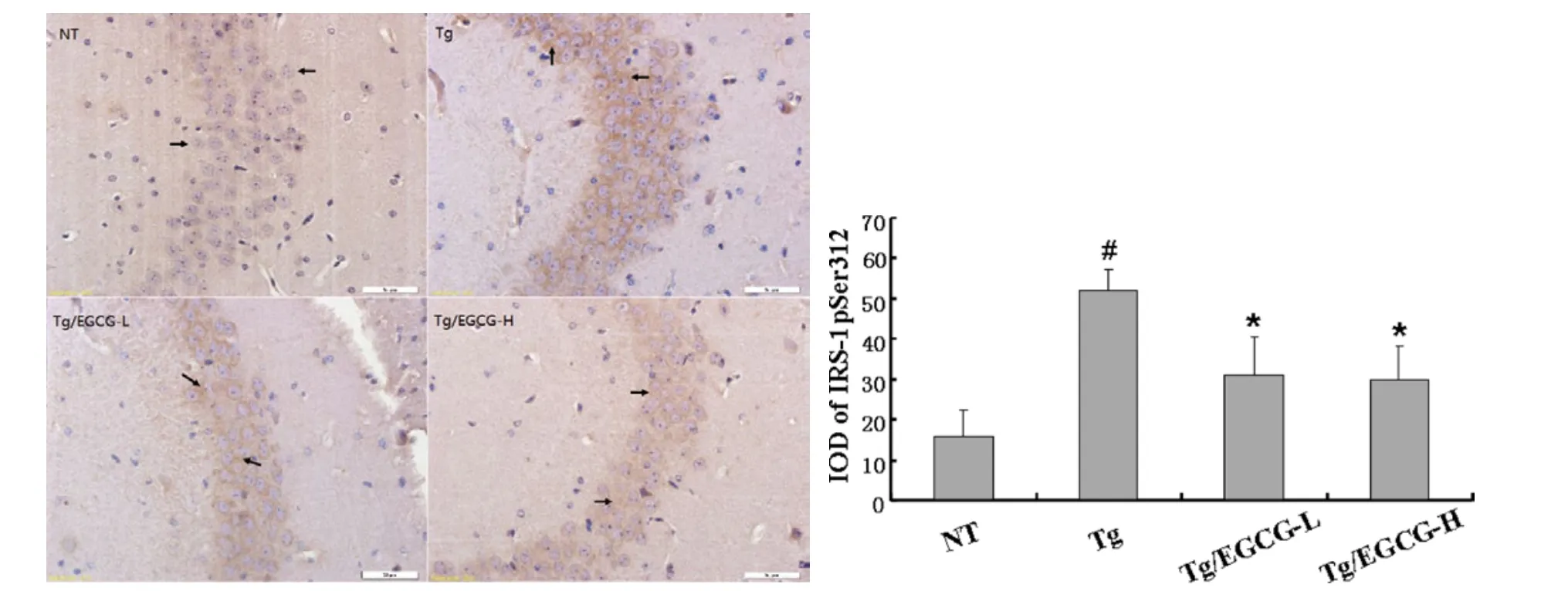
图3 免疫组化法观察EGCG对APP/PS1小鼠海马IRS-1 pSer 312蛋白表达的影响(×400)#P<0.0,与NT组相比;*P<0.05与Tg组相比Fig.3 Effect of EGCG on the expression of IRS-1 pSer 312 in the hippocampus of APP/PS 1 transgenetic mice detected by Immunohistochemical staining(×400)#P<0.05 compared with NT group;*P<0.05 compared with Tg group
4 讨论
阿尔茨海默病是老龄人群最常见的痴呆原因,多种病因参与了AD的发病机制。在大脑,胰岛素信号在调节学习记忆必需的突触活性中起着关键作用,因此胰岛素抵抗伴随信号通路破坏可能有助于形成AD认知功能损害[1-2]。生理情况下,胰岛素与胰岛素受体结合,酪氨酸磷酸化IRS-1,活化下游磷脂酰肌醇-3激酶(phosphatidylinositol 3 kinase,PI3 K),使胰岛素信号正常下传,发挥其生理功能。任何原因引起IRS-1丝氨酸位点的磷酸化,可以阻断其酪氨酸位点的正常磷酸化,使胰岛素信号下传受阻,导致胰岛素抵抗的发生。胰岛素抵抗的后果是胰岛素作用减弱,最终损害记忆和认知的神经系统。2012年,Talbot[12]等证实,AD患者脑内存在胰岛素抵抗,这种病理状态与脑内IRS-1功能异常及认知功能下降密切相关。某些治疗2型糖尿病的药物可能治疗AD也有效,Bomfim等[6]发现给予APP/PS1双转基因小鼠腹腔内注射长效胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)受体激动剂exendin-4能够减轻升高的IRS-1 pSer 636和IRS-1 pSer 312水平并且改善小鼠认知功能。本实验首次得到结论,绿茶提取物EGCG亦可以有效减轻APP/PS1小鼠海马IRS-1 pSer 312表达,调节中枢胰岛素信号转导,减轻脑胰岛素抵抗同时改善此动物模型在水迷宫定位航行实验中表现出的学习、记忆障碍,其潜在的药用价值越来越受到科学工作者的关注。
JNK被认为是最重要的介导外周胰岛素抵抗组织IRS-1丝氨酸磷酸化的应激激活激酶之一[13-14]。与2型糖尿病外周胰岛素抵抗发生机制相似的是,Bomfim[6]等证实JNK在脑神经元胰岛素抵抗发生过程中也起着关键性作用,JNK的异常活化可以引起海马神经元IRS-1丝氨酸位点磷酸化程度的升高,阻断胰岛素信号下传,导致中枢胰岛素抵抗的发生。已有研究证实EGCG作用于外周胰岛素抵抗组织,通过抗氧化、抗炎机制降低肝脏、脂肪、肌肉组织的IRS-1 pSer 307水平从而使胰岛素信号正常下传[7-10]。有一篇报道显示EGCG可以通过减轻TNF-α诱导的JNK活化缓解外周脂肪组织胰岛素抵抗[15]。但其能否作用于中枢未知,本实验进一步证实EGCG可以减轻APP/PS1小鼠海马TNF-α/JNK信号通路的异常活化,这可能部分解释了EGCG调节此动物模型中枢胰岛素信号转导机制。由于EGCG除了抗炎特性,还可以通过降低氧化应激、防止线粒体功能异常以及扮演潜在的自噬调节剂等角色来治疗外周胰岛素抵抗[16],而其在中枢神经系统也具有广泛的生物学作用,因此下一步我们将深入探讨EGCG改善AD等中枢神经系统变性病认知功能障碍的其他可能机制。
[1] De la Monte SM.Insulin resistance and Alzheimer’s disease[J].BMB Rep,2009,42(8): 475-481.
[2] Ghasemi R,Dargahi L,Haeri A,et al.Brain Insulin Dysregulation:Implication for Neurological and Neuropsychiatric Disorders[J].Mol Neurobiol,2013, 47(3):1045-1065.
[3] Gual P,Le Marchand-Brustel Y,Tanti JF.Positive and negative regulation of insulin signaling through IRS-1 phosphorylation[J].Biochimie,2005,87(1):99-109.
[4] Shoelson SE,Lee J,Goldfine AB.Inflammation and insulin resistance[J].J Clin Invest,2006,116(7):1793-1801.
[5] Ma QL,Yang F,Rosario ER,et al.Beta-amyloid oligomers induce phosphorylation of tau and inactivation of insulin receptor substrate via c-Jun N-terminal kinase signaling:suppression by omega-3 fatty acids and curcumin[J].J Neurosci,2009,29(28):9078-9089.
[6] Bomfim TR,Forny-Germano L,Sathler LB,et al.An anti-diabetes agent protects the mouse brain from defective insulin signaling caused by Alzheimer’s diseaseassociated A β oligomers[J].J Clin Invest,2012,122(4):1339-1353.
[7] Lin CL,Lin JK.Epigallocatechin gallate (EGCG) attenuates high glucose-induced insulin signaling blockade in human hepG 2 hepatoma cells[J].Mol Nutr Food Res,2008,52(8):930-939.
[8] Zhang ZF,Li Q,Liang J,et al.Epigallocatechin-3-O-gallate (EGCG) protects the insulin sensitivity in rat L 6 muscle cells exposed to dexamethasone condition[J].Phytomedicine,2010,(17):14-18.
[9] Li Y,Zhao S,Zhang W,et al.Epigallocatechin-3-O-gallate (EGCG) attenuates FFAs-induced peripheral insulin resistance through AMPK pathway and insulin signaling pathway in vivo[J].Diabetes Res Clin Pract,2011,(93):205-214.
[10] Deng YT,Chang TW,Lee MS,et al.Suppression of free fatty acid-induced insulin resistance by phytopolyphenols in C2 C 12 mouse skeletal muscle cells[J].J Agric Food Chem,2012,60(4):1059-1066.
[11] Koh SH,Lee SM,Kim HY,et al.The effect of epigallocatechin gallate on suppressing disease progression of ALS model mice[J].Neurosci Lett,2006,395(2):103-107.
[12] Talbot K,Wang HY,Kazi H,et al.Demonstrated brain insulin resistance in Alzheimer’s disease patients is associated with IGF-1 resistance,IRS-1 dysregulation,and cognitive decline[J].J Clin Invest,2012,122(4):1316-1338.
[13] Hirosumi J,Tuncman G,Chang L,et al.A central role for JNK in obesity an d insulin resistance[J]. Nature,2002,(420):333-336.
[14] Tanti JF,Jager J.Cellular mechanisms of insulin resistance:role of stressregulated serine kinases and insulin receptor substrates (IRS) serine phosphorylation[J].Curr Opin Pharmacol,2009,9(6):753-762.
[15] Yan J,Zhao Y,Suo S,et al.Green tea catechins ameliorate adipose insulin resistance by improving oxidative stress[J].Free Radic Biol Med,2012, (52):1648-1657.
[16] Yan J,Feng Z,Liu J,et al.Enhanced autophagy plays a cardinal role in mitochondrial dysfunction in type 2 Diabetic Goto–Kakizaki (GK) rats:ameliorating effects of (-)-epigallocatechin-3-gallate[J].J Nutr Biochem,2012,(23):716-724.
The mechanism study of EGCG on improvement of cognitive function and alleviation of hippocampal insulin resistance in APP/PS 1 transgenetic mice
JIA Ning,HAN Kun△
(Department of Neurology, The First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo explore mechanism of epigallocatechin-3-gallate (EGCG) on improvement of cognitive function and alleviation of hippocampal insulin resistance in APP/PS 1 transgenetic mice。Method12 months old female APP/PS 1 mice were randomly divided into 3 groups: model group(Tg), EGCG low dose group (Tg /EGCG-L), high dose group(Tg /EGCG-H). C 57 BL/6 J mice were utilized as control. learning and memory ability in 4 group mice were detected by morris water maze test(MWM). The hippocampal TNF-α/JNK signal and IRS-1 pSer 312 expression were detected by Western blot and immunohistochemical staining。ResultsCompared with NT mice, Tg mice showed a marked prolongation of the escape latency and swimming distance in the MWM test(P<0.05); Abnormal activation of TNF-α/JNK signaling and increased IRS-1 pSer 312 expression in the hippocampus of Tg mice(P<0.05). EGCG-treated Tg mice showed signi fi cantly improvement of all these abnormal changes(P<0.05)。ConclusionEGCG treatment is able to alleviate hippocampal insulin resistance and improve cognitive function in the APP/PS 1 mice. which may be partly attributed to the reduction of TNF-α/JNK signaling activity in this AD mouse model.
epigallocatechin-3-gallate; APP/PS 1 transgenetic mice; TNF-α/JNK signaling ; insulin resistance
R 741.05
A
1005-1678(2014)01-0012-04
辽宁省自然科学基金项目(2013022028);辽宁省科学技术计划项目(2012225019)
贾宁,女,博士,主治医师;韩锟,通信作者,男,研究方向:神经系统变性病的基础与临床研究工作,E-mail:13700166350@163.com。

