基于免疫层析的C R P定量检测试剂研制
蒋树海,杨发青,崔迎进,王程飞,许俊艳,周鸿锐
(1. 天津科技大学生物工程学院 天津市工业微生物重点实验室 教育部工业微生物重点实验室,天津 300457 ; 2. 天津中新科炬生物制药有限公司,天津 300092)
基于免疫层析的C R P定量检测试剂研制
蒋树海1,杨发青2,崔迎进2,王程飞2,许俊艳2,周鸿锐2
(1. 天津科技大学生物工程学院 天津市工业微生物重点实验室 教育部工业微生物重点实验室,天津 300457 ; 2. 天津中新科炬生物制药有限公司,天津 300092)
目的基于免疫层析技术,研制一种C反应蛋白(C reactive protein,CRP)定量检测试剂。方法采用双抗体夹心法,通过严格的原辅料筛选和生产工艺控制研制试剂,用基于光学定量的免疫层析结果判读记录仪进行定量检测,最后进行性能分析和临床试验。结果 研制出了定量检测试剂,功能灵敏度≤1 mg/L,CV≤15%,线性范围1~200 mg/L,室温稳定性12个月;经对220份临床样本进行验证,总符合率为98.6%,Pearson相关系数r=0.987,和对照试剂性能无显著性差异。结论 基于免疫层析技术,研制出一种操作简便、稳定性好的CRP定量检测试剂,可运用于现场或临床对CRP的快速定量检测。
C反应蛋白;免疫层析;定量检测;双抗体夹心
C反应蛋白(C reactive protein,CRP)是一种由5个相同亚单位组成的α球蛋白,在肝脏中合成,具有广泛的生理学意义。CRP正常情况下浓度很低,在多种疾病过程中特别是细菌感染时含量会明显增高,24~48 h内CRP的浓度迅速上升。尽管检测CRP上升不能作为特定疾病的指标,但对于多种炎症的判定具有意义[1-6]。此外,低水平的CRP与心血管疾病的发生有着密切的关系,是心血管炎症病变的生物标志物,可用于心血管和外围血管疾病的风险评估。目前CRP检测在临床上广泛应用[7-12]。
目前市场上CRP检测以免疫比浊法为主,对试剂存储和检测仪器都有一定的要求[13-14]。本研究目的是开发一种基于免疫层析的CRP胶体金定量检测试剂,操作简便、性能稳定、适于现场检测,以满足市场上差异化的需要。
1 材料与方法
1.1 材料 (1)主要原材料:CRP单克隆抗体,芬兰Hytest公司产品;羊抗鼠IgG:自制;CRP抗原:美国Meridian Biosciences产品,系从人血液样本中纯化的CRP样本,经标化后作为内控品使用;NC膜:型号HF 135,美国Millipore公司产品。其他对照品和化学试剂,从相应有资质的公司购买。(2)免疫层析结果判读记录仪:型号NS 3001,天津中新科炬生物制药有限公司产品。(3)临床样本:为天津第三中心医院和泰达国际心血管病医院就诊病人采集的血液样本。(4)临床对照试剂:英国朗道(Randox)公司免疫比浊法CRP检测试剂。
1.2 方法[13-16]
1.2.1 CRP抗体标记 以氯金酸-柠檬酸三钠还原法制备直径为40 nm的胶体金溶液,用0.2 M K2CO3将溶液调到pH 7.5。然后将溶液置于磁力搅拌器上搅拌,按1 mg抗体比100 mL胶体金溶液的比例将CRP标记抗体缓慢滴加到胶体金溶液中,继续搅拌1 h,再以终浓度为0.1%的BSA和0.1%的PEG 20000进行封闭30 min,标记结束后以12000 g离心15 min,弃上清,沉淀按75%原体积复溶至胶体金稀释液中。然后用喷金仪将胶体金溶液用均匀喷涂在样品垫上,再干燥3~4 h,制成胶体金垫,干燥储存。
1.2.2 CRP抗体包被 用0.01 M pH 7.4 PBS将CRP包被抗体配制成0.8 mg/mL,然后用喷膜仪将在NC膜上按1.5 uL/ cm进行划线包被,同时在NC膜上包被羊抗鼠IgG,用于试剂的质控,包被完成后将NC膜在干燥间干燥3~4 h,干燥储存。
1.2.3 试剂组装 准备好吸样垫、样品垫、PVC板、塑卡等包装材料,在干燥条件下将PVC板中央粘贴包被好的NC膜,NC膜上缘粘贴吸样垫,NC膜下缘粘胶体金垫,胶体金垫下缘粘贴样品垫,然后用裁切机将贴好的PVC板切成适当宽度的试纸条,再将试纸条装入塑卡中,密封于铝箔袋中,完成检测卡组装。
1.2.4 内置标准曲线制备 将CRP抗原用Randox免疫比浊法CRP检测试剂进行测定标化后,配制成1、3、10、50、100、200 mg/L的内控品,用制备好的试剂检测,用免疫层析结果判读记录仪读取检测线的光学GOD值,将浓度和GOD值按最小二乘法拟合曲线,再输入到免疫层析结果判读记录仪中,成为内置标准曲线。
1.2.5 检测方法 取10µL血清或血浆样本,或20µL全血样本,加入检测卡S孔中,再于B孔中加入80µL样本稀释液,15~20 min内用免疫层析结果判读记录仪检测,通过仪器内置标准曲线计算样本含量。
1.2.6 分析性能评估 分别应用CRP内控品、含干扰物质样本等对检测试剂进行相应的测试,评估试剂的功能灵敏度、检测范围、精密度、特异性和稳定性。
1.2.7 临床试验:在天津第三中心医院和泰达国际心血管病医院进行试验,检测样本220份临床血清样本,采用英国朗道(Randox)公司免疫比浊法CRP检测试剂作为对照。
1.2.8 统计学方法 检测数据用SPSS 17.0等软件,进行配对卡方检验、Kappa一致性分析、线性回归和Bland-Altman等分析考核试剂的临床符合率、相关性、一致性。同时检测来自于同一病人血清、血浆和全血样本各50份,考核试剂对不同样本的检测能力。
2 结果
2.1 功能灵敏度、检测范围、精密度和准确度 以CRP质控品为标准,对制备的试剂进行检测,每个样品平行检测10次,检验结果如下(见表1)。
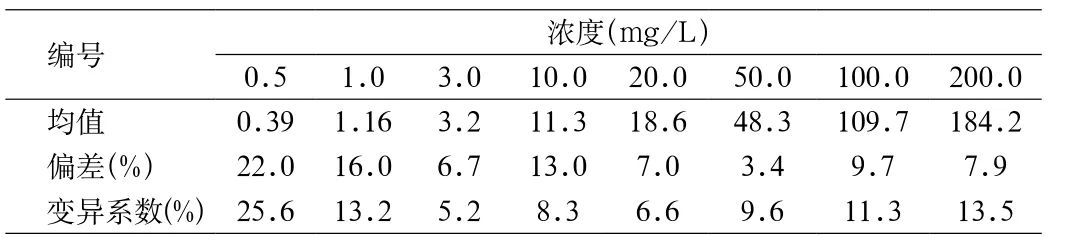
表1 试剂对不同浓度CRP内控品检测结果Tab.1 Result of the kit tested with CRP inner control samples
表1是对批制备的一批试剂检测结果,其他批次检测结果类似。可以看出,以变异系数(coefficient of variation,CV)≤20%作为功能灵敏度的标准,试剂的功能灵敏度可达到1 mg/L。以r>0.975、CV<15%作为定量检测的标准,在1~200 mg/L范围内,计算r=0.996,符合标准。同时可以看出,在1~200 mg/L范围内,检测的偏差<15%,准确度达到定量试剂标准要求。
2.2 分析特异性 对不同类型的样本进行检测,同类型的样本各检测5份,样本均来自于医院进行相关检测后的剩余样本。用考核试剂和对照试剂同时对其CRP含量进行检测,检测样本若同时为阴性或偏差<15%,则结果符合要求。结果表明,考核试剂对PCT≤20 ng/mL、AFP≤400 ng/mL、CEA≤400 ng/ mL,cTnI≤50 ng/mL无交叉反应;血红蛋白≤6 mg/mL,甘油三脂≤15 mg/mL,胆红素≤0.2 mg/mL对检测无明显影响;肝素、EDTA和枸椽酸钠抗凝血对检测结果无影响。
2.3 稳定性 试剂盒在室温条件下保存至15个月,定期测试,结果表明性能无明显变化,性能符合产品标准。说明试剂的稳定性较好,稳定性应该在12个月以上。
2.4 临床试验
2.4.1 对220份血清样本的检测结果进行分析,样本基本情况如下(见表2)。

表2 临床样本基本情况简介(n=220)Tab.2 Summary of clinical trail samples(n=220)
以对照试剂的检测结果为标准,可以看出,样本的值在1.00~184.00 mg/L内分布,较为离散,能反应实际临床样本分布的情况。
2.4.2 临床定性分析 对220份血清样本进行检测后,以10 mg/L作为感染参考值,检测结果如果下(见表3)。

表3 临床对比检测结果(n=220)Tab 3 Comparison result of testes with trail samples(n=220)
从上图可知,阳性符合率=53/53=100.00%(93.28%~100.00%);阴性符合率=164/167=98.20%(94.84%~99.63%);总符合率=217/220=98.64% (96.07%~99.72%);配对卡方检验(精确概率法):χ2=0.25,差异无统计学意义;一致性检验:Kappa= 0.963, 一致性较好。
2.4.3 临床定量分析 对220份血清样本的检测值分析,结果如下。Pearson相关系数r=0.987;F=7952.69,P<0.001,直线关系成立。Bland-Altam分析[5],220对检测数据有206(93.6%)对落在1.96 SD界内,均为高值样本(见图1)。

图1 Bland-Altam分析图Fig.1 The map of Bland-Altam analysis
2.4.4 血清、血浆和全血的一致性分析 对来自于同一病人血清、血浆和全血样本各50份样本进行检测后,进行直线回归和相关分析,血清血浆对比,r=0.989;血清和全血对比,r= 0.991。说明对血清、血浆和全血检测的一致性良好。
3 讨论
近年来,胶体金技术用于定性试剂的临床检测已得到广泛的认可[17-18]。然而在定量检测上存在难度,进入临床应用的试剂以进口试剂为主。根据国家相关标准的要求,定量试剂的准确性和精密度需要控制在15%以内,线性范围内r值无强制要求,但一般应不低于0.95[7]。
本研究以CRP对象,采用免疫层析胶体金技术研制开发定量检测试剂,从结果分析看,试剂的精密度、准确度和相关系数r均达到定量试剂的一般要求,成功研制出定量检测试剂;试剂的功能灵敏度、线性范围和稳定性和已市的相关试剂相比,能满足临床需要。在临床试验中,定性分析结果良好;定量分析除Bland-Altam分析外,各项数据结果良好。Bland-Altam分析中,少量的高值样本绝对偏差稍大,但如果分析相对偏差并不大,结果可以接受。并且高值均表示较为严重的炎症或感染,不影响临床结果判定。
在本试剂的研究中,我们总结出以下几个关键因素:(1)将检测线的胶体金光学信号定量化,需要有灵敏、可靠的检测仪器[19-20]。目前市场上相关仪器种类少,且大多不兼容。本产品采用本公司自主开发的通用型免疫层析判读记录仪[9-10],很好地解决了此问题。(2)需要对原辅材料和工艺进行严格的控制,以减少批内差异。经本研究检测,如果按一般的胶体金方法生产试剂,将结果转化为数字信号后,CV高于50%。其中NC膜本身的均一性、胶体金颗粒的大小、制备胶体金垫的均一性和组装过程中各个粘贴接头的严密程度均影响检测结果的CV值。只有采用更为严格的质量标准和工艺改进可以将CV降低到15%以内。(3)免疫层析法试剂需要样本将胶体金溶解后在NC膜上层析并进行免疫学反应,和免疫比浊等纯液相反应不同,反应速率受胶体金溶解速度、环境的温湿度及样本的粘度的影响。若采用速率法判定结果则CV值较大;采用终点法时由于反应较为完全,结果CV值较小,结果可信。(4)内置标准曲线虽然为检测带来了方便,然而各个检测实验室由于人员操作习惯、配套器具或环境的不同,会给检测结果带来一定的偏差,因而必要时需要进行系统的校准或质控,以得到为准确可信的检测结果。
目前市面上虽然已有比浊、超敏等多种CRP检测试剂,然而本研究的检测试剂具有操作简便、稳定性好、适用血清、血浆和全血多种样本、适于现场检测等特点,特别适合于中小型医疗卫生机构,方便普通民众的检测需要。
[1] Riedel M,Lafitte M,Pucheu Y,et al.Prognostic value of high-sensitivity C-reactive protein in a population of post-acute coronary syndrome patients receiving optimal medical treatment[J].Eu J Prev Card,2012,(19):1128-1137,
[2] Whelton SP,Roy P,Astor BC,et al.Elevated high-sensitivity C-reactive protein as a risk marker of the attenuated relationship between serum cholesterol and cardiovascular events at older age:The ARIC Study[J].Am J Epidemiol,2013,178(7):1076-1084.
[3] 张晓慧,李光韬,张卓莉.C反应蛋白与超敏C反应蛋白的检测及其临床意义[J].中华临床免疫和变态反应杂志,2011,35(1):74-79.
[4] Ridker PM.C-reactive protein:eighty years from discovery to emergence as a major risk marker for cardiovascular disease[J].Clin Chem,2009,55(2):209-215.
[5] Sanders S,Barnett A,Correa-Velez I,et al.Systematic review of the diagnostic accuracy of C-reactive protein to detect bacterial infection in non-hospitalized infants and children with fever[J].J Pediatr,2008,153(4):570-574.
[6] 王凡,蒋红君.C反应蛋白的检测与临床应用进展[J].检验医学与临床,2011,8(14):1761-1764
[7] Filiberto AC,Mumford SL,Pollack AZ.Habitual Dietary Isoflavone Intake Is Associated with Decreased C-Reactive Protein Concentrations among Healthy Premenopausal Women[J].J.Nutr,2013,(143):900-906,
[8] Tugirimana PL,De Clercq D,Holderbeke AL,et al.A functional turbidimetric method to determine C-reactive protein in horses[J].J Vet Diagn Invest,2011,23(2),308-311.
[9] Nikpour M,Gladman DD,Ibaňez D,et al.Variability and correlates of high sensitivity C-reactive protein in systemic lupus erythematosus[J]. Lupus,2009,18(11):966-73.
[10] Nabulsi M,Hani A,Karam M.Impact of C-reactive protein test Results on evidence-based decision-making in cases of bacterial infection[J].BMC Pediatr,2012,3(12):140.
[11] Hofer N,Zacharias E,Müller W,et al.An update on the use of C-reactive protein in early-onset neonatal sepsis:current insights and new tasks[J]. Neonatology,2012,102(1):25-36.
[12] Benitz WE,Han MY,Madan A,et al.Serial serum C-reactive protein levels in the diagnosis of neonatal infection[J].Pediatrics,1998,102(4):41.
[13] 中国国家标准化管理委员会.GB/T 26124-2011 临床化学体外诊断试剂(盒)[S].北京:中国标准出版社,2011.
[14] 陈延平,杜民.基于光电技术的金免疫层析试条定量测试的研究[J].仪器仪表学报,2002,23(3),331-332.
[15] Shemesh T,Rowley KG,Jenkins AJ,et al.C-reactive protein concentrations are very high and more stable over time than the traditional vascular risk factors total cholesterol and systolic blood pressure in an Australian aboriginal cohort[J].Clin Chem,2009,55(2):336-441.
[16] Sabatine MS,Morrow DA,Jablonski KA,et al.Prognostic significance of the Centers for Disease Control/American Heart Association high-sensitivity C-reactive protein cut points for cardiovascular and other outcomes in patients with stable coronary artery disease[J].Circulation,2007,115(12):1528-1236.
[17] Chandler J,Gurmin T,Robinson N.The Place of Gold in Rapid Tests[J].IVD Technology,2000,6(2):37-49.
[18] Coggins SA,Wynn JL,Hill ML,et al.Use of a Computerized C-Reactive Protein (CRP) Based Sepsis Evaluation in Very Low Birth Weight (VLBW) Infants:A Five-Year Experience[J].PLoS One,2013,8(11):78602.
[19] Hengst JM.The role of C-reactive protein in the evaluation and management of infants with suspected sepsis[J].Adv Neonatal Care,2003,3(1):3-13.
[20] Azarpazhooh MR,Mobarra N,Parizadeh SM,et al.Serum High-Sensitivity C-Reactive Protein and Heat Shock Protein 27 Antibody Titers in Patients With Stroke and 6-Month Prognosis[J].Angiology,2010,(61):607-612.
Development of a quantitative CRP test kit with lateral fl ow method
JIANG Shu-hai1, YANG Fa-qing2, CUI Ying-jin2, WANG Cheng-fei2, XU Jun-yan2, ZHOU Hong-rui2
(1.Tianjin Key Laboratory of Industrial Microbiology,Ministry of Education Key Laboratory of Industrial Microbiology, College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China; 2.Newscen Coast Bio-pharmaceutical Co., Ltd. ,Tianjin 300457, China)
ObjectiveA kind of quantitative C reactive protein (CRP) test kit was developed with colloidal gold lateral fl ow method。MethodThe kit was prepared with double antibody sandwich technology, and by material optimization and strict process control to improve performance. Quantitative assay was realized by a specialized lateral fl ow reader. The kit performance was evaluated with series of tests and clinical trial。ResultsThe kit was developed with functional sensitivity ≤ 1 mg/L, linear range 1-200 mg/L, CV <15% and with stability of 12 months. 220 samples clinical trial showed 98.6% of coincidence rate. Pearson Correlation coef fi cient r is 0.987, which showed no signi fi cant difference in performance compare with control kit。ConclusionA quantitative CRP test kit was developed with easy to operating and good stability, Which can be used for point of care testing or laboratory testing.
C reactive protein; lateral fl ow; quantitative assay; double antibody sandwich
Q 819
A
1005-1678(2014)01-0076-03
天津市科技型中小企业技术创新资金项目(12ZXCXSY04600)
蒋树海,男,博士,研究方向:代谢工程,Email:chuangxinzijin@126.com。

