蓝藻素通过诱导血红素氧化酶-1表达发挥对急性脓毒性肺损伤的保护作用
周定耕,詹向阳,张永虎,张大利
(1. 南华大学 附属第二医院 急诊科,湖南 衡阳 421001;2. 南华大学 附属第一医院 急诊科,湖南 衡阳 421001)
蓝藻素通过诱导血红素氧化酶-1表达发挥对急性脓毒性肺损伤的保护作用
周定耕1,詹向阳1,张永虎1,张大利2
(1. 南华大学 附属第二医院 急诊科,湖南 衡阳 421001;2. 南华大学 附属第一医院 急诊科,湖南 衡阳 421001)
目的观察藻蓝素(C-phycocyanin,CPC)对脓毒症急性肺损伤(acute lung injury,ALI)大鼠的保护作用及分子机制。方法75只SD大鼠随机分为对照组、模型组和3个CPC干预组。其中模型组采用盲肠结扎穿刺建立脓毒症急性肺损伤大鼠模型。CPC干预组在模型组基础上腹腔注射浓度为20、40、60 mg/kg 的CPC。术后72 h获取血液及肺组织标本,检测肺湿干重比(wet-to-dry weight ratio,W/D)、支气管肺泡灌洗液中TNF-α,IL-1 β和IL-6水平,以及肺组织中髓过氧化物酶(myeloperoxidase,MPO)活性;Western blot检测血红素氧合酶(heme oxygenase,HO)-1的表达以及Nrf2和NF-κB的激活。化学发光法检测超氧化物的产生,还原法检测肺组织中亚硝酸盐/硝酸盐的含量。结果CPC处理可显著抑制脓毒症急性肺损伤大鼠肺组织的炎症反应(P<0.05),如过氧化物形成、MPO活性、白细胞渗出以及蛋白含量,以及支气管肺泡灌洗液中促炎症细胞因子和亚硝酸盐/硝酸盐的水平。同时,CPC能显著促进ALI肺组织中核转录因子Nrf2的活化和HO-1表达(P<0.05),同时也能抑制NF-κB的激活。HO-1抑制剂锡原卟啉Ⅸ(tin protoporphyrin IX,SnPP)能减轻CPC在肺损伤大鼠中的保护效应。结论CPC对ALI大鼠的保护作用可能与诱导HO-1表达、NF-κB的激活,进而抑制炎症反应有关。
藻蓝素;脓毒症;急性肺损伤;血红素氧合酶1
1 材料与方法
1.1 主要实验试剂与仪器 CPC、锡原卟啉(tin protoporphyrin IX,SnPP)为Sigma-Aldrich产品(纯度均为98%)。兔抗鼠HO-1多克隆抗体、兔抗NF-κB p 65和抗Nrf2单克隆购自CellSignaling。兔抗鼠β-actin、兔抗TATA盒结合蛋白(TATA-boxbinding protein,TBP)多克隆抗体以及FITC标记羊抗兔 IgG抗体购自Santa Cruz,HRP标记羊抗兔IgG抗体购自Abcam。TNF-α,IL-1 β和IL-6 ELISA检测试剂盒购自深圳新博盛生物科技有限公司,采用其检测下限为5 pg/ml。Bradford蛋白浓度测定试剂盒购自Bio-Rad。主要实验仪器:发光测定仪(Microlumat LB 96 V,Berthold),一氧化氮分析仪(Nitric Oxide Analyzer,NOA),酶标仪(iMark,BIORAD)。
1.2 脓毒症急性肺损伤大鼠模型的构建及分组 雄性SPF级Sprague-Dawley雄性大鼠[动物许可证号:SCXK(湘) 2010-0004,体重200~250 g]购自南华大学实验动物中心,给予正常饲料喂养。本研究符合我校实验动物伦理委员会批准。动物随机分为5组(每组15只):(1)对照组(或假手术组):SD大鼠用10%水合氯醛生理盐水麻醉(400 mg/kg),去除毛发并进行皮肤消毒后,沿前腹正中线作3 cm长的切口,取出盲肠,然后逐层关腹。(2)模型组:取出盲肠后,用4.0丝线在距盲端1.5 cm处结扎,用18号针头在盲肠结扎处远端队穿刺2次,挤出少量粪便,随后将盲肠回纳入腹腔中,逐层关腹。(3)~(5)CPC干预组:术后2 h分别予20、40、60 mg/kg CPC,腹腔注射,12 h后给予第二次注射。72 h后获取大鼠组织标本用于下一步研究。
1.3 支气管肺泡灌洗液(BALF)的采集以及细胞因子、细胞计数以及蛋白浓度的测定 实验结束后,在右主支气管部位结扎右肺,随后通过气管插管注入5 mL无菌PBS,收集BALF。4℃,300 g离心10 min,上清液保存于-70℃备用。PBS重悬细胞沉淀,利用血细胞计数器对总细胞数量进行计数。同时利用ELISA方法测定BALF中TNF-α,IL-1 β和IL-6水平。Bradford方法测定BALF上清液中的蛋白浓度。以上操作步骤按照试剂盒提供的方法进行。
1.4 肺组织湿干比(wet-to-dry weight ratio,W/D)及髓过氧化物酶(myeloperoxidase,MPO)活性的测定 CO2麻醉处死大鼠,取各组右肺下部,获得湿重,然后在烤箱内60℃放置48 h,获取干重。计算肺湿/干比值。测定MPO活性时,肺组织加入50 mM KH2PO4(含5 mM Tris,pH 6.0)后超声破碎,并经3个冻融循环后,4℃、14000 g离心10 min。取20µl组织上清液与40µL分析缓冲液(含0.167 mg/ml二盐酸邻联茴香胺和0.0005% H2O2)混合,3 min内于460 nm处动态测定MPO活性。MPO的活性计算为460 nm处1 min内吸光度的改变值(ΔA),用ΔA/min·g·protein表示。
1.5 肺部O2-测定 新鲜的右肺组织切成5 mm×5 mm小块,用Krebs-HEPES缓冲液孵育5~10 min。随后加至含200µl Krebs-HEPES缓冲液(含1.25 mmol/L光泽精)的96孔培养板中,用发光测定仪于1 min内读取化学发光强度。随后将所有肺组织在60℃干燥48 h,计算其总蛋白干重。化学发光强度以1 min每毫克干重蛋白的相对发光单位(relative light unit,RLU)表示。
1.6 BALF中亚硝酸盐/硝酸盐的测定 BALF中加入两倍体积乙醇,20℃混合2 h以沉淀蛋白。随后加入1N HCl(含0.8%VCl3),使其将样本中的亚硝酸盐/硝酸盐还原为NO,并测量NO的浓度,与标准硝酸钠溶液进行比较,从而间接反应亚硝酸盐/硝酸盐的含量。
1.7 Western blot以及 NF-кB和Nrf2的核转位分析 根据试剂盒(Pierce)提供的步骤提取肺组织中的总蛋白和核蛋白,并测定其浓度。获取100µg蛋白用于SDS-PAGE。分离的总蛋白或核蛋白随后转印至PVDF膜上(Millipore),用含5%脱脂牛奶的TBST封闭1 h,随后分别加入抗抗HO-1(1:500)、β-actin(1∶5000)、抗p 65(1∶1000)或抗Nrf 2(1∶1000),抗TBP(1∶1000)的抗体4℃孵育过夜。多次洗涤之后,加入HRP标记的二抗(1∶10000稀释)孵育膜1 h。ECL法发光、显影。
1.8 统计学方法 所有实验重复3次,用SPSS 17.0软件进行统计学分析,正态计量数据用“x±s”表示,并采用单因素方差分析数据,P<0.05为差异具有统计学意义。
2 结果
2.1 CPC对BALF中的白细胞含量、MPO活性、蛋白水平、肺水肿以及硝酸盐含量的影响
ALI大鼠BALF中的总白细胞数量,肺MPO活性,蛋白水平,肺湿/干重比率以及硝酸盐显著增高(P<0.05)。不同浓度CPC干预后,与模型组相比,以上指标随之降低。此外,大鼠腹腔注射SnPP(50 mg/kg)抑制HO-1活性后,可明显逆转CPC预处理对ALI大鼠上诉指标的抑制作用(见表1)。
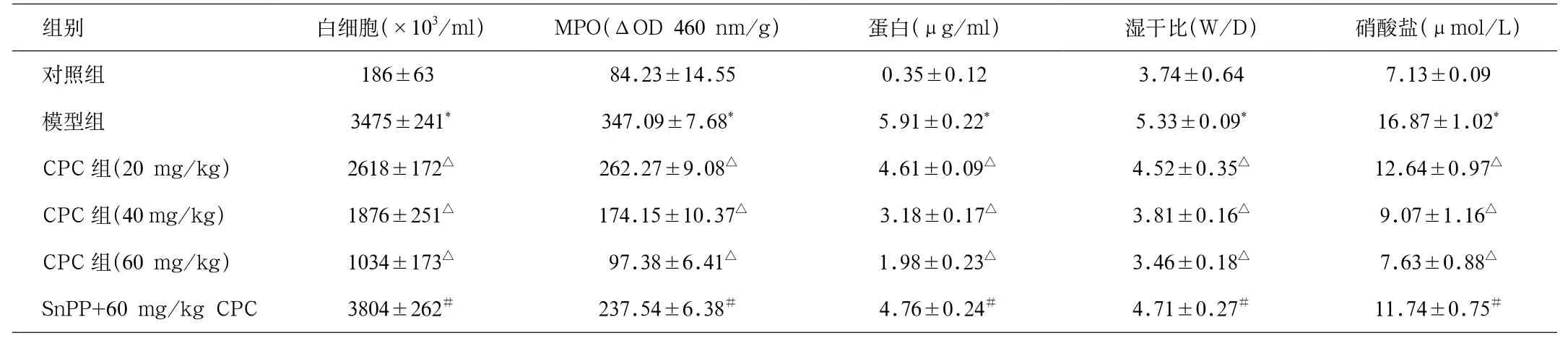
表1 各组BALF中MPO活性、白细胞、蛋白、硝酸盐含量以及肺组织湿干比(n=8)Tab.1 MPO activity, leucocytes, protein, nitrates content in BALF and wet/dry ratio(n=8)
2.2 CPC对肺组织中超氧化产物含量的影响 与对照组相比,ALI大鼠肺组织中明显增高。不同浓度CPC干预后,与模型组相比,超氧化产物含量随之降低。其中60 mg/kg CPC处理后,其含量降低至30.7%,而SnPP可明显消除CPC的抑制作用(见图1)。

图1. CPC对脓毒性ALI大鼠肺组织中超氧化物含量的影响1.对照组;2.模型组;3.20mg/kg CPC干预组;4.40mg/kg CPC干预组;5.60mg/kg CPC干预组;6.60mg/kg CPC+50 mg/kg SnPP*P<0.01,与对照组相比;△P<0.05 ,与模型组相比;#P<0.05,与 60mg/kg CPC组相比Fig.1 Effect of CPC on production of superoxide in septic rats1. Control group; 2. Model group; 3. 20mg/kg CPC group; 4. 40 mg/kg CPC group; 5: 60 mg/kg CPC group; 6: 60mg/kg CPC+50 mg/kg SnPP group*P<0.01, compared with control group;△P<0.05, compared with model group;#P<0.05 , compared with 60 mg/kg CPC group
2.3 各组BALF细胞因子含量测定 实验各组各时间点BALF中TNF-α、IL-1 β和IL-6水平见表2所示。与对照组相比,模型组大鼠BALF中TNF-α、IL-1 β和IL-6含量明显增高。不同浓度CPC干预后,TNF-α、IL-1 β和IL-6含量进一步降低,其中60 mg/kg CPC处理后,细胞因子含量显著低于20 mg/kg和40 mg/kg组(P<0.05),而SnPP处理后,能降低CPC对细胞因子的抑制作用(见表2)。
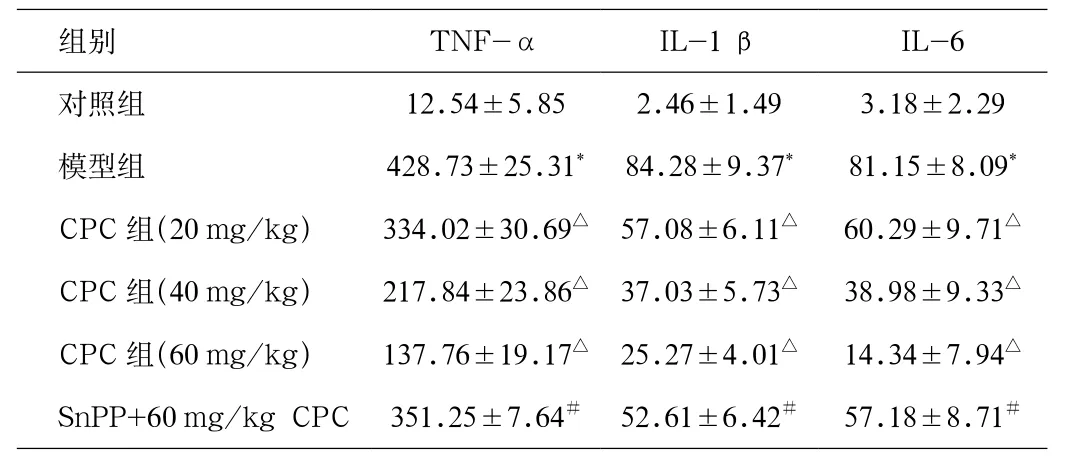
表2 各组BALF中TNF-α、IL-1 β和IL-6含量(pg/mL,n=8)Tab. 2 Content of TNF-α, IL-1 β and IL-6 in each groups (pg/mL, n=8)
2.4 CPC对肺组织中HO-1表达以及Nrf2核转位的影响 与对照组相比,脓毒性ALI大鼠肺组织中HO-1蛋白表达水平有轻微增高,而经CPC处理后,HO-1表达进一步增强(见图2 A)。类似的,对照组细胞核中几乎无Nrf2表达,ALI大鼠肺组织细胞核中Nrf2有所增高,而CPC处理后,Nrf2含量明显增多,而内参TBP含量保持一致(见图2 B)。

图2.CPC对肺组织中HO-1表达(A)以及Nrf2核转位(B)的影响1.对照组;2.模型组;3.20 mg/kg CPC干预组;4.40 mg/kg CPC干预组;5.60 mg/kg CPC干预组Fig.2 Expression of HO-1 (A) and nuclear translocation of Nrf 2 (B) induced by CPC1.Control group;2.Model group;3.20 mg/kg CPC group;4.40 mg/kg CPC group;5.60 mg/kg CPC group
2.5 CPC对转录因子NF-кB活化的影响 Westernblot结果显示,ALI大鼠肺组织内细胞核中NF-кB p 65含量明显高于对照组,而CPC处理后,p 65转位水平有所降低,表明CPC能抑制p 65从细胞浆转移至细胞核中(见图3)。
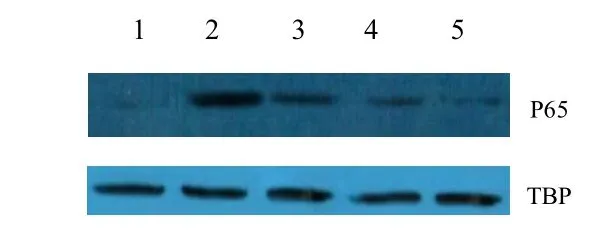
图3.CPC对肺组织中NF-κB p 65亚基核转位的影响1.对照组;2.模型组;3.20 mg/kg CPC干预组;4.40 mg/kg CPC干预组;5.60 mg/kg CPC干预组Fig.3 Nuclear translocation of NF-κB induced by CPC1.Control group;2.Model group;3.20 mg/kg CPC group;4. 0 mg/kg CPC group;5.60 mg/kg CPC group
3 讨论
HO-1是催化血红素降解为CO、亚铁离子和胆红素的限速酶,并在机体的抗炎症、抗氧化损伤中发挥重要作用[4],研究显示,HO-1基因的启动子区域含有转录因子Nrf2的结合位点,因此Nrf2诱导的HO-1表达,是机体一种重要的适应性保护反应。在非激活情况下,Nrf2可与抑制物keap1结合于细胞质内。当细胞受到外源性刺激时,Nrf2从keap1中分离出来,转移至细胞核内,从而与应激诱导性基因如HO-1的启动子区域的抗氧化剂应答元件结合[5]。本研究发现CPC处理后,Nrf2转位增加,这与肺组织中HO-1蛋白表达的趋势一致,表明CPC诱导HO-1的表达可能是由于Nrf2的活化所致。HO-1的代谢产物如CO和胆绿素在多种肺部疾病包括ALI中发挥抗氧化和抗炎症作用,包括抑制促炎症细胞因子、趋化因子、ROS的形成[6-7]。为了进一步评价HO-1在CPC的保护效应中的作用,在干预过程中加入SnPP,对CPC的这些抗炎症活性进行了分析。结果表明,脓毒性ALI的肺部病理特征包括肺泡炎、白细胞浸润、蛋白渗出以及水肿,CPC处理可明显减弱这些病理学改变。然而利用HO-1抑制剂SnPP可削弱CPC的保护效应,表明CPC的保护效应与HO-1有关。
肺组织中的中性粒细胞渗出与脓毒性ALI的预后不良密切相关,抑制中性粒细胞的渗出反应可减缓肺损伤乃至ARDS的发生[8]。本研究发现,CPC可明显减弱ALI大鼠肺组织中性粒细胞积聚以及MPO的活性(中性粒细胞渗出标志物)。BALF中由活化的肺泡炎症细胞(包括中性粒细胞)释放的促炎症细胞因子(包括TNF-α、IL-1 β、IL-6等)水平的增加在引起ALI的过程中发挥重要作用,并与ALI的不良结局密切相关[9]。CPC也可明显抑制ALI大鼠BLAF中促炎症细胞因子水平的增加。SnPP也能减弱CPC对中性粒细胞和促炎症细胞因子的抑制效应,表明CPC的抗炎症活性也与HO-1有关。
ALI发生时,呼吸道和血液中的免疫细胞释放大量ROS从而诱导炎症反应,进而引起肺损伤[10]。本研究也证明:CPC对ROS的抑制作用与HO-1的表达有关,因为SnPP预处理可明显减弱CPC对肺组织中O2-的抑制作用。其他的重要介质,如NO的过量产生也与ALI的发病机制密切相关。NO的过量产生可快速与O2-相互作用,产生过氧亚硝酸盐,导致细胞和组织的大量损伤[11]。因此,抑制NO相关的细胞毒性是治疗ALI的一个潜在靶点。与预期结果一样,服用CPC能明显抑制由LPS诱导的亚硝酸盐/硝酸盐形成,最终抑制NO的产生。其过程也可能与HO-1的表达有关,这也说明由HO-1介导的NO途径和ROS产生的减少可能是CPC对ALI的保护性效应中的一个重要机制。
细胞在静息状态下,NF-кB以p 50和p 60亚单位的同聚或异聚复合物的形式存在于细胞质,并与抑制分子IкB-α结合。细胞受到外源性因素刺激后,导致IкB-α/NF-кB复合物分离。然后,NF-кB转移至细胞核内,并诱导一些炎症基因表达(包括促炎症细胞因子以及ROS、NO的形成)[12]。因此,NF-кB被认为是一种用于肺损伤的早期检测、防治的重要靶分子。本研究也证实CPC明显抑制ALI大鼠中p 65转移至肺细胞核内,说明CPC对炎症的抑制作用可能是通过NF-κB而实现的。已有研究表明,抑制NF-кB的活化可明显抑制巨噬细胞内由LPS诱导的细胞因子分泌、iNOS表达以及NO产生[13-14]。虽然如此,HO-1和NF-κB发挥抗炎症活性的真正机制目前仍不完全清楚。HO-1分解游离血红素,以及产生抗炎症的复合物比如胆绿素/胆红素和CO等可能与HO-1的抗炎症活性有关[15],在下一步研究中,我们将对HO-1的上游调控机制以及HO-1的作用靶点开展进一步研究。
[1] Du B,An Y,Kang Y,et al.Characteristics of critically ill patients in ICUs in Mainland China[J].Crit Care Med,2013,41(1):84-92.
[2] Shih CM,Cheng SN,Wong CS,et al.Antiinflammatory and antihyperalgesic activity of C-phycocyanin[J].Anesth Analg,2009,108(4):1303-1310.
[3] Cherng SC,Cheng SN,Tarn A,et al.Anti-inflammatory activity of c-phycocyanin in lipopolysaccharide-stimulated RAW 264.7 macrophages[J].Life Sci,2007,81(19):1431-1435.
[4] Deshane J,Chen S,Caballero S,et al.Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J].J Exp Med,2007,204(3):605-618.
[5] Zhang Z,Cui W,Li G,et al.Baicalein protects against 6-OHDA-induced neurotoxicity through activation of Keap 1/Nrf 2/HO-1 and involving PKCalpha and PI3 K/AKT signaling pathways[J].J Agric Food Chem,2012,60(33):8171-8182.
[6] Sarady-Andrews JK,Liu F,Gallo D,et al.Biliverdin administration protects against endotoxin-induced acute lung injury in rats[J].Am J Physiol Lung Cell Mol Physiol,2005,289(6):1131-1137.
[7] Yin H,Li X,Yuan B,et al.Heme oxygenase-1 ameliorates LPS-induced acute lung injury correlated with downregulation of interleukin-33[J].Int Immunopharma col,2011,11(12):2112-2117.
[8] Perl M,Hohmann C,Denk S,et al.Role of activated neutrophils in chest traumainduced septic acute lung injury[J].Shock,2012,38(1):98-106.
[9] Lomas-Neira J,Perl M,Venet F,et al.The role and source of tumor necrosis factor-alpha in hemorrhage-induced priming for septic lung injury[J]. Shock,2012,37(6):611-620.
[10] Carnesecchi S,Pache JC,Barazzone-Argiroffo C.NOX enzymes:potential target for the treatment of acute lung injury[J].Cell Mol Life Sci,2012,69(14):2373-2385.
[11] Wang L,Taneja R,Razavi HM,et al.Specific role of neutrophil inducible nitric oxide synthase in murine sepsis-induced lung injury in vivo[J]. Shock,2012,37(5):539-547.
[12] Kwon DJ,Ju SM,Youn GS,et al.Suppression of iNOS and COX-2 expression by flavokawain A via blockade of NF-kappaB and AP-1 activation in RAW 264.7 macrophages[J].Food Chem Toxicol,2013,58(7):479-486.
[13] Jin M,Sun CY,Pei CQ,et al.Effect of safflor yellow injection on inhibiting lipopolysaccharide-induced pulmonary inflammatory injury in mice[J].Chin J Integr Med,2013,19(11):836-843.
[14] Liu F,Sun GQ,Gao HY,et al.Angelicin regulates LPS-induced inflammation via inhibiting MAPK/NF-kappaB pathways[J].J Surg Res,2013,185(1):300-309.
[15] Chung SW,Liu X,Macias AA,et al.Heme oxygenase-1-derived carbon monoxide enhances the host defense response to microbial sepsis in mice[J].J Clin Invest,2008,118(1):239-247.
C-phycocyanin induces Heme oxygenase-1 expression to protect acute lung injury in septic rats
ZHOU Ding-geng1, ZHAN Xiang-yang1, ZHANG Yong-hu1, ZHANG Da-li2
(1.Department of Emergency,The Second Affiliated Hospital of Nanhua University, Hengyang 421001,China;2. Department of Emergency,The First Affiliated Hospital of Nanhua University, Hengyang 421001,China)
ObjectiveTo observe the protective effect and molecular mechanism of C-phycocyanin (CPC) on acute lung injury (ALI) in septic rats。Method75 SD rats were randomly divided into control group, model group and CPC group. Cecal ligation and puncture was used to establish a septic acute lung injury rats (model group). For the CPC groups, septic acute lung injury rats were administrated by 20, 40 and 60 mg/kg CPC by intraperitoneal injection. 72 h after the operation, serum and lung tissue were obtained, the wet to dry weight ratio, the content of TNF-α、IL-6 and IL-10 in bronchoalveolar lavage fl uid, the activity of myeloperoxidase (MPO) was analyzed. Expression of heme oxygenase (HO)-1,activation of nuclear factor erythroid 2-related factor 2 (Nrf 2) and nuclear factor-kappa B (NF-B) were detected by Western blot. Superoxide and Nitrite/Nitrate Level production in Lungs and bronchoalveolar lavage fl uid were measured by chemiluminescence and reduction method, respectively。ResultsTreatment with CPC significantly inhibited septic-induced inflammatory responses including elevation of superoxide formation, myeloperoxidase activity, leucocytes and protein in fi ltration in lung tissues, and production of proin fl ammatory cytokine, and nitrite/nitrate in bronchoalveolar lavage fl uid (P<0.05). In addition, CPC could activate Nrf 2 and induce HO-1 expression, and inhibit NF-B activation in ALI rats. However, blocking HO-1 activity by tin protoporphyrin IX (SnPP), an HO-1 inhibitor, markedly abolished these bene fi cial effects of CPC in septic-induced ALI。ConclusionThe protection mechanism of CPC may be through HO-1 induction and suppressing of NF- B-mediated in fl ammatory responses.
C-phycocyanin;sepsis;acute lung injury;heme oxygenase-1
R 453.9
A
1005-1678(2014)01-0005-04
脓毒症性肺损伤是一种由败血症或严重感染引起的一种危急并发症,虽然目前的治疗方法和手段已经取得了较大的进步,但其死亡率依然可达30%~50%[1]。因此寻求有效的辅助治疗,有望改善其预后。和其他因素引起的急性肺损伤 (acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)一样,病理生理学上是肺泡毛细血管广泛损伤,通透性增加,从而导致肺水肿、缺氧,以及多形核中性粒细胞(polymorphonuclear neutrophils,PMN)渗入肺泡腔内,最终导致呼吸功能受损。目前的观点认为:这种失控性炎症反应是ALI的发病基础,因此,抑制由固有免疫系统介导的炎症反应可能是减弱ALI进展的一个潜在治疗靶点。藻蓝素(C-phycocyanin,CPC)一种从螺旋藻提取、加工而成的天然食用色素,是一种营养价值极高的营养物质[2-3]。研究显示:CPC不但可以帮助调节合成人体所需要的多种重要酶,而且对人体的免疫系统有一定的调控作用,这表明CPC可能对于各种炎症性疾病有一定的作用[2-3]。但目前未见有关蓝藻素在急性肺损伤中的相关研究。本研究旨在探讨CPC在脓毒症诱导的ALI中发挥的保护效应及可能的分子机制。
湖南省自然科学基金衡阳联合基金(13 JJ 9009)
周定耕,男,硕士,主治医师,研究方向:急性肺损伤发病机制与防治,Email:zhoudinggeng@163.com。

