怡肾丸对阿霉素肾病大鼠肾脏TNF-α的影响
冯 立
武汉市中医医院,武汉 430014
肿瘤坏死因子(TNF-α)是一种多效的炎症性细胞因子,在肾脏疾病损伤中起关键作用,炎症损伤是间质纤维化发生发展的重要因素。怡肾丸作为补肾泄浊的代表方剂,被用于临床治疗慢性肾功能衰竭(chronic kidney dysfunction,CKD)3~5期的患者,有很好的疗效。本研究通过对阿霉素肾病大鼠病变肾脏组织中TNF-α含量的测定,观察怡肾丸对TNF-α的影响,探讨其补肾泄浊的机制,以及是否通过影响TNF-α来延缓肾间质纤维化的发展,保护肾脏功能,为怡肾丸的临床疗效提供理论依据。
1 材料与方法
1.1 动物
健康SD雄性大鼠80只,体重(170±10) g,购自于湖南斯莱克景达实验动物有限公司。每笼5只,大鼠饲养环境保持恒温、通风、安静,每日更换垫料,定期消毒笼具;给予12 h灯光照射管制;每只大鼠均给予严格的卡片登记管理。
1.2 药物及试剂
怡肾丸由熟地15 g,生地10 g,白术10 g,五味子10 g,山茱萸15 g,人中黄5 g,砂仁5 g,蝉蜕5 g等组成,由本院药学基地统一制备。参照《中国药典》2010年版附录ⅠC颗粒剂和国家食品药品监督管理总局颁布的“中药配方颗粒质量标准”中的备案标准,对配方颗粒的性状、水分、溶化性、装量差异、微生物限度等指标进行质量控制。六味地黄丸购于湖南九芝堂股份有限公司(批号:CY1174);注射用盐酸多柔比星购于深圳万乐药业有限公司(批号:CY0027)。兔抗大鼠TNF-α试剂购于北京博奥森生物技术有限公司。
1.3 主要仪器
CS-Ⅵ型摊片烤片机、TS-12A生物组织自动脱水机、冷冻台、BM-Ⅷ生物组织包埋机(湖北孝感市宏业医用仪器有限公司);FINESSE325珊顿旋转石蜡切片机(英国产品);电热恒温鼓风干燥箱DHG -9053(上海山连实验设备有限公司);OLYMPUS显微镜BX51(日本产品)。
1.4 实验方法
1.4.1 动物分组及处理 80只大鼠适应性饲养1周,取60只造模,本研究采用一次性尾静脉注射阿霉素6 mg/kg的方法复制阿霉素肾病大鼠模型。将模型复制成功的大鼠,随机分为模型组、怡肾丸组、六味地黄丸组,每组20只。未做特殊处理的20只大鼠作为空白对照组。每隔7 d测1次体重,依据体重调整灌胃的药量。各组处理如下:空白对照组与模型组均予以自由饮水、摄食,等体积蒸馏水灌胃,剂量参照怡肾丸组;怡肾丸组,60 kg体重的成人每日剂量为18 g,怡肾丸药丸研碎后按照药物剂量换算方法换算成大鼠的剂量溶于4 ml蒸馏水,每日上午灌胃1次;六味地黄丸组,60 kg体重的成人每日剂量为9 g,六味地黄丸药丸研碎后按照药物剂量换算方法换算成大鼠的剂量溶于4 ml蒸馏水,每日上午灌胃1次。各组的疗程均为8周。
1.4.2 药物剂量换算方法 公式为D1:D2=R1:R2,D2=D1×R2/R1。D1为成人的服药剂量,是已知剂量;D2为大鼠服药剂量,为所求剂量;R1以60 kg的成人服药剂量为标准,即R1=346.68;R2为大鼠体表面积比值。
1.4.3 标本采集和处理 分别于灌胃后第2、4、6、8周分离双肾,称重后将左肾沿肾门纵向切开,置于4%多聚甲醛固定,24~48 h后石蜡包埋,切片待用,采用免疫组织化学法观察TNF-α的表达变化。
1.5 统计学处理
2 结果
2.1 动物死亡状况
造模8周后,模型组大鼠死亡7只,怡肾丸组死亡2只,六味地黄丸组死亡3只。
2.2 TNF-α在肾间质的表达与定量分析
2.2.1 TNF-α在肾间质的表达 TNF-α在空白组肾间质轻度表达;在模型组的肾间质表达明显;在六味地黄丸组与怡肾丸组的肾间质都有高度表达。见图1。
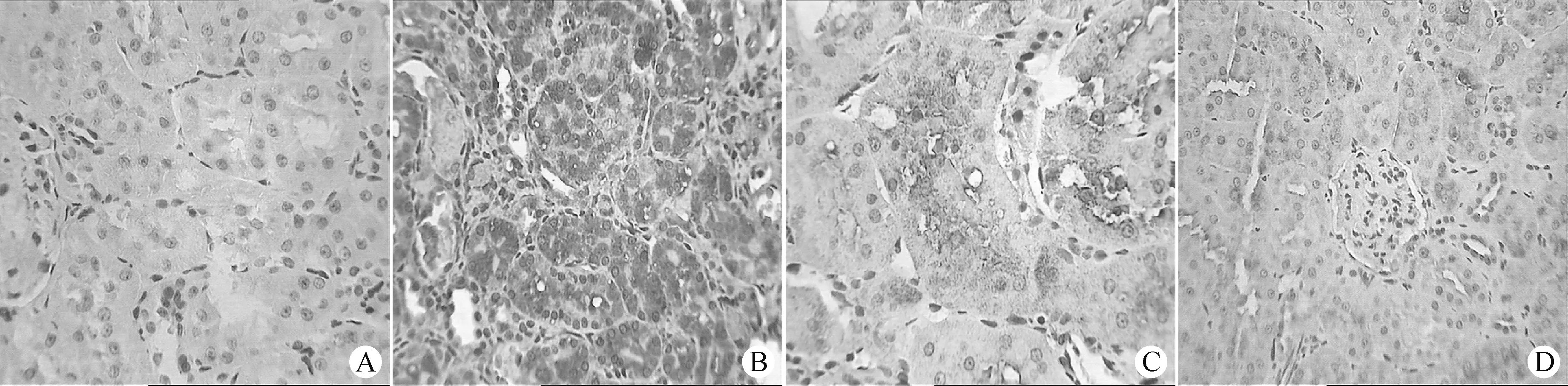
A:空白组;B:模型组;C:六味地黄丸组;D:怡肾丸组图1 各组肾间质TNF-α的表达(免疫组织化学法,×400)
2.2.2 TNF-α的定量分析 组内比较:空白组第2、4、6、8周4个时间点相互比较,差异无统计学意义(P>0.05);模型组、六味地黄丸组、怡肾丸组第2、4、6、8周4个时间点相互比较,差异有统计学意义(P<0.05)。组间比较:造模后第2、4、6或8周,模型组、六味地黄丸组、怡肾丸组分别与空白组比较,差异均有统计学意义(P<0.05);六味地黄丸组及怡肾丸组与模型组比较,差异均有统计学意义(P<0.05);六味地黄丸组与怡肾丸组比较,差异无统计学意义。表明造模后六味地黄丸组与怡肾丸组疗效无明显差异。见表1、图2。
表1 各组TNF-α累积光密度的定量分析(μm2,±s)
与空白组比较*P<0.05;与模型组比较△P<0.05
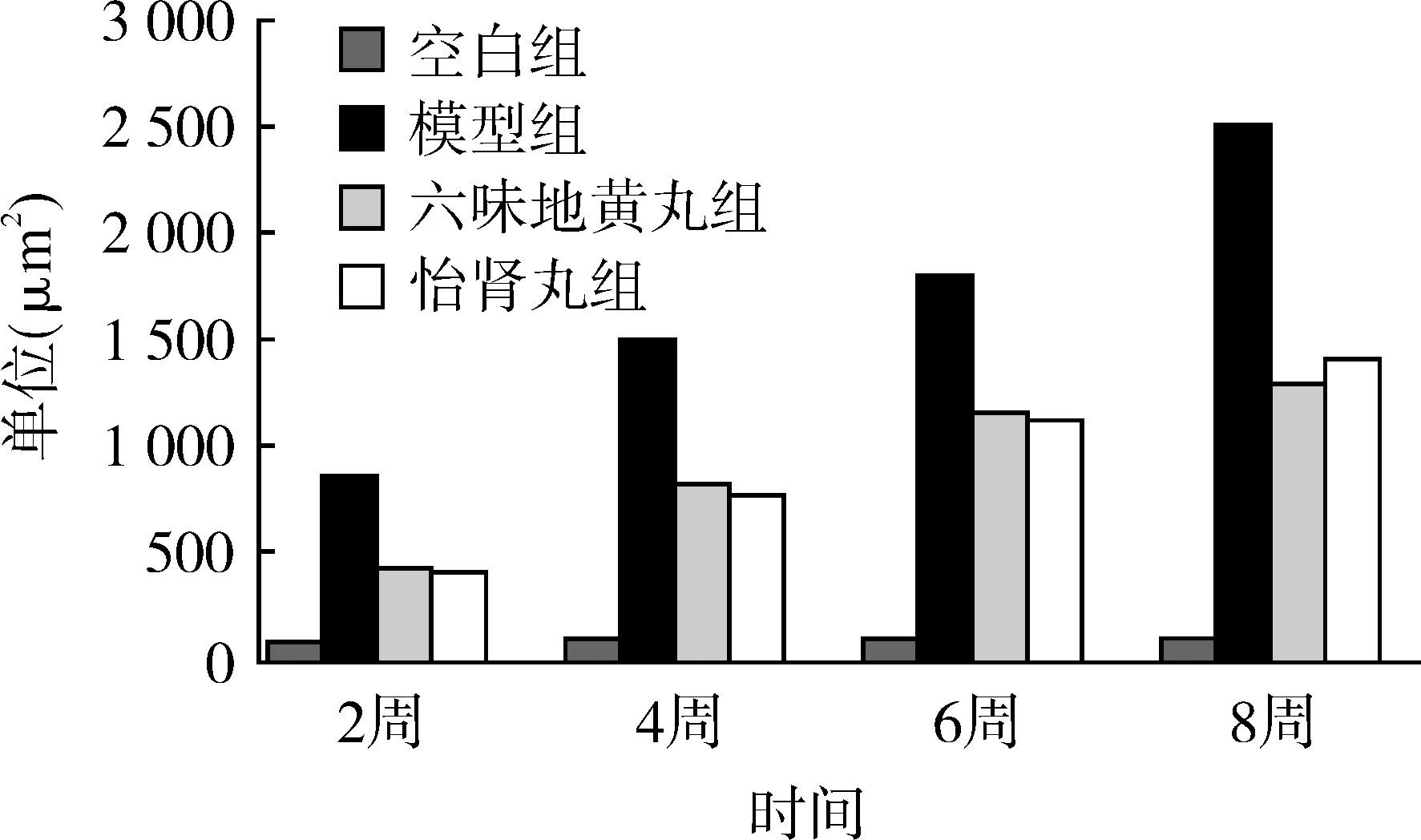
图2 各组TNF-α累积光密度的定量变化图
3 讨论
在慢性肾脏病的进展中,肾脏纤维化起着重要的作用,肾功能的恶化很大程度上取决于肾小管间质纤维化的程度[1-4]。肾小管间质细胞的活化、炎症细胞浸润、血管活性物质等因素导致纤维化细胞因子过度表达,在肾间质纤维化发生和发展过程中起着重要作用。
TNF-α是肾脏疾病发生发展中众多细胞因子中关键的一个。TNF-α的毒性大,低浓度的TNF-α主要在局部发挥作用,高浓度的TNF-α可进入血液中,引起全身性反应。当体内发生炎症时,TNF-α对单核细胞和中性粒细胞等有趋化作用,并可诱导内皮细胞表达高表达内皮细胞白细胞黏附分子-1(ELAM-1)、血管细胞黏附分子-1(VCAM-1)等黏附分子,从而促进循环中的单核、中性粒细胞等附着,并向感染和炎症部位游走。另外,在参与炎症反应的众多细胞因子中,TNF-α是早期细胞因子,可调节IL-1、IL-6和IL-10等其他细胞因子的表达和分泌,且可增强巨噬细胞的细胞毒性作用,诱导IL-1的合成,也可增加血小板激活因子(PAF)的合成,TNF-α还可诱导T细胞释放干扰素γ,可调节β细胞的增生及分化。邱阳等[5]在实验中证明,模型组大鼠注射阿霉素后3 d,血清TNF-α水平开始出现轻度升高,血清TNF-α浓度与NF-kB p65活性变化呈正相关,提示NF-kB被激活后上调TNF-α的转录,使TNF-α生成增多。慢性肾功能衰竭发病机制大多与免疫机制有关,TNF-α是导致肾功能衰竭发生发展的重要炎症介质。许多研究[6-7]均表明,慢性肾功能衰竭患者TNF-α水平较正常对照组升高的原因可能是各种肾脏疾病导致的肾功能衰竭,都存在不同程度的炎症反应。单核细胞处于活化状态,产生的TNF-α增加[8]。刘毅等[9]研究发现,尿毒症非血液透析患者与血液透析患者外周血单核细胞中均有TNF-α的基因表达,由于免疫复合物、内皮素、内毒素等因素的刺激,改变内皮细胞的黏附性及诱导巨噬细胞产生趋化因子,促进炎症细胞聚集于肾小球,进而产生炎症因子,诱导肾小球局部也分泌TNF-α,肾功能下降致肾脏排泄障碍同样致TNF-α升高。本实验表明,TNF-α的活性在阿霉素肾病模型组织中随时间增加明显增高,并伴有明显间质纤维化改变,提示:①TNF-α的活化与肾间质纤维化有正相关;②阿霉素作为一个应激因子,触发了TNF-α信号转导通路,进一步启动下游的各种因子而诱导细胞内蛋白的合成。
中医没有肾间质纤维化的概念,但肾间质纤维化最终可因久病伤正而导致正虚邪实,浊邪内蕴而出现的水肿、少尿、无尿、尿血、尿浊、腰痛、恶心、呕吐等临床表现,与现代医学中肾间质纤维化的病理改变出现最终导致慢性肾功能不全所出现的疾病进程相一致。但肾间质纤维化是以细胞外基质过度积聚和成纤维细胞的增殖为病理特点。中医学认为,“虚、痰(浊)、瘀、毒”四大病机学说实质上是导致肾间质纤维化发生发展的关键。虚者,既有肾脏之亏虚,也有脾胃之不足;浊者,既有内蕴之痰浊,又有瘀血等邪毒。肾主藏精,为先天之本,“精气夺则虚”,故肾虚的本质是指肾中精气之不足。肾脏本为排毒之脏器,肾气亏虚,气血运行不畅,可使体内代谢产物不能充分排出,瘀久则成浊毒。肾虚贯穿于整个慢性肾脏病的病程中,肾虚为本病发生发展的基础,也是治疗的核心所在[10]。
怡肾丸基本方出自金代医家张元素的《病机气宜保命集》所记载的黑地黄丸,取其补肾泄浊、攻补兼施之效,用于临床可明显改善患者临床症状,延缓肾衰竭。其主要药物包括熟地15 g,人中黄5 g,生地10 g,白术10 g,砂仁5 g,山茱萸15 g,五味子10 g,蝉蜕5 g。君药为熟地和人中黄,熟地有补血滋阴,益精填髓之功;人中黄具有清热解毒泻浊之功,二药合用,共奏补肾泄浊之功;臣药为生地和山茱萸,生地补肾之精血,退浮热之虚热;山茱萸有补益肝肾,涩精固脱之效;五味子涩精滋肾;白术、砂仁为轻灵之品,共奏益气健脾补肾之功,使其振奋先后天之气,使补而不滞,且无留邪之弊,共为佐药;蝉蜕具散风除热、利咽透疹、退翳、解痉之功,因其体气轻扬之性,使脾之气易于外清,令肺之气易于外达,脾、肺之气升达于上、外,既有利于余邪的祛除,又有利于脏腑功能的恢复,故为使药。
六味地黄丸是治疗慢性肾脏病临床上研究很多的方剂,有大量的临床研究证明其对肾小球肾炎和肾病有明显的治疗作用,增强机体的抗氧化能力,加速自由基及其代谢产物的消除,减轻体内脂质过氧化反应;促进蛋白质的合成,加强受损组织的修复。本实验显示,怡肾丸组及六味地黄丸组肾小管上皮细胞TNF-α的表达明显低于模型组,证明怡肾丸对慢性肾脏病有明显的治疗作用。
怡肾丸用于临床,针对慢性肾功能不全,肌酐升高,“浊毒内蕴”,能更好地从“泄浊”的角度改善肾功能。怡肾丸可能通过抑制TNF-α的表达,抑制肾小球的扩大,减轻炎症反应和纤维化程度,明显抑制肾小管上皮变性、坏死、脱落,从而达到保护肾单位,保护肾脏、延缓肾间质纤维化的作用。
[1] NEILSON EG.Mechanisms of disease fibroblasts a new look at an old problem[J].Nat Clin Pract Nephrol,2006,2(2):101-108.
[2] LIU Y.Renal fibrosis:new insights into the pathogenesis and theraeutics[J].Kidney Int,2006,69(2):213-217.
[3] EDDY AA.Progression in chronic kidney disease[J].Adv Chronic Kidney Dis,2005,12(4):353-365.Review.
[4] 王海燕.肾脏病学[M].3版.北京:人民卫生出版社,2008:1146-1175.
[5] 邱阳,杨玉秀,任青,等.大黄素对慢性肾功能衰竭患者肿瘤坏死因子产生的抑制作用[J].中华肾脏病学杂志,1998,14(3):188-189.
[6] 程晓霞,王军.黄芪注射液对慢性肾衰患者血细胞因子的影响[J].中国中医药科技,2001,8(3):178.
[7] 陈莉芬,李荣亨,曹文富,等.黄芪对慢性肾炎患者血清TNF-α、IL-6及细胞免疫功能的影响[J].重庆医科大学学报,2002,27(2):174-176.
[8] 钟巧,易著文.川芎嗪对小儿肾病综合征肿瘤坏死因子的影响[J].湖南中医学院学报,1997,17(2):18-19.
[9] 刘毅,马威,吴文莉,等.坚肾合剂对Adenine所致CRF大鼠血NO、NOS、及TNF-α的影响[J].中国实验方剂学,2000,6(1):28-30.
[10]邱阳,杨玉秀,任青,等.慢性肾衰患者外周血单个核细胞产生肿瘤坏死因子的观察[J].中国医科大学学报,1996,25(5):499-501.

