IL-6对大鼠骨髓间充质干细胞 VCAM-1表达的影响*
徐 蕴 窦珊珊 柳新平 崔利德 徐旭东
(济宁医学院基础学院,山东 济宁 272067)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)因具有来源广泛,易于分离培养,且不受伦理制约等优势,使其成为细胞替代治疗的理想种子细胞[1-2]。然而骨髓MSCs移植后能在局部存留并分化的细胞量很少,不能满足需要,从而难以达到理想治疗效果。因此该疗法详细机制的阐明将为组织再生治疗开辟新的前景。 Caplan等[3]认为,骨髓MSCS是存在于机体的一种多能干细胞,损伤组织释放的炎症因子可能与其从骨髓到达损伤组织完成修复作用有关。研究[4]表明炎性因子可促进血管内皮细胞与骨髓MSCs间的黏附,但机制有待进一步证明。本实验着重观察炎性因子IL-6对大鼠骨髓MSCs表达VCAM-1的影响,为全面阐明骨髓MSCs移植治疗机制提供一份资料,同时对提高其临床应用疗效打下理论基础。
1 材料和方法
1.1 实验材料
Wistar大鼠;L-DMEM培养基(Hyclone公司); 胎牛血清(Hyclone公司); 青霉素和链霉素(华北制药厂); 胰酶(Gibco公司); IL-6 (Peprotech公司);免疫组织化学检测试剂盒 (博士得生物工程公司); PE标记抗大鼠VCAM-1单克隆抗体(BioLegend公司); Biozol总RNA提取试剂 (BioFlu公司); RT试剂盒K1622(Fermentas公司),包括反转录酶、RNA抑制酶、Buffer、4种dNTP及Oligo引物等; DNA MarkerⅡ和Taq PCR MasterMix(天为时代有限公司)。
1.2 实验方法
1.2.1细胞培养 取150 g左右的Wistar大鼠,处死,取两侧股骨,收集骨髓,离心,用含10%FBS的L-DMEM完全培养基重悬,以0.5×107/ml的密度接种于培养瓶中;置37℃、5% CO2及饱和湿度的孵箱中培养。3 d后首次更换培养基,去除未黏附细胞,以后每3~4 d换液1次。待细胞长至90%融合,用0.25%的胰蛋白酶消化,按1:3传代。取第3代rMSCs用作试验。
1.2.2实验分组 取生长2 d的第3代rMSCs,弃旧培养基,用0.1 mol PBS(pH7.2~7.4)洗2遍,加入不含血清的L-DMEM培基; 然后分成2组,每组6个样本,一组加入IL-6使终浓度为10 ng/ml,另一组不加IL-6,继续培养12 h,分别收集各组细胞进行下面的实验。
1.2.3免疫细胞化学显色 收集各组细胞爬片,4%多聚甲醛固定,按二步免疫组织化学法进行rMSCs表面细胞黏附分子VCAM-1染色;用PBS代替一抗作阴性对照。细胞被染成褐色或棕褐色为阳性。
1.2.4流式细胞仪检测VCAM-1的表达率 收集处理后的各组细胞,调整细胞密度为106/ml,体系为100 μl;分别加入1.25 μl PE标记的VCAM-1(CD106) 单克隆抗体,室温下避光孵育20 min,0.1 mol PBS洗2遍,1%多聚甲醛固定,待机检测。以流式细胞仪配套软件Cell Quest(Version 1.0)分析样本中1×104个细胞相应标记阳性表达率,用PE标记同型IgG作相应的免疫阴性对照。
1.2.5RT-PCR检测VCAM-1 mRNA的表达 用Bizol提取处理后的各组细胞总RNA。采用二步法进行RT-PCR:第一步按Fermentas公司Firststrand cDNA Synthesis Kit说明书逆转录制备各组cDNA;第二步分别用获得的各组cDNA作模板进行扩增反应。各基因引物由上海生工生物工程技术服务有限公司设计合成,合成序列为:1)β-actin 上游引物: 5′-TGTCTAGGGGCTCTTCCA′-3; 下游引物: 5′-TGCTCGCTGTTTCACCTATG′-3,扩增产物长度为305bp。2)VCAM-1 上游引物: 5′-TGCACGGTCCCTAATGTGTA′-3,下游引物: 5′-CCCGT TCTTTAGGTGTCTGC′-3,扩增产物长度为350bp。扩增条件为:94℃ 5 min预变性,94℃ 30 s,61℃ 30 s,72℃ 1min,共进行30个循环,最后72℃延伸5 min。内参β-actin的扩增条件为:94℃ 3 min预变性,94℃ 30 s,55℃ 30 s,72℃ 1 min,共进行30个循环,最后72℃延伸7 min。
扩增产物电泳凝胶置于UVP凝胶成像系统中扫描并进行图像分析,以VCAM-1光密度值与β-Actin光密度值作比,该比值即表示VCAM-1 mRNA的相对表达水平。
1.3 统计学方法
采用SPSS13.0统计软件进行实验数据处理。
2 结果
2.1 免疫细胞化学显色
免疫细胞化学染色显示,未刺激组rMSCs着色浅,说明VCAM-1呈弱阳性表达(图1),刺激组rMSCs着色深,说明VCAM-1呈强阳性表达(图2)。
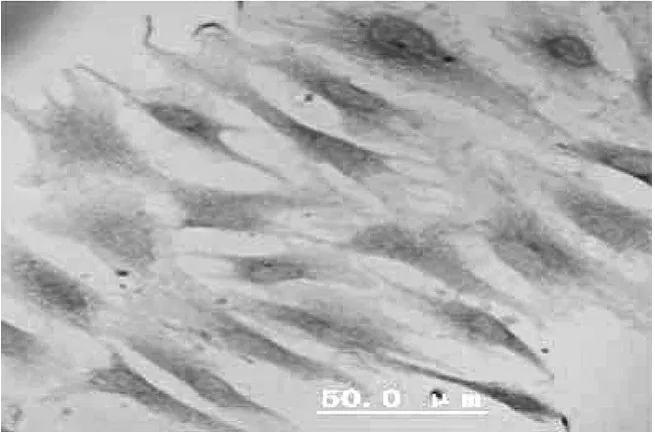
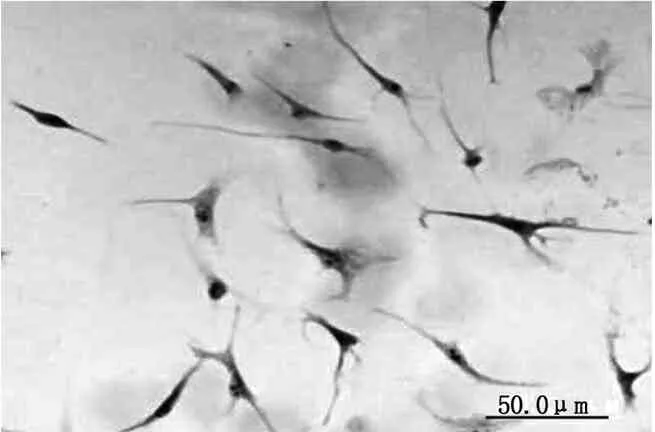
图1 未刺激组:rMSCs(400×)
图2 刺激组:第3代rMSCs,VCAM-1呈强阳性表达 (400×)
2.2 流式细胞术检测两组VCAM-1表达率
流式细胞术检测显示,对照组VCAM-1的平均表达率仅为14.1%(图3),刺激组VCAM-1的平均表达率高达80.9%(图4),明显高于对照组(P<0.001);说明IL-6可诱导rMSCs高表达VCAM-1。
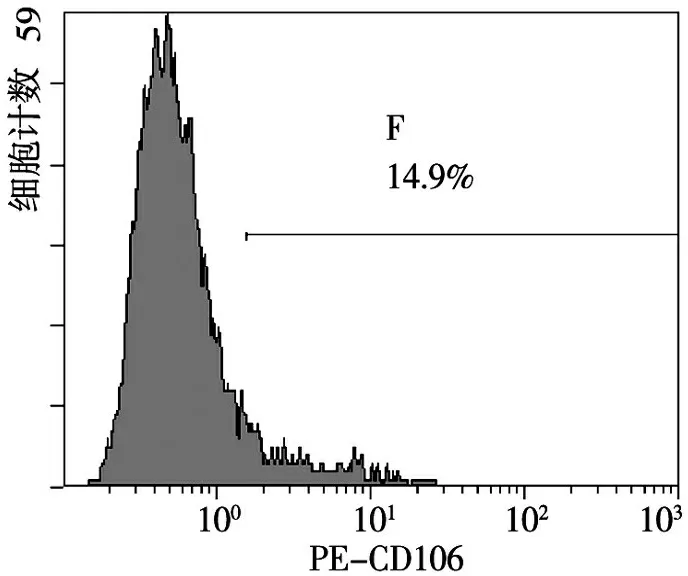
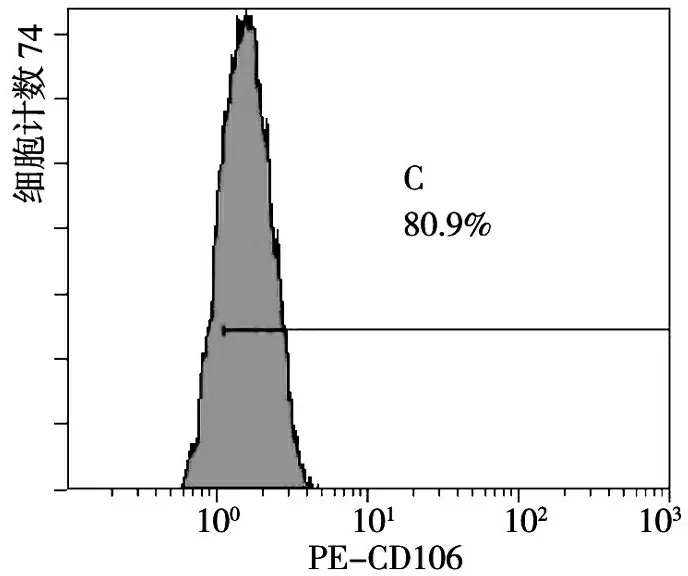
图3 对照组VCAM-1的表达率
图4 IL-6刺激12 h后VCAM-1的表达率(B1)
2.3 两组VCAM-1 mRNA的表达
RT-PCR检测显示,刺激组:rMSCs VCAM-1的电泳条带明显较对照组亮(P<0.001)(图5);表明IL-6可诱导MSCs高表达VCAM-1。VCAM-1 mRNA的扩增产物为350bp,内参的大小为305bp。
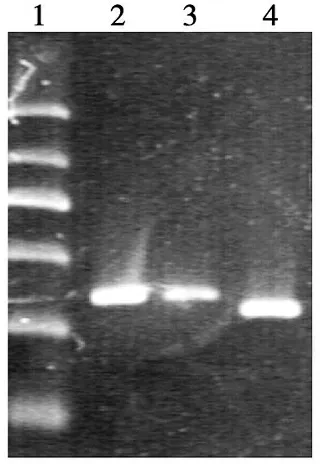
1.Marker;2.刺激组VCAM-1 mRNA;3.对照组VCAM-1 mRNA;4.内参
图5 VCAM-1 mRNA的表达
3 讨论
随着对骨髓MSCs生物学特性等研究的深入,以及细胞分子生物学技术、组织工程技术和基因工程技术的不断发展,骨髓MSCs替代治疗已成为近年来医学领域乃至整个生命科学领域中的研究热点,为人类征服多种疾病带来了新的希望。目前,关于骨髓MSCs移植治疗各种疾病的研究常见报道,然而其长期治疗效果却不尽人意。因此,如何使骨髓MSCs在体内实现治疗的靶向性和高效性成为目前该领域关注的焦点。
研究发现干细胞有向缺血或损伤组织“归巢”的特征。缺血性疾病如心肌梗死或缺血性再灌注情况下,损伤组织会释放一系列的炎症因子如IL-6以及趋化因子MCP-l等,刺激局部组织细胞和血管内皮细胞表达ICAM-1等黏附分子,继而启动白细胞的黏附、趋化过程[5]。骨髓MSCs的移植也可能同样涉及MSCs的黏附、趋化作用,但目前这方面的研究尚待深入。
VCAM-1 属于免疫球蛋白超家族成员,是组织中分布最广的黏附分子之一。目前有关人骨髓间充质干细胞(hMSCs)黏附分子表达的研究相对多一些,认为VCAM-1是介导hMSCs向缺血或损伤组织迁移的重要黏附分子之一[6];而有关鼠类骨髓MSCs黏附分子表达的研究资料甚少,且结论有所差异[7]。Ruster B等[8]研究结果显示VCAM-1可能在 MSCs黏附、迁移等过程起着非常重要的作用;Ren G等[9]认为VCAM-I和ICAM-1在免疫反应中也起到关键作用;Lu HH等[10]研究表明炎症因子能使内皮细胞表面黏附分子如VCAM-1 表达增高。为此,我们采用免疫细胞化学技术、流式细胞技术和RT-PCR技术从蛋白和基因水平研究了VCAM-1在rMSCs上的表达及IL-6对其表达的影响。结果表明:在生理状态下,VCAM-1在 rMSCs上表达微弱;在体外,IL-6能诱导 rMSCs高表达 VCAM-1。这为证实VCAM-1参与在 MSCs的黏附、迁移等过程提供更充分的证据,并为进一步研究MSC移植治疗奠定了理论基础。至于是否可通过提高MSC,黏附分子表达来实现骨髓MSC治疗的靶向性和高效性,还需作进一步的试验研究。
[1] Alexandra P,Jason A,Mellad,et al. Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes,rates of proliferation and differentiation potential[J].Blood,2004,5(103):1662-1668.
[2] McCarty RC,Xian CJ,Gronthos S,et al. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury[J]. Open Orthop J,2010,23(4) : 204-210.
[3] Caplan Al. Mesennhymal stem cells[J]. J Orthop Res,1991,9(5):641-650.
[4] Teo GS,Ankrum JA,Martinellli R,et al. Mesenchymal stem cells transmigrate between and directly through tumor necrosis factor-α-activated endothelial cells via both leukocyte-like and novel mechanisms[J]. Stem Cells,2012,30(11): 2472-2486.
[5] Gao J,Dennis JE,Muzic RF,et al. The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion[J]. Cells Tissues Organs,2001,169(1):12-20.
[6] Daniel ADU,Zeni A,Patricia AZ,et al. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow[J]. Immunol Lett,2003,89(2-3): 267-270.
[7] Eslaminejad MB,Nadri S. Murine mesenchymal stem cell isolated and expanded in low and high density culture system: surface antigen expression and osteogenic culture mineralization[J]. In Vitro Cell Dev Biol Anim,2009,45(8):451-459.
[8] Ruster B,Gottig S,Udwig RJ,et al. Mesenchymal stem cells (MSCs) display coordinated rolling and adhesion behavior on endothelial cells[J]. Blood,2006,108 (12): 938-944.
[9] Ren G,Zhao X,Zhang L,et al. Inflammatory cytokine-induced intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in mesenchymal stem cells are critical for immunosuppression[J]. J Immunol,2010,184(5):2321-2328.
[10] Lu HH,Sheng ZQ,Wang Y,et al. Levels of soluble adhesion moleculesin patients with various clinical presentations of coronary atherosclerosis[J]. Chin Med J ( Engl),2010,123( 21) : 3123-3126.

