3,5-二氨基苯甲酸缩邻香草醛席夫碱镉配合物的合成及抗肿瘤活性研究
张 震
(济宁医学院药学院,山东 日照 276826)
席夫碱及其配合物的特殊生理活性,使其在抑菌、抗肿瘤等方面表现独特的药理活性[1-2]。席夫碱配合物的药用性引起人们的广泛关注,对其药理作用的研究也进一步加深。近年来,研究表明许多席夫碱铜配合物具有良好的蛋白酶体抑制作用,从而选择性诱导肿瘤细胞凋亡[3-4]。本实验以3,5-二氨基苯甲酸和邻香草醛为原料合成了席夫碱配体,进而合成了其镉配合物,对其进行了结构表征。在细胞水平上,通过细胞增殖分析,蛋白酶体活性抑制作用分析,免疫蛋白印迹分析和细胞形态分析,研究了配合物的抗肿瘤活性和对正常细胞的毒性。以期在此研究基础上,为设计、合成低毒、高效且选择性高的新型抗肿瘤药物提供重要的理论依据。
1 实验部分
1.1 试剂和仪器
3,5-二氨基苯甲酸、邻香草醛和醋酸镉(阿拉丁试剂有限公司);DMSO和溴化3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑)(MTT)(Sigma-Aldrich公司);DMEM/F12 (1∶1)、青霉素、链霉素(Invitrogen 公司);胎牛血清 (FBS)(Aleken Biologicals公司);荧光底物 Suc-LLVY-AMC (Calbiochem 公司);单克隆抗体(PARP) 、ubiquitin (P4D1) 、IκB-α (H-4)、 β-actin (C-11) 和第二抗体(Santa Cruz 公司)。Perkin-Elmer 240C型 元素分析仪;Nicolet 170SX 型红外光谱仪(KBr 压片);AVANCE III (600 MHz)超导核磁共振波谱仪;DDS-312 型电导率仪。
1.2 席夫碱配体(L)的合成
将2.0 mmol的3,5-二氨基苯甲酸,用10ml乙醇溶解后,不断搅拌下,滴入到4 mmol的邻香草醛无水乙醇溶液中,逐渐有橘黄色沉淀产生,50 ℃反应2 h,室温下冷却,过滤,用无水乙醇多次洗涤沉淀,得到橘黄色席夫碱配体L,呈粉末状。收率80%。元素分析(C7H4N2O2) (C8H6O2)2计算值(%):C,66.02;H,4.34;N,6.69。实测值:C,65.95;H,4.41;N,6.63。
1.3 配合物CdL的合成
用20ml甲醇加热溶解希夫碱配体,逐滴加入含等摩尔的醋酸镉的甲醇溶液,60 ~70 ℃回流7 h。过滤,沉淀用冷的甲醇洗涤多次得到镉配合物CdL,收率73%。元素分析[Cd(C7H4N2O2) (C8H6O2)2]·2H2O计算值(%):C,48.91;H,3.57;N,4.96;Cd,19.90。实测值:C,48.35;H,3.83;N,5.27,Cd,19.81。
1.4 配合物的抗肿瘤活性试验
本研究所用细胞为人乳腺癌MDA-MB-231细胞和人乳腺MCF-10A 细胞(永生,非致瘤性)。
用MTT法测定配合物对肿瘤细胞增殖的抑制作用;用Wallac Victor 3多标记读数器测定水解AMC基团的量;用Bradford 蛋白分析仪测定细胞裂解液的蛋白浓度;用特定的抗体 IκB-α,PARP 和 β-actin进行Western blot 分析;使用Zeiss Axiovert 25显微镜观察细胞形态的变化。
2 结果与讨论
2.1 红外光谱分析
配合物的红外光谱数据列于表1中。
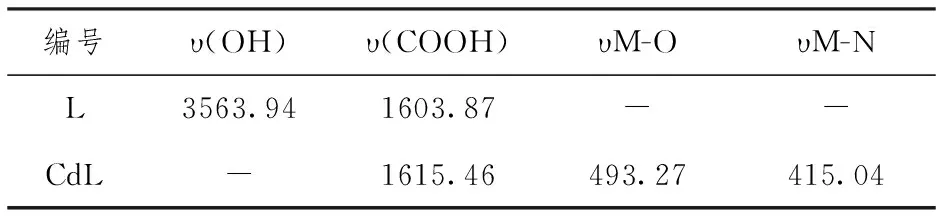
表1 配合物的主要红外光谱数据 (cm-1)
从表1中红外光谱数据可知,配体在3563.94cm-1处存在羟基吸收峰,而在配合物中,这一吸收峰消失,说明配体羟基中的氧原子参与配位,与金属离子形成配位键。在1615.46 cm-1的处存在COOH吸收峰,并且没有发生明显偏移,说明配体COOH上的O原子并没有参与配位。在493.27 cm-1和 415.04cm-1处,分别出现两处新峰,可归为Cd-O和Cd-N的伸缩振动峰。
2.2 配合物的1H NMR数据
CdL:[Cd(C7H4N2O2) (C8H6O2)2]·2H2O,1H NMR (DMSO,600MHz):δ (ppm) 12.772 (1H,s,COOH);9.347 (2H,s,CH=N);6.392-7.855 (6H,m,Ar-H);3.911 (6H,s,OCH3)。
根据CdL的1H NMR 数据可知,在12.772 ppm 处的单峰为COOH 基团上的H,在9.347 ppm处的单峰为甲亚胺 (-CH=N-)上的H,在6.392~7.855 ppm范围归为芳香环上H。在3.911 ppm 处强的单峰归为-OCH3上的质子。酚羟基上的H原子峰消失,说明被金属离子取代。
2.3 配合物的热重分析
在25~800℃温度范围内,配合物主要分两步进行热分解,第一步热分解的温度区间为25~125 ℃,失重率为3.28%,与失去相应分子结晶水比较相符(计算值为 3.19%)。配合物的残重率为23.11%与相应金属氧化物CdO的理论的残重率接近(计算值为22.73%)。
2.4 配合物的摩尔电导率
配合物的摩尔电导率如表2所示。
配合物易溶于DMF和DMSO,配合物溶于DMSO的摩尔电导率为11.61S·cm2·mol-1,小于35 S·cm2·mol-1,可认为配合物为非电解质。
2.5 配合物CdL的可能的结构
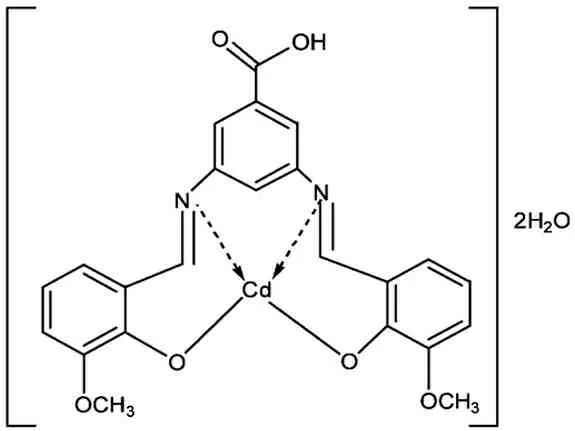
图1 配合物的可能结构
2.6 抗肿瘤活性研究
2.6.1不同浓度的CdL对人类乳腺癌MDA-MB-231细胞增殖的影响 浓度为5、10、20、40、80μM的CdL以及相应体积溶剂DMSO处理人乳腺癌细胞MDA-MB-231 24 h,结果如图2所示。
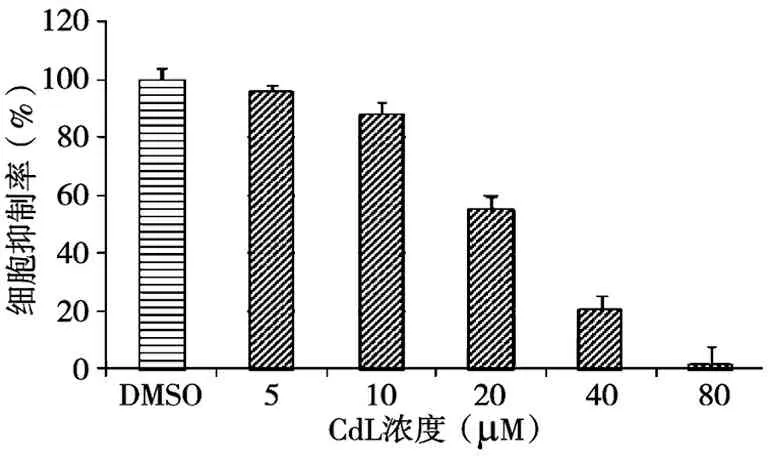
图2 不同浓度的CdL对人乳腺癌MDA-MB-231细胞的增殖抑制作用
由图2可知,与阴性对照DMSO处理相比,当浓度为20 μM 时,CdL对MDA-MB-231细胞增殖有明显的抑制作用,抑制率为43%。浓度达到40 μM 和80 μM,抑制率分别约为80%和98%,说明CdL抑制人乳腺癌细胞增殖活性随浓度增加而梯度增强,呈浓度依赖关系。
2.6.2不同浓度的CdL对纯化的20S蛋白酶体的CT活性的抑制作用 为了考察CdL抑制蛋白酶体活性是否与抑制细胞增殖活性相似,同样条件下,浓度1、5、10、20、40 μM的配合物CdL和相应体积溶剂(DMSO)作为阴性对照,处理纯化的人20 S蛋白酶体,37 ℃孵育2 h,测定其类糜蛋白活性的抑制作用。结果如图3所示。
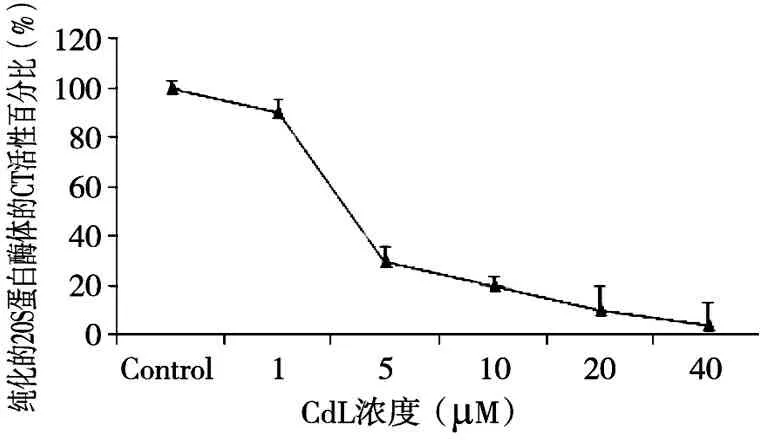
图3 不同浓度CdL对纯化的20S 蛋白酶体中类糜蛋白活性的抑制作用
由图3可知,配合物CdL具有较强的抑制纯化的20S蛋白酶体CT活性作用,依赖浓度的方式增加,抑制活性不断增强,其IC50值为3.3 μM。
2.6.3CdL对人乳腺癌MDA-MB-231细胞蛋白酶体抑制作用及细胞凋亡诱导作用 实验已经证明,CdL能够抑制肿瘤细胞增殖,抑制蛋白酶体的活性。为考察肿瘤细胞凋亡是否由蛋白酶体CT活性受抑制引起的,浓度20 μM 的CdL处理乳腺癌MDA-MB-231细胞2、4、8、12 h,收集细胞,测定其蛋白酶体的活性,免疫蛋白印迹分析以及细胞形态分析。结果如图4 所示。

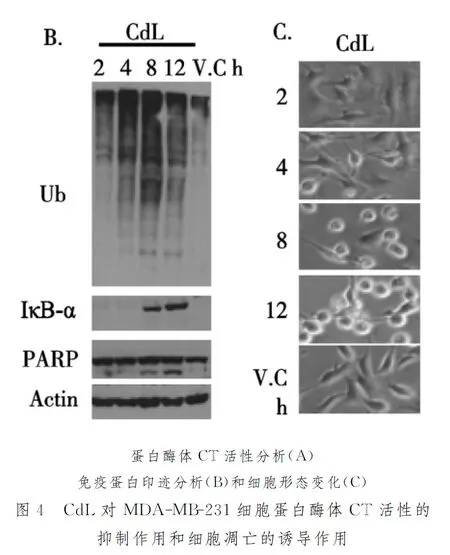
由图4可知,CdL处理MDA-MB-231细胞4 h后,已经出现较为明显的蛋白酶体CT活性抑制,其抑制率达28%(图A),相应的泛素蛋白表达也开始累积,蛋白酶体的靶向蛋白IκB-α积累出现在处理细胞8 h(图B)。随着处理时间的增长,抑制蛋白酶体CT 活性的作用增强,泛素蛋白的表达以及蛋白酶体靶向蛋白也不断累积。同一实验中,由图4C可知,肿瘤细胞形态学变化(细胞变圆、脱壁现象)出现在CdL处理细胞8 h,12 h后出现大量肿瘤细胞凋亡现象。细胞凋亡相关蛋白PARP的p85 KD蛋白片断出现在8 h(图4B)。由此可以得出,蛋白酶体活性的抑制先于肿瘤细胞凋亡,CdL以时间依赖方式抑制人乳腺癌细胞MDA-MB-231蛋白酶体的活性进而诱导其凋亡。
2.6.4CdL对人类乳腺正常细胞MCF-10A的细胞毒性 新型抗癌药物的开发应具备对正常细胞的毒性较小甚至无毒性。为了考察CdL对正常细胞的毒性,浓度为20 μM的CdL(DSF,CdCl2,DSF-Cd和 DMSO作对照,有研究表明DSF-Cd有较强的抑制蛋白酶体活性和诱导肿瘤细胞凋亡能力[5])分别处理乳腺癌MDA-MB-231细胞和正常乳腺MCF-10A 细胞24 h。之后进行了细胞增殖抑制分析(图5A)和细胞形态分析(图5B)。
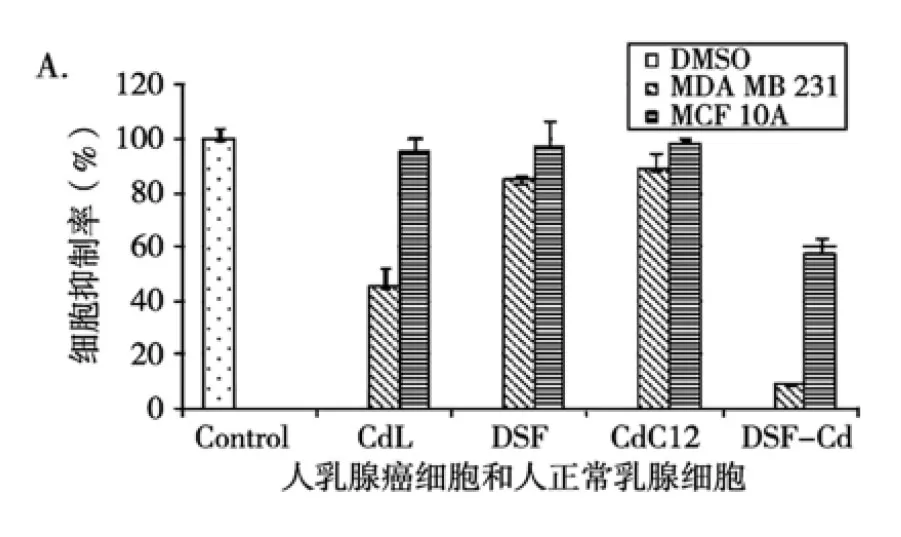
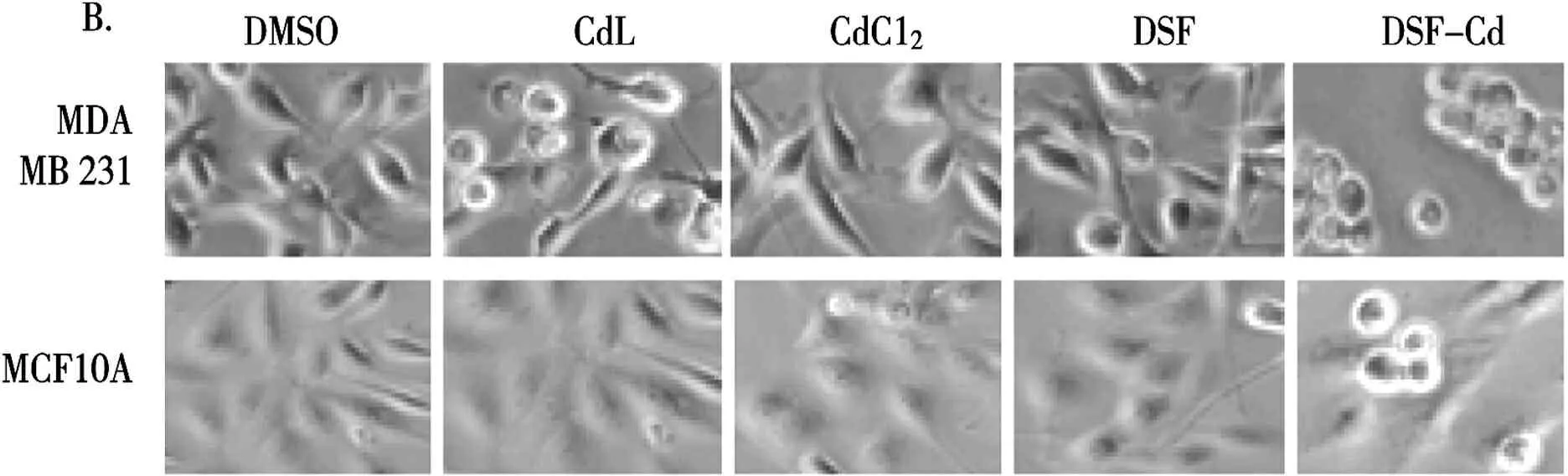
细胞增殖分析(A);细胞形态变化(B)
图5 CdL对人乳腺癌细胞和人正常乳腺细胞的不同作用
由图5可知,CdL对MCF-10A细胞的增殖仅有微弱的抑制作用,抑制率不到5%,而对乳腺癌细胞MDA-MB-231细胞增殖抑制显著的不同,同等条件下,其抑制率为54%(图5),因此,乳腺癌MDA-MB-231细胞比正常MCF-10A 细胞对CdL有更高的敏感性。DSF 和 CdCl2对这两种细胞系抑制作用均较小。然而,DSF-Cd 混合物对MDA-MB-231的抑制率约为90%,但其对MCF-10A也有较强毒性(其抑制率为42%)。结果表明,CdL比已报道的DSF-Cd混合物更具有临床前研究价值。
3 结论
本研究合成了席夫碱配体L和配合物CdL,通过结构表征,得到了配合物的准确结构。将所得配合物作用于人乳腺癌MDA-MB-231细胞,结果显示CdL具有较强的抑制MDA-MB-231细胞增殖能力,配合物通过抑制肿瘤细胞内蛋白酶体CT活性进而诱导肿瘤细胞凋亡,且对正常细胞的毒性较小。本研究表明,在新型的抗癌治疗中,3,5-二氨基苯甲酸缩邻香草醛席夫碱镉配合物可以作为潜在的蛋白酶体抑制剂和肿瘤细胞凋亡的诱导剂,然而,还需要进一步的生物学分析和临床前试验。
参考文献:
[1] 刘玉婷,张洁心,尹大伟.氨基酸schiff碱及其金属配合物的性能研究进展[J].氨基酸和生物资源,2008,30(3):51-54.
[2] 杨立荣.牛磺酸希夫碱金属配合物的合成、表征及生物活性研究[D].青岛:中国海洋大学化学化工学院,2006.
[3] Zhang X,Bi C,Fan Y,et al. Induction of tumor cell apoptosis by taurine Schiff base copper complex is associated with the inhibition of proteasomal activity[J]. Int J Mol Med,2008,22(5): 677-682.
[4] Xiao Y,Bi C,Fan Y,et al. L-glutamine Schiff base copper complex as a proteasome inhibitor and an apoptosis inducer in human cancer cells[J]. Int J Oncol,2008,33(5): 1073-1079.
[5] Li L,Yang H,Chen D,et al. Disulfiram promotes the conversion of carcinogenic cadmium to a proteasome inhibitor with pro-apoptotic activity in human cancer cells[J]. Toxicol Appl Pharm,2008,229 (2): 206-214.

