体外诱导大鼠骨髓间充质干细胞向神经细胞分化的实验研究
李双月,王哲敏,陈若霖,戚 媛,刘 爽,朴丰源
(大连医科大学劳动卫生与环境卫生学教研室,辽宁大连 116044)
体外诱导大鼠骨髓间充质干细胞向神经细胞分化的实验研究
李双月,王哲敏,陈若霖,戚 媛,刘 爽,朴丰源
(大连医科大学劳动卫生与环境卫生学教研室,辽宁大连 116044)
目的 对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)进行分离、培养与鉴定,并探讨全反式维甲酸(retinoic acid,RA)、碱性成纤维细胞生长因子(fibroblast growth factor,basic,bFGF)和表皮生长因子(epidermal growth factor,EGF)联合诱导BMSCs分化为神经细胞的可行性。方法 全骨髓贴壁法分离培养BMSCs,观察细胞形态及生长增殖情况;流式鉴定细胞表面标志物CD29、CD34、CD90;选用第3代细胞,经RA、bFGF和EGF联合诱导后,细胞免疫化学染色检测神经细胞标志物神经元特异性烯醇化酶(neuron specific enolasen,NSE)的表达。结果 体外培养的BMSCs呈成纤维细胞样,第3、4、5代BMSCs的生长曲线均呈S形,活性无明显差异。BMSCs的均一性较好,第3代细胞CD29、CD90阳性率均在90%以上,而CD34阳性率仅为0.58%;BMSCs经诱导后分化为神经细胞,并表达神经细胞标志NSE。结论 成功建立BMSCs的体外培养体系,所得细胞纯度高、生物学特征稳定,并可诱导分化为神经细胞,为移植治疗神经系统损伤提供实验基础。
骨髓间充质干细胞;神经细胞;分化;诱导;培养
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓中的非造血类干细胞,有较强的可塑性,不仅能被诱导分化为骨、软骨、脂肪等中胚层细胞,还能分化为神经细胞等外胚层细胞和肝细胞等内胚层细胞[1-3]。BMSCs取材方便,能在体外大量扩增,分化的目的细胞具有可移植性,对于治疗脑卒中、早老性痴呆和帕金森病等多种神经系统疾病都具有重要意义[4-5]。本研究采用全反式维甲酸(retinoic acid,RA)、碱性成纤维细胞生长因子(fibroblast growth factor,basic,bFGF)和表皮生长因子(epidermal growth factor,EGF)的联合诱导方式,诱导体外分离培养的BMSCs向神经细胞定向分化,旨在探讨BMSCs向神经样细胞分化的可行性,为BMSCs移植治疗神经系统损伤提供实验基础。
1 材料和方法
1.1 材 料
Wistar大鼠,4~5周龄,由大连医科大学动物实验中心提供[许可证号SCKK(辽)2002-0002]。
DMEM培养基、胎牛血清(Gibco公司),RA、大鼠神经元特异性烯醇化酶(neuron specific enolasen,NSE)、胰蛋白酶、青霉素、链霉素(Sigma公司),二苯基四氮唑溴盐(MTT)(上海生工生物工程有限公司),bFGF、EGF(Peprotech公司),FITC -CD29 抗体、PE-CD34抗体、PE-CD90抗体(e-BIOSCIENCE公司)。
1.2 方 法
1.2.1 BMSCs的分离、纯化和培养:大鼠脱臼处死,75%乙醇浸泡消毒10 min,无菌条件下完整剥离股骨及胫骨,暴露骨髓腔并反复冲洗,尤其是干骺端。将冲出的骨髓细胞过筛网制成单细胞悬液,离心后用含10%FBS的DMEM培养液重悬,2×109/cm2细胞接种于培养皿,于37℃、CO2饱和湿度培养箱中培养。接种24 h后全量换液,以后3 d换液1次,待细胞达到80% ~90%融合,0.25%胰酶消化并传代,利用差速贴壁法逐步纯化BMSCs。
1.2.2 BMSCs增殖能力的检测:将生长状态良好的BMSCs按1×104/mL的密度接种于96孔培养板,每孔200 μL细胞悬液进行细胞培养,每组各6复孔,每3 d换液1次,应用MTT法检测其生长增殖能力。从培养第1天到第7天,每天弃去原培养液,每孔加入20 μL MTT(5 g/L)溶液,37℃孵育4 h,小心弃去上清液,各孔加入150 μL DMSO,微量振荡器震荡10 min,使结晶物充分溶解后,酶标仪检测490 nm波长处各孔吸光度(A)值,以时间为横轴,光吸收值为纵轴绘制细胞生长曲线。
1.2.3 BMSCs表面标记物表达的鉴定:采用流式细胞仪检测CD29、CD34、CD90的表达,取第3代生长状态良好的细胞,1000 r/min室温离心5 min,PBS洗涤细胞3次,并轻轻吹打制成单细胞悬液,各待检测的样本依次加入单克隆抗体CD29、CD90、CD34,同时每管样品设立同型阴性对照,4℃避光孵育20 min,PBS洗涤细胞3次,以去除未结合抗体,用500 μL PBS重悬细胞后上机检测分析。
1.2.4 BMSCs诱导分化:取第 3 代 BMSCs,接种于6孔板,生长密度达到 60%时,换成诱导培养基(DMEM+10%FBS+1 μmol/L ATRA+20 ng/mL bFGF+20 ng/mL EGF)。37℃、CO2饱和湿度静置培养。
1.2.5 细胞免疫化学染色:培养细胞在诱导分化48 h、72 h分别进行细胞免疫化学染色,诱导细胞PBS洗3次,冷丙酮固定15 min,PBS洗3次,0.5%Triton X-100孵育20 min,PBS洗3次,山羊血清封闭20 min,弃去血清,加入 NSE 抗体(1∶500),37 ℃孵育3 h,PBS洗3次,滴加二抗,37℃孵育15 min后DAB显色,显微镜下观察。镜下随机选取4个视野,计数阳性细胞。
2 结果
2.1 BMSCs分离培养
细胞接种时呈悬浮状态,24 h后少量细胞贴壁,细胞呈圆形;72 h后大部分细胞贴壁,形态变短梭形、多角形;4、5 d左右形成细胞集落,细胞伸出长短不一、粗细不均的突起(图1a);10 d左右细胞集落融合成片,铺满瓶底80%,可进行首次传代(图1b),传3代后,细胞形态均一,为成纤维细胞样的长梭形、多角形,排列有序(图1c)。

图1 BMSCs的形态学观察(×100)Fig 1 Morphology of bone marrow mesenchymal stem cells(BMSCs)at different phases(×100)
2.2 BMSCs的鉴定
流式细胞仪检测结果显示,BMSCs均一性较好,3代细胞即可达到90.10%的细胞CD29表达阳性,96.61%的细胞CD90表达阳性,而仅0.58%的细胞CD34表达阳性,证明培养所得细胞为BMSCs。见图2。

图2 BMSCs表面标志物表达Fig 2 Surface markers expression of BMSCs
2.3 生 长
细胞接种1 d后开始少量增殖,潜伏期为24 h,3~5 d细胞生长达指数生长期,接种后6 d增殖逐渐减缓,7 d达到高峰,然后生长逐渐缓慢,进入平台期。第3、4、5 代(P3、P4、P5)细胞的生长曲线接近,没有明显差异(图3)。
2.4 神经细胞分化检测
细胞诱导2 h即可见体积变小,形成双极或多极的细胞体,细胞质以细胞核为中心收缩,周围的胞质收缩形成细胞的突起,诱导48 h时,染色可见(33.95±3.12)%细胞 NSE阳性表达,诱导 72 h时,NSE阳性表达细胞增至(51.86 ±2.89)%,NSE阳性细胞间存在突触联系。未诱导对照组细胞保持长梭形和多角形,未见NSE阳性细胞出现。
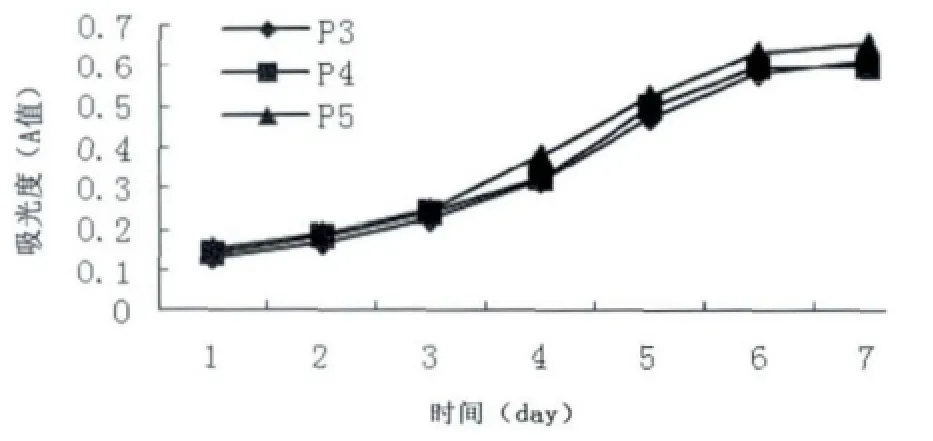
图3 BMSCs的生长曲线Fig 3 The growth curve of BMSCs
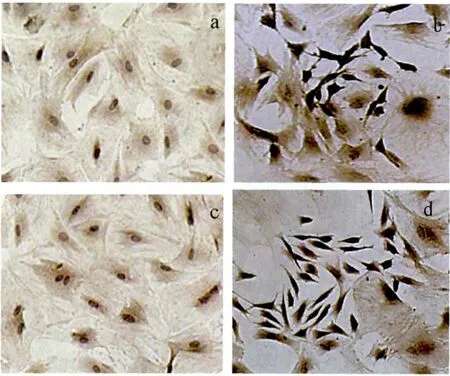
图4 细胞免疫化学检测神经诱导细胞的NSE表达(×100)Fig 4 The expression of NSE detected by Cytochemistry(×100)
3 讨论
高度特化的神经细胞是神经系统的基本结构和功能单位,一旦大脑或脊髓中的神经细胞损伤或缺失便会引起一系列的神经系统疾病,且神经细胞受损后往往不能重建正常的树突和轴突联系。而内源性神经干细胞在神经受损时因量少且缺乏正向信号的激活,无法进行组织修复;外源性神经干细胞来源受限、涉及伦理学争议及免疫排斥等诸多问题,存在应用的局限性。1999年,Kopen等[6]首次发现BMSCs新生鼠脑移植后可分化为神经细胞和神经胶质细胞;2000 年,Woodbury等[7]首次证实 BMSCs可在体外向神经细胞诱导分化。BMSCs如用于治疗神经系统疾病,因其具有取材方便、易于分离和扩增、免疫原性低、可自体移植等优势,比其他细胞具有显著优势[8-9]。
基于BMSCs可能分化为神经样细胞从而促进神经系统功能恢复的假设,本课题组参考国外文献的成功报道,并结合实际情况设计了RA、bFGF和EGF联合诱导的方案。实验结果显示,在RA、bFGF和EGF联合诱导下,BMSCs在形态上发生近似神经细胞的变化,而且免疫染色显示部分细胞表达NSE,说明这部分细胞具有神经细胞的特征。
RA、bFGF和EGF联合诱导BMSCs分化为神经细胞的作用可能是通过以下几方面实现:(1)有研究表明,RA能催化胚胎干细胞定向诱导分化为神经元,并明显增加神经细胞的数量。RA能调控细胞的生长增殖及分化,有很强的诱导剂功能。RA能调节EGF反应的神经干细胞分化,增加神经细胞和星形胶质细胞的合成[10]。(2)EGF是有丝分裂的促进因子,对神经干细胞分裂有促进作用,可诱导神经干细胞向星形胶质细胞分化,促进神经元轴突的延长和维持神经元的存活[11]。(3)bFGF是体内重要的神经营养因子,能促进神经干细胞增殖并向神经细胞分化,能维持神经细胞和神经胶质细胞存活[12-13]。有文献报道,bFGF 可能参与了 BMSCs向神经元分化的启动,并参与细胞的生长、发育和组织损伤的修复[14-15]。(4)bFGF和EGF对神经前体细胞增殖具有协同作用,促进神经干细胞分化[16]。
本实验结果为下一步的细胞移植治疗神经系统疾病提供了基础,可通过将BMSCs分离培养并诱导分化为神经细胞后,将其移植入损伤局部,并观察其疗效,以期为临床应用BMSCs移植治疗神经系统损伤提供实验依据。
:
[1]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143 -147.
[2]Herzog EL,Chai L,Krause DS,et al.Plasticity of marrowderived stem cells[J].Blood,2003,102(10):3483 -3493.
[3]雷阳,牟文松,雄鹰,等.骨髓基质干细胞不同途径移植对脑缺血治疗的影响[J].大连医科大学学报,2009,31(3):28-33.
[4]van Velthoven CT,Sheldon RA,Kavelaars A,et al.Mesenchymal stem cell transplantation attenuates brain injury after neonatal stroke[J].Stroke,2013,44(5):1426 -1432.
[5]Huang W,Mo X,Qin C,et al.Transplantation of differentiated bone marrow stromal cellspromotes motor functional recovery in rats with stroke[J].Neurol Res,2013,35(3):320-328.
[6]Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mouse brains[J].Proc Natl Acad Sci USA,1999,96(19):10711-10716.
[7]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364 -370.
[8]Wakeman DR,Dodiya HB,Kordower JH.Cell transplantation and gene therapy in Parkinson's disease[J].Mt Sinai J Med,2011,78(1):126 -158.
[9]Wislet- Gendebien S,Laudet E,Neirinckx V,et al.A-dult Bone Marrow:Which Stem Cells for Cellular Therapy Protocols in Neurodegenerative Disorders[J].J Biomed Biotechnol,2012,2012:601560.
[10]Kaito T,Myoui A,Takaoka K.Potentiation of the activity of bone morphogenetie protein-2 in bone regeneration by a PLA - PEG/hydroxyapatite composite[J].Biomaterials,2005,1(26):73 -79.
[11]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cell differentiate into neurons[J].J Neurosci Res,2000,61(4):364 -370.
[12]Sieber-Blum M,Zhang JM.Growth factor action in neural crest cell diversification[J].J Anat,1997,191(Pt4):493- 499.
[13]Pincus DW,Keyoung HM,Harrison-Restelli C,et al.Fibroblast growth factor-2/brain-derivered neurotrophic factor-associated maturation of new neurons generated from adult human subependymal cells[J].Ann Neurol,1998,43(5):576 -585.
[14]Okabe S,Forsberg-Nisson K,Spiro AC,et al.Development of neuronal precursor cells and functional postnitotic neurons from embryonic stem cells in vitro[J].Mech Dev,1996,59(1):89-102.
[15]Xu C,Rosler E,Jiang J,et al.Basic fibroblast growth factor supports undifferentiated human embryonic stem cell growth without conditioned medium[J].Stem Cell,2005,23(3):315-323.
[16]Tamama R,Fan VH,Griffith LG,et al.Epidermal growth factor as a candidate for ex vivo expansion of bone marrow derived mesenchymal stem cells[J].Stem Cells,2006,24(3):686-695.
Neuron-like cells differentiated from rat mesenchymal stem cellsin vitro
LI Shuang-yue,WANG Zhe-min,CHEN Ruo-lin,QI-Yuan,LIU Shuang,PIAO Feng-yuan
(Department of Occupational and Environmental Health,Dalian Medical University,Dalian116044,China)
[Abstract]ObjectiveTo isolate and culture rat bone marrow mesenchymal stem cells(BMSCs)and induce them differentiate to neural cells.MethodsBMSCs were isolated from rats by wall sticking method.Then the cells were identified with morphology,proliferation and the surface markers.Neuron-like cells from BMSCs were induced by the combination of retinoic acid(RA),fibroblast growth factor,basic(bFGF)and epidermal growth factor(EGF),and their neuron specific enolasen(NSE)were detected by NSE immunohistochemistry.ResultsCultured BMSCs like fibroblast- shapedin vitro.Growth curves of the 3rd,4thand 5th -generation BMSCs and their activities were not significantly different.FCM detected that CD29 and CD90 were positively expressed,but CD34 was negatively expressed.The induced BMSCs showed neuronlike morphology and expressed NSE,the neuron marker.ConclusionWe have established an efficient and steady method to obtain BMSCs.BMSCs could differentiated into neurons which was an ideal source for clinical cell transplantation in treatment of nervous system diseases.
[Key words]mesenchymal stem cells;neuron;differentiate;induce;culture
R322.2
A
1671-7295(2014)01-0007-04
李双月,王哲敏,陈若霖,等.体外诱导大鼠骨髓间充质干细胞向神经细胞分化的实验研究[J].大连医科大学学报,2014,36(1):7 -10.
10.11724/jdmu.2014.01.02
国家自然科学基金项目(81102160,81273038)
李双月(1978-),女,黑龙江哈尔滨人,讲师。
朴丰源,博士生导师,教授。E-mail:piaofy_dy@163.com
2013-09-15;
2014-01-02)

