红果冬青组培快繁技术研究
杨灿,陈丽洁,黄小辉,蒋宣斌,张宏,朱恒星
(重庆市林业科学研究院 三峡库区森林生态保护与恢复重庆市市级重点实验室,重庆 400036)
红果冬青组培快繁技术研究
杨灿,陈丽洁,黄小辉,蒋宣斌,张宏,朱恒星
(重庆市林业科学研究院 三峡库区森林生态保护与恢复重庆市市级重点实验室,重庆 400036)
红果冬青具有较高的药用价值,但传统育苗方式效率低,采用组织培养方法可快速繁殖红果冬青。对红果冬青茎段进行组织培养试验,结果表明:红果冬青最佳灭菌方法为0.1%升汞灭菌8 min;最佳启动培养基为MS+BA1.4 mg·L-1+NAA0.2 mg·L-1,萌芽率可达82.5%;继代培养基1/2MS+ BA1.4 mg·L-1+NAA0.2 mg·L-1+KT0.2 mg·L-1,增殖系数达4.1;生根培养基1/2MS+NAA0.2 mg·L-1+IAA0.2 mg·L-1,生根率达90%。
红果冬青;组织培养;培养基
红果冬青(IlexpurpueaHassk),属冬青科(Aquifoliaceae)冬青属(Ilex),常绿乔木。其叶色翠绿,四季常青,入秋红果累累,鲜艳美丽,挂果期较长,可从当年10月持续到次年4-5月[1,2]。红果冬青具有治疗烫伤、火伤、小儿头疮,活血镇痛,清热解毒的药用价值。冬青属种子是种胚细胞分化尚未完成的典型,有隔年发芽的特性,种子发芽十分困难,且幼苗期生长缓慢,种子从萌发到成年树需要的年限较长。目前红果冬青主要通过种子繁殖和扦插繁殖,繁殖效率较低,不能满足优良品系快速繁殖的生产要求[3]。有关冬青属植物的组织培养已有部分报道[4~8],增殖系数可达3~6,但未见工厂化生产应用的报道。 本研究以前期筛选得到的药用红果冬青优良品系的嫩梢为外植体,应用不同激素配比的培养基进行初代诱导试验,建立了红果冬青的植株再生体系,总结了红果冬青组培快繁的培养方式,为红果冬青组培快繁提供了有用的数据及技术支持,在生产上具有重要的现实意义[9]。
1 材料与方法
1.1 材料处理
取4-5月红果冬青新萌发的嫩芽枝条,将嫩枝条放入洗涤剂溶液中浸泡5 min,然后用自来水冲洗30 min,剪掉多余的叶片,剪成2 cm左右带芽的茎段,超净工作台中,先将茎段用无菌镊子夹入无菌瓶中,用加有吐温-80的0.1%升汞灭菌时间分别为2、4、6、8、10和12 min,用无菌蒸馏水浸泡清洗5~6次,将氯化汞残液洗净,用无菌滤纸吸干材料上的多余水分。接种时先用无菌手术刀将材料切成单芽茎段,然后接种到启动培养基中,用长镊子夹取材料将其直立着插入培养基约1 cm左右,启动培养每组接入40株。接种后一周内及时观察杂菌污染情况,若发现培养瓶内发生污染立即把未污染的材料转移到新鲜的培养基或重新接种补齐。
1.2 试验方法
1.2.1 培养条件
培养基在121℃下灭菌20 min,接种前灭菌后的培养基在贮藏室室温下贮存3 d。初代、继代培养的光照条件培养室光强为2000~2500 lx,光照12 h·d-1,温度24~26℃,室内湿度60%~70%。
1.2.2 培养基
启动培养:
(1)MS空白培养基;
(2)MS+BA0.7 mg·L-1+IBA0.2 mg·L-1;
(3)MS+KT1 mg·L-1+IBA0.2 mg·L-1;
(4)MS+BA0.7 mg·L-1+NAA0.2 mg·L-1;
(5)MS+BA1 mg·L-1+NAA0.2 mg·L-1;
(6)MS+BA0.9 mg·L-1+NAA0.2 mg·L-1;
继代培养:
(1)MS空白培养基;
(2)MS+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.5 mg·L-1;
(3)MS+BA1 mg·L-1+NAA0.2 mg·L-1+GA31 mg·L-1;
(4)MS+BA1 mg·L-1+IBA0.2 mg·L-1+GA30.2 mg·L-1;
(5)MS+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.2 mg·L-1;
(6)MS+BA1 mg·L-1+NAA0.4 mg·L-1+GA30.2 mg·L-1;
(7)MS+BA1 mg·L-1+NAA0.1 mg·L-1+GA30.2 mg·L-1;
(8)WPM+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.2 mg·L-1;
(9)1/2MS+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.2 mg·L-1;
(10)1/2WPM+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.2 mg·L-1;
(11)1/4MS+BA1 mg·L-1+NAA0.2 mg·L-1+GA30.2 mg·L-1;
生根培养:
(1)1/2MS+NAA0.1 mg·L-1+IAA0.1 mg·L-1;
(2)1/2MS+NAA0.2 mg·L-1+IAA0.2 mg·L-1;
(3)1/2MS+NAA0.2 mg·L-1;
(4)1/2MS+IAA0.2 mg·L-1;
(5)1/2MS+NAA0.3 mg·L-1+IAA0.3 mg·L-1;
(6)1/2MS+NAA0.4 mg·L-1+IAA0.4 mg·L-1;
上述培养基均加蔗糖30 g·L-1,卡拉胶10.5 g·L-1,调pH值至5.8。
2 结果与分析
2.1 不同灭菌时间对材料的影响
接种后7 d,观察外植体污染、成活情况,结果见表1。虽然用0.1%升汞消毒12 min污染最少,但是成活率比较低,综合考虑消毒效果和成活率,采用0.1%升汞消毒8 min效果最佳。
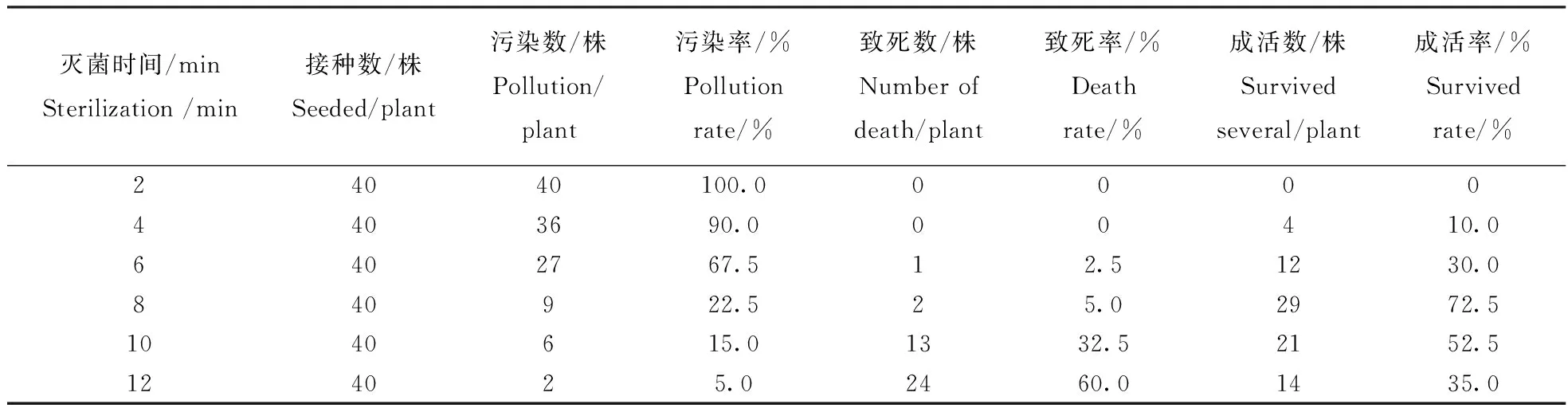
表1 不同灭菌时间外植体表现
2.2 启动培养
挑选出接种后污染的材料,接种补齐每个启动培养组合。茎段接种后约7 d,腋芽开始萌动。再经6~7 d腋芽长出新的绿色幼芽。接种后25 d新芽进入正常生长阶段。接种后30 d时调查材料生长情况,结果见表2。在以MS为基本培养基的组合中,以(4)MS+BA0.7 mg·L-1+NAA0.2 mg·L-1和蔗糖30 g·L-1的培养基萌芽率最高82.5%,长势好;其次是(6)MS+BA0.9 mg·L-1+NAA0.2 mg·L-1,诱导萌芽率为72.5%;(1)MS空白培养基诱导萌芽率最差,只有12.5%。
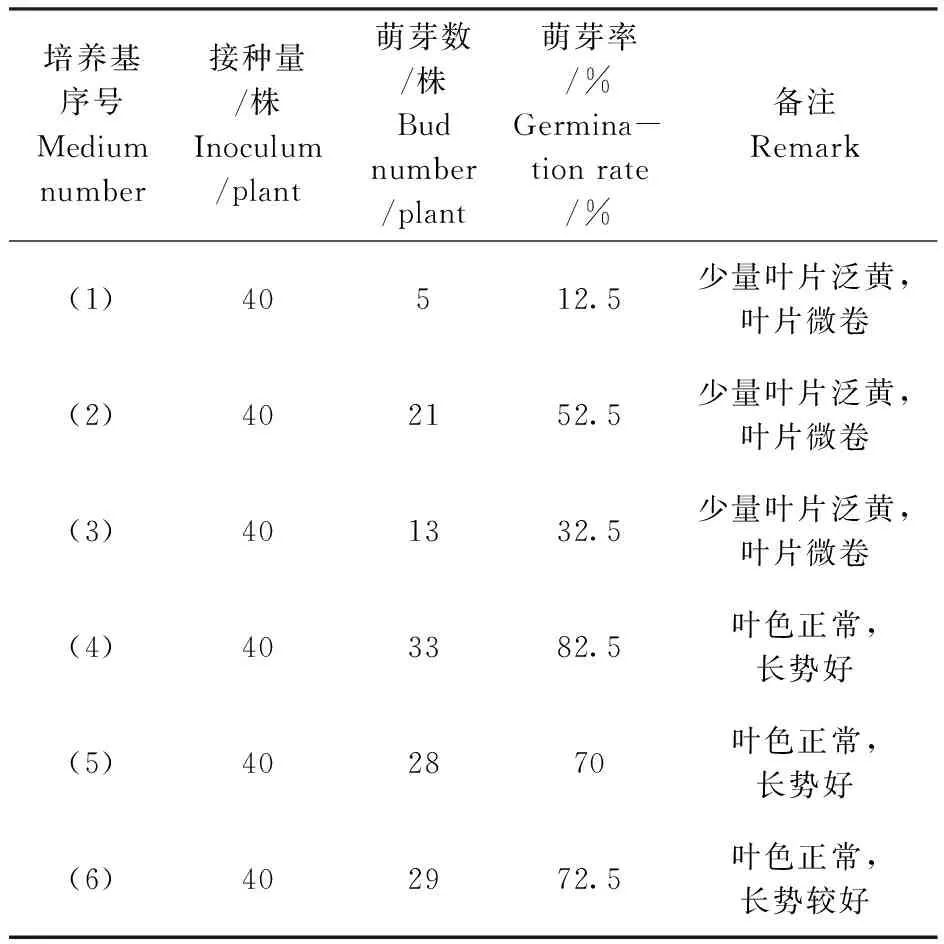
表2 不同培养基对启动培养的影响
2.3 继代培养
将萌芽后的茎段接种在不同激素浓度的增殖培养基上,20~30 d观察红果冬青增殖情况,结果见表3和图1。以MS为基本培养基的组合(5)与组合(9)的激素种类和含量相同,增殖系数最高且相近,但是组合(5)红果冬青的叶色部分淡黄,而组合(9)的叶色正常。组合(9)的盐离子浓度为组合(5)的一半,表明红果冬青适宜于在低离子浓度的培养基条件下培养。
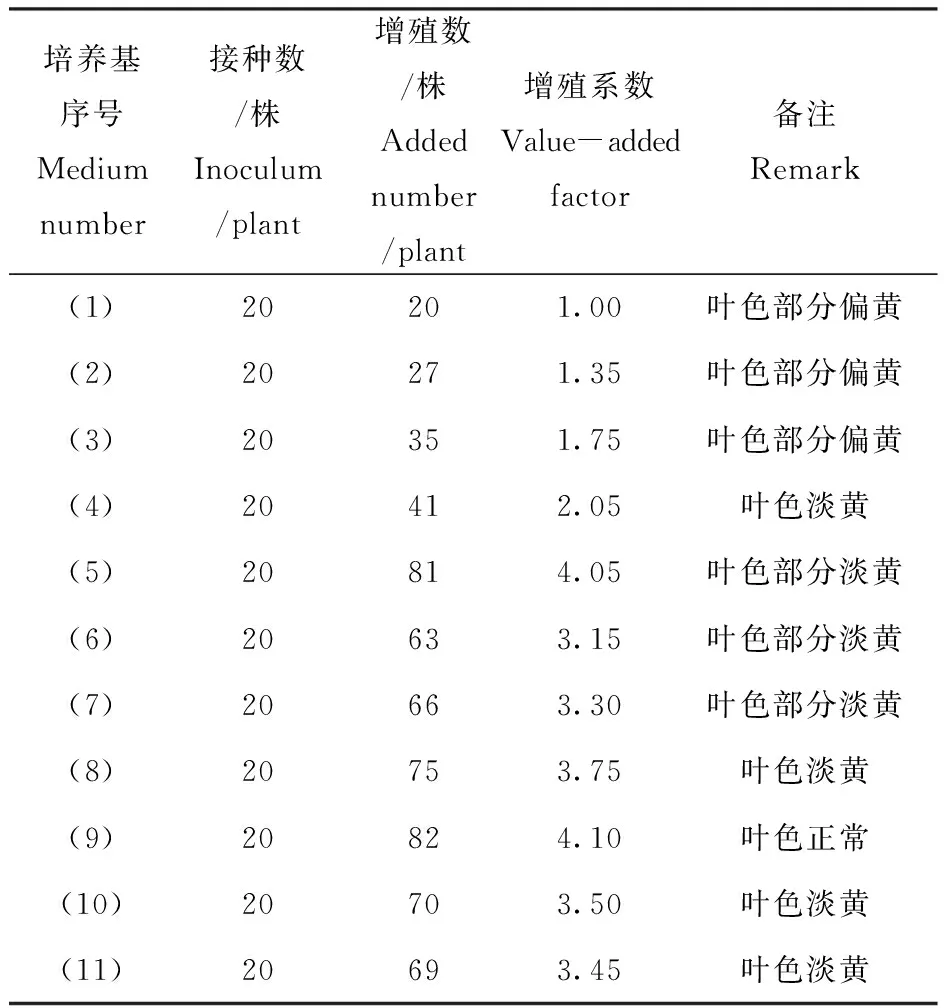
表3 不同培养基对增殖培养的影响

图1 红果冬青增殖情况
2.4 生根培养
由表4可见,在(2)1/2MS+NAA0.2 mg·L-1+IAA0.2 mg·L-1培养基上生根率最高达到90%,而仅用NAA0.2 mg·L-1时生根率下降为40%,仅用IAA0.2 mg·L-1时生根率下降为46.7%。在(5) 1/2MS+NAA0.3 mg·L-1+IAA0.3 mg·L-1培养上生根率为56.7%,当NAA和IAA分别用0.4 mg·L-1时,随着生长素浓度的升高,生根率反而下降,生根率为20%。
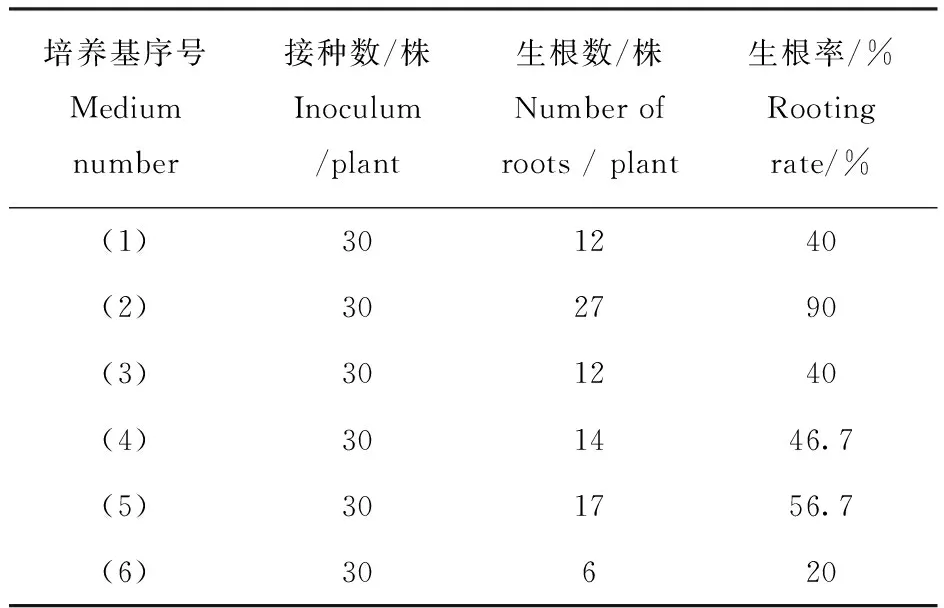
表4 不同培养基对生根培养的影响
3 讨论与结论
通过对红果冬青茎段灭菌处理时间,启动培养,继代培养的研究发现,最适合红果冬青灭菌处理为采用0.1%升汞灭菌8 min;红果冬青在MS+BA0.7 mg·L-1+NAA0.2 mg·L-1初代培养基中,诱导萌芽率可达82.5%;在继代培养基1/2MS+ BA1 mg·L-1+NAA0.2 mg·L-1+ GA30.2 mg·L-1中增殖系数最高,为4.1,长势好。在生根培养基1/2MS+NAA0.2 mg·L-1+IAA0.2 mg·L-1中,生根率达到90%。随着生长素浓度增加到一定值,生根率达到最高,继续增加生长素浓度生根率降低,与其他学者的研究结果相似[10]。
在红果冬青增殖阶段,叶片失绿、变黄。MS无机盐含量高,WPM无机盐含量低,在2种基本培养基中生长都有叶片失绿,选用1/2MS作为基本培养基,红果冬青生长正常,叶色正常。生根培养阶段,因为植物组织培养在生根培养过程中,培养基中除了pH下降之外,其余成分含量均上升,其中铁、磷、氮、钾和钙上升的幅度最大[11,12],所以生根培养中的基本培养基采用降低了大量元素含量的培养基1/2MS。
[1]周心铁.红果冬青[J].湖北林业科技, 2004(1):8.
[2]杜军,高艳鹏,宋书芳.红果冬青在兖州市的引种栽培调查[J].山东林业科技,2010(4):67-69.
[3]刘德华,廖利民,张金莲.苦丁茶树微繁殖技术的研究[J].湖南农学院学报,1994,20(3):234-239.
[4]王桂文,周兴,李海鹰,等.苦丁茶冬青茎段离体培养[J].植物生理学通讯,1995,31(5):358-359.
[5]刘根林,蒋泽平,刘泽东,等.苦丁茶的组织培养研究[J].江苏林业科技,1999,26(1):40-42.
[6]Morte M A,Olmos E,Hellin E,et al.Micropropagation of holly(Ilex aquifolium)[J].Acta Horticulturae,1991,289:139-140.
[7]夏海武. 红果冬青的组织培养与快速繁殖[J],植物生理学通讯,2001,37(4):309-310.
[8]Hu C Y.Advances in Ilex embryo culture[C].//Proceedings of the 54th meeting of the Holly Socity of America,1977:5-6.
[9]姚延梼.华北落叶松营养元素及酶活性与抗逆性研究[D].北京:北京林业大学,2006.
[10]张晓申,邢廷茂,王慧瑜,等.红果冬青快繁技术的研究[J].山东农业科学,2012,44(2):41-43.
[11]辜夕容.植物组织培养基营养动态研究[D].四川农业大学,2000.
[12]王慧瑜,张晓申,赵海红,等.大叶冬青组培快繁技术研究[J].农业科技通讯,2013(10):69-70.
StudiesonTissueCultureandRapidPropagationTechniquesofIlexpurpueaHassk
Yang Can, Chen Lijie, Huang Xiaohui, Jiang Xuanbin, Zhang Hong, Zhu Hengxing
(ChongqingAcademyofForestry,ChongqingKeyLaboratoryoftheThreeGorgesAreaForestEcologyProtectionandRestoration,Chongqing400036,China)
IlexpurpueaHassk has high medicinal value, with a low breeding efficiency by traditional style. However, it can be fast bred by the tissue culture method. In this study,IlexpurpueaHassk stem was obtained for tissue culture test. The results show that the best sterilization time forIlexpurpueaHassk is 8 min with 0.1% mercuric chloride sterilization; the best initial medium is MS + BA1.4 mg·L-1+NAA0.2 mg·L-1, in which the germination rate can reach 82.5%; Successive transfer culture medium is 1/2 MS + BA1.4 mg·L-1+NAA0.2 mg·L-1+KT0.2 mg·L-1, with multiplication coefficient of 4.1. Rooting culture medium is 1/2MS+NAA0.2 mg·L-1+IAA0.2 mg·L-1, with rooting rate up to 90%.
IlexpurpueaHassk;Tissue culture;Medium
2013-11-20
2014-04-17
杨灿(1989-),女(汉),重庆人,在读硕士,研究方向:园艺。
朱恒星,博士。Tel:15213188486;E-mail:17249643@qq.com
重庆市林业科学研究院基本科研业务专项(BL1005)
S792.990.5
A
1671-8151(2014)04-0356-04
(编辑:马荣博)

