ST细胞的鉴定及种子细胞库的建立
彭丽英,章伟建,张华弟,徐平 ,钱忠辉,潘杰,朱永军,张春玲,蒋凤英,何锡忠,徐伟林,张婉华
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海佳牧生物制品有限公司,上海 201106;3.上海市动物无害化处理中心,上海 201415;4.上海科立特农科(集团)有限公司,上海 201106)
ST细胞的鉴定及种子细胞库的建立
彭丽英1,2,章伟建3,张华弟1,2,徐平1,2,钱忠辉1,2,潘杰1,2,朱永军1,2,张春玲1,2,蒋凤英1,2,何锡忠1,2,徐伟林4,张婉华1,2
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海佳牧生物制品有限公司,上海 201106;3.上海市动物无害化处理中心,上海 201415;4.上海科立特农科(集团)有限公司,上海 201106)
为确保疫苗生产的的安全性,对不同代次的ST细胞进行鉴定。从中国兽医药品监察所引进第40代的ST细胞,传至80代,每个代次各冻存3瓶于液氮中。细胞复苏后,对细胞的特征、纯净度、核型、致瘤性及对细胞的毒性进行了研究。结果表明,ST细胞系呈现梭状上皮细胞,生长状态良好,细胞的生长速度基本一致;细菌、霉菌、支原体、外源病毒的检测均为阴性;染色体数目为19对且核型相同;无致瘤性;对豚鼠和兔子无毒性;病毒在ST细胞系中稳定地繁殖,TCID50≥107.00,HI≥1∶32。建立ST细胞的种子细胞库,为开展猪细小病毒疫苗的生产提供安全保障,也为猪伪狂犬病疫苗及猪细小病毒弱毒苗的研究提供基础理论依据。
ST细胞系;细胞库;生物学特性
猪睾丸细胞(Swine Testis,ST)属于成纤维细胞系,体外可连续传代贴壁培养。该细胞系对多种病毒敏感,如:猪细小病毒(PPV)[1]、伪狂犬病毒(PRV)[2]、猪瘟病毒(CSFV)[3]、猪传染性胃肠炎(TGEV)[4]等。在疫苗生产中繁殖病毒用细胞是主要的原辅材料之一,它直接影响到疫苗的质量,所以无论是疫苗的新兽药证书的申请还是生物制品兽药GMP车间的验收,种子细胞的鉴定及种子细胞库的建立都是关键项目[5,6]。本研究对从中国兽医药品监察所引进ST细胞系进行了传代,并对ST细胞进行了鉴定。确定一级种子细胞、二级种子细胞、三级种子细胞范围以及生产细胞的最高代次,从而建立了相应的种子细胞库,确保疫苗的质量。
1 材料与方法
1.1 材料
细胞,ST细胞购自中国兽医药品监察所(中国微生物菌种保藏管理委员会兽医微生物中心)。
细胞用培养基,DMEM及犊牛血清购买于GOBICO公司。
液氮罐及其他仪器设备,由上海佳牧生物制品有限公司提供。
1.2 方法
1.2.1 ST细胞传代及保存
将购自中国兽医药品监察所(中国微生物菌种保藏管理委员会兽医微生物中心)的第40代ST细胞长满单层后进行传代,传至80代。第41代冻结保留,保留3瓶,其余每一代ST细胞冻结保留,各保留5瓶。以便随时进行检验。
1.2.2 ST细胞的特征性检测
在ST细胞的传代中,对41~80代各代次细胞进行仔细观察,观察细胞的形态、细胞的生长速度以及产酸等情况。
1.2.3 ST细胞种子细胞纯净度检测的试验
按《中华人民共和国兽药典》[7]附录进行无细菌、霉菌、霉形体、支原体及外源病毒的检验。
1)无菌检验
分别取ST细胞第45、50、55、60、65、70、75、80代的消化后细胞弃上清,加维持液10 mL悬浮后为待检样品,按《中华人民共和国兽药典》[7]附录进行。
2) 支原体检验
按《中华人民共和国兽药典》[7]附录进行。每次设阴、阳性对照,阳性样品为猪鼻支原体。在同样条件下培养,观察有无支原体生长。
3 )外源病毒的检测
按《中华人民共和国兽药典》[7]附录进行。
1.2.4 ST细胞的细胞核学检测
取50个处于有丝分裂中期的细胞进行检查[5],用常规方法制备染色体标本后用油镜观察,染色体形态及细胞染色体数目。
1.2.5 ST细胞的致瘤性(致癌性)鉴定[8]
接种乳鼠 将第45、80代的ST活细胞以及冻融的ST细胞悬浮于适量无血清培养基中,使细胞浓度为5×107个细胞·mL-1,各接种乳鼠一窝,每只裸鼠皮下注射0.2 mL,同时设接种Hep-Ⅱ细胞为阳性对照,每只注射0.2 mL含5×106个细胞;接种DMEM培养液为阴性对照,每只注射0.2 mL含5×107个细胞。每窝至少10只,和母鼠一同饲养。
1.2.6 病毒培养适应性检验
分别取第45、50、55、60、65、70、75、80代ST细胞培养猪细小病毒强毒株,测定其病毒含量;病毒接种乳鼠观察其毒力;病毒灭活后配苗接种豚鼠测定其免疫原性[9]。
2 结果
2.1 ST细胞的特征性检测
在ST细胞的传代中,对41~80代各代次细胞进行仔细观察, 可见细胞均呈现梭状上皮细胞,轮廓清晰、明朗,细胞浆内可见小颗粒。细胞传代后24 h可见细胞形成不规则的细胞岛屿,随后长成细胞单层。细胞的生长速度基本一致。
2.2 ST细胞种子细胞纯净度检测的试验结果
2.2.1 无菌检验结果
ST细胞第45、50、55、60、65、70、75、80代的待检样品,分别接种T.G、G.P和G.A培养基后, T.G培养液无颜色变黄也无液体变浑浊;G.A斜面无菌落形成;G.P培养液无颜色变黄或液体变浑浊。
2.2.2 支原体检验
ST细胞第45、50、55、60、65、70、75、80代的待检样品5 mL接种小瓶的液体培养基后,在最后一次移植到小管后观察14 d培养物无颜色变黄或变红,移植固体培养基后的没有出现典型的“煎蛋”状菌落;阴性对照也无颜色的变化,也无典型的“煎蛋”状菌落;阳性对照在接种第5天时液体颜色变黄,移植固体培养基后的第7天有典型的“煎蛋”状菌落。
2.2.3 外源病毒的检验结果
1)荧光抗体检测结果
分别取ST细胞第45、50、55、60、65、70、75、80代的细胞连传两代后,丙酮固定并经牛病毒性腹泻/粘膜病毒(BVDV)、伪狂犬病病毒(PRV)、狂犬病病毒(RV)、猪细小病毒(PPV)及猪瘟病毒(HCV)的特异荧光抗体进行染色后,镜检,均无荧光。
2)致细胞病变的外源病毒的检测
分别取ST细胞第45、50、55、60、65、70、75、80代的细胞传代后培养7 d后,PBS冲洗,经甲醛固定,苏木素-伊红染色,无包涵体、巨细胞或由其它外源病毒引起的细胞病变。
3)红细胞吸附性外源病毒的检测
分别取ST细胞第45、50、55、60、65、70、75、80代的细胞传代后培养7 d后,PBS冲洗,加入0.2%红细胞悬液适量, 2℃~8℃和20℃~25℃培养30 min,用PBS洗涤,无红细胞吸附。
2.3 ST细胞的核型分析
对第45、50、55、60、65、70、75、80代的ST细胞进行了核型比较分析:细胞染色体数目均为19对即38条,细胞中均存在染色体标志,并且核型相同。
2.4 ST细胞的致瘤性(致癌性)的检测
接种乳鼠临床症状:阳性对照观察至4周时,9只乳鼠全部死亡,母鼠健在。其余接种组及阴性对照组的乳鼠均健活。结果见表1。

表1 ST细胞对乳鼠的致瘤性试验
2.5 在ST细胞中病毒培养适应性
分别取第45、50、55、60、65、70、75、80代ST细胞培养猪细小病毒强毒株,测定其病毒含量均大于107.00;免疫原性均≥1∶32;接种乳鼠100%死亡。见表2。
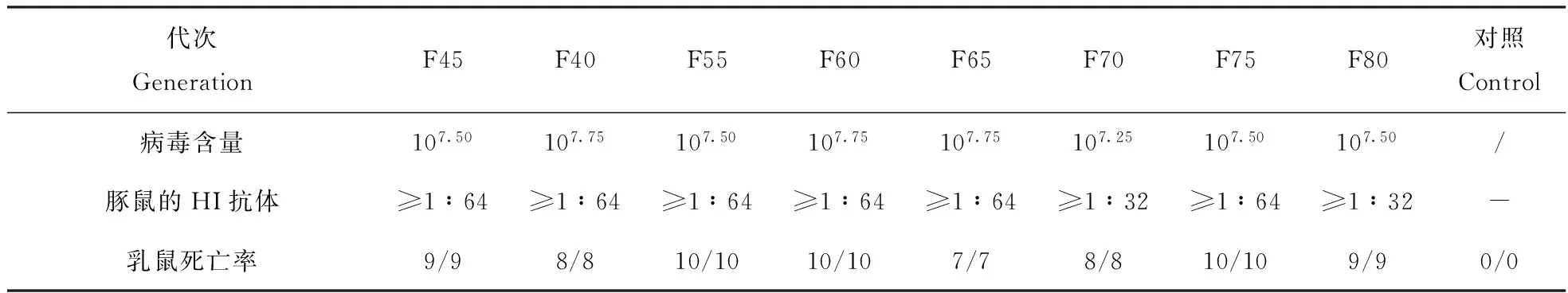
表2 在ST细胞中病毒培养适应性
注:"-"表示为阴性;"/"表示未做;"*/*"中前者*为死亡的乳鼠数,后者*为一窝乳鼠数。
Note:"-" indicate negative ;"/" indicate not done; the former * being the number of suckling of death of "*/*",the latter * being of the number suckling of a nest mice "*/*"
2.6 ST细胞三级种子细胞的建立
依据ST细胞种子纯净度检测的试验结果、ST细胞的生物学特性及致瘤性(致癌性)检测结果、病毒敏感性检测和细胞毒性试验结果以及生产疫苗的具体情况确立三级种子细胞范围:一级种子细胞范围为41~45代;二级种子细胞范围为46~70代;三级种子细胞范围为71~75代。
3 讨论与结论
将从中国兽医药品监察所引进40代ST细胞进行传代,每个代次各取3瓶冻存于液氮中,传至80代。细胞复苏后,对细胞的特征、纯净度、核型、致瘤性、病毒培养适应性及对细胞的毒性进行了研究。结果表明,ST细胞系呈现梭状上皮细胞,生长状态良好,细胞的生长速度基本一致;细菌、霉菌、支原体、外源病毒的检测均为阴性;染色体数目为19对且核型相同;无致瘤性;对豚鼠和兔子无毒性,病毒可以在ST细胞系中稳定地繁殖,并能保持该病毒毒免疫原性和毒力。所以建立ST细胞的3级种子细胞库。
ST细胞在传代中能保持相对稳定的遗传性,为疫苗的研发及生产打下了基础。同时,病毒能够在ST细胞系中稳定、高效价地繁殖,确保了疫苗免疫后能够产生较高的免疫效力。种子细胞库的建立为猪细小病毒灭活疫苗的生产提供安全保障,也为猪细小病毒活疫苗及猪伪狂犬病灭活疫苗的研究及开发提供基础理论依据。
[1]殷震,刘景华.动物病毒学(第2版)[M].北京:科学出版社,1997:1151.
[2]彭丽英,倪建平,张婉华,等.猪伪狂犬病病毒在不同细胞中增殖的研究[J].上海农业学报,2011,27(4):67-69.
[3]刘宁,时洪艳,陈建飞,等.猪瘟病毒衣壳蛋白的细胞核定位[J].中国预防兽医学报,2014,36(1):72,80.
[4]周燕,王建超,华平,等.猪传染性胃肠炎病毒在ST细胞中增殖规律的研究[J].中国兽医科技,2005,35(6):423-427.
[5]中华人民共和国农业部畜牧兽医局.兽药生产质量管理规范培训指南[M].北京:中国农业出版社,2002:380.
[6]中华人民共和国农业部公告第442号.兽用生物制品注册分类及注册资料要求[S].北京:中华人民共和国农业部,2004:21.
[7]国家药典委员会.中华人民共和国兽药典(2010版)[M].北京:中国医药科技出版社,2010:21.
[8]中华人民共和国农业部公告第683号.兽用生物制品试验研究技术指导原则[S].北京:农业部兽药评审中心,2006:16-17.
[9]张婉华,叶向阳,徐平,等.用豚鼠效检猪细小病毒病油乳剂灭活疫苗判断标准的初步研究[J].上海农业学报,2004,20(1):120-122.
IdentificationandEstablishmentofSTCellsBank
Peng Liying1,2, Zhang Weijian3, Zhang Huadi1,2,Xu Ping1,2,Qian Zhonghui1,2, Pan Jie1,2, Zhu Yongjun1,2, Zhang Chunling1,2, Jiang Fengying1,2, He Xizhong1,2, Xu Weilin4,Zhang Wanhua1,2
(1.AnimalHusbandryandVeterinaryResearchInstitute,ShanghaiAcademyofAgriculturalSciences,Shanghai201106,China;2.ShanghaiJiamuBiologicalsLimitedCompany,Shanghai201106,China;3.ShanghaiMunicipalAnimalInnocuousTreatmentCentre,Shanghai201415,China;4.ShanghaiCo-EliteAgriculturalSci-Tech(group)Co.Ltd.,Shanghai201106,China)
In order to ensure the safety of the vaccine production, ST cells of different generation was identified. 40 generations of ST cells was imported from China Institute of Veterinary Drugs Control and passaged to 80 generations; 3 bottles of each generation times were frozen to storage in liquid nitrogen. The characteristics, purity and karyotype, tumorigenicity and cell toxicity of the cells were studied after the recovery of frozen cells. The results showed that ST cell lines presented fusiform epithelial cells and growth well, with almost an equal cell growth speed among different generations.. Bacteria, mold, mycoplasma, exogenous virus detection were negative. The chromosome number was 19 pairs and karyotype was the same. No tumorigenicity and no toxic for guinea pigs and rabbits. The virus in the ST cell line stably reproduced,TCID50≥107.00,HI≥1∶32. The ST cell hank was established. It was provided security for the pig parvovirus vaccine production, and the basis of the basic theory of the vaccine for the pig pseudo rabies vaccine and the pig parvovirus weak poison vaccine research.
ST cellline;Cell bank;Biological characteristics
2014-03-04
2014-04-18
彭丽英(1968-),女(汉),山西临汾人,研究员,研究方向:疫苗研发等。
张婉华,副研究员。Tel:021-62205528;E-mail:zhangwanhua@sina.com
上海市科学技术委员会产业化项目(11D21930400)
858.28
A
1671-8151(2014)04-0336-03
(编辑:武英耀)

