PI3K 和MAPK抑制剂对胃肠道间质瘤细胞系GIST-T1细胞增殖和凋亡的影响
高华,朱长明,王涛,白利平,康向鹏,闫峰
(厦门大学附属中山医院胃肠外科,福建厦门361004)
PI3K 和MAPK抑制剂对胃肠道间质瘤细胞系GIST-T1细胞增殖和凋亡的影响
高华,朱长明,王涛,白利平,康向鹏,闫峰Δ
(厦门大学附属中山医院胃肠外科,福建厦门361004)
目的研究胃间质瘤中(磷脂酰肌醇-3-激酶)PI3K和(丝裂原活化蛋白激酶)MAPK信号通路对FOXO1的活性调节及胃间质瘤细胞增殖和凋亡的影响。方法采用PI3K信号通路抑制剂LY294002和MAPK信号通路特异性抑制剂UO126单独或联合处理细胞,CCK-8法检测其对细胞增殖的影响;Western blot检测FOXO1、p-FOXO1蛋白及信号下游蛋白Bcl2、Bax表达的变化;免疫荧光法检测FOXO1蛋白在GIST-T1细胞中的细胞定位的变化。结果与DMSO组相比,LY294002和UO126单独、联合处理组GIST-T1细胞增殖明显受到抑制(P<0.05),且呈时间依赖性。Western blot结果显示,总FOXO1蛋白表达水平未见显著变化,而p-FOXO1及Bcl2蛋白表达下降(P<0.05),Bax蛋白的表达增加(P<0.05)。免疫荧光显示FOXO1在GIST-T1细胞中的细胞核移位明显增多。LY294002和UO126联合处理GIST-T1细胞较药物单独应用时作用效果显著增强(P<0.05)。结论LY294002和UO126能够抑制GIST-T1细胞增殖;PI3K和MAPK信号通路能通过调节FOXO1蛋白磷酸化水平,使其转录活性受到抑制,进而抑制Bcl2的表达,增加Bax的表达,且2种抑制剂作用效果具有协同效应。
FOXO1;PI3K;MAPK;胃肠道间质瘤;Bcl2;Bax
胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)是消化道最常见的间叶组织肿瘤,是一种具有恶性潜能的胃肠道肿瘤[1]。GISTs发病率约为1~2例/10万人口,发病率有逐年增加的趋势[2]。FOXO1是FoxO蛋白家族成员,现已发现FOXO1与细胞凋亡、DNA损伤/修复、细胞自噬、氧化应激、血管生成和糖代谢等密切相关[3-5]。磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI-3K)和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是调节FOXO1的关键信号通路,FOXO1的靶基因与细胞增殖、细胞凋亡、代谢和迁移等关系密切[6]。研究表明FOXO1因子高表达能够抑制细胞增殖[7]。FOXO1可以通过磷酸化、乙酰化等多种调节方式影响肿瘤的发生、发展。但PI3K和MAPK信号通路在胃间质瘤中对FOXO1转录因子活性调节的机制尚不明确。本实验旨在研究GIST-T1细胞中PI3K和MAPK信号通路对FOXO1转录因子活性与细胞内定位及其下游凋亡相关因子Bcl2、Bax表达的调控机制。
1 材料与方法
1.1 主要材料和细胞培养 PI3K抑制剂LY294002和MAPK抑制剂UO126(Sigma Aldrich公司);DMEM培养基及胎牛血清(Gibco公司);FOXO1抗体、p-FOXO1(s256)抗体、Bcl2抗体、Bax抗体(Cell Signaling公司);兔抗人GAPDH抗体、HRP标记的山羊抗兔IgG抗体(Santa Cruze公司);TRITC标记的山羊抗兔IgG抗体、CCK-8试剂盒(生工公司);DAPI(Roche公司)。
GIST-T1细胞系(百恩维公司),以含10%胎牛血清的DMEM培养基培养于37℃、5%CO2、饱和湿度的细胞培养箱中进行培养,取生长良好,呈对数期细胞进行实验。
1.2 CCK-8检测GIST-T1细胞的增殖抑制率 取GIST-T1单细胞悬液,以每孔4×103个细胞接种于96孔板培养24 h后,血清饥饿24 h,处理组分别加入30μmol/L LY294002(LY294002组),10μmol/L UO126(UO126组),30μmol/L LY294002+10 μmol/L UO126(即:LY+UO组),对照组加入等量DMSO,每组5个重复孔,分别作用0、12、24、36、48h后,加入10μL CCK-8试剂,37℃孵育1 h。轻微溶解震荡,450 nm为吸收波长,酶标仪测量各孔吸光度。抑制率=(对照组OD值×实验组OD值)/对照组OD值×100%。
1.3 Western blot检测FOXO1、p-FOXO1、Bcl2、Bax蛋白的表达 将细胞接种于6孔板,以含10%胎牛血清的DMEM培养基培养24 h后,血清饥饿24 h后,分别加入30μmol/L LY294002(LY294002组),10μmol/L UO126(UO126组),30μmol/L LY294002+10μmol/L UO126(即LY+UO组),对照组加入等体积的DMSO(抑制剂溶解在DMSO中),抑制剂作用24 h后收集细胞。加入RIPA裂解液置于冰上裂解30min,超声波细胞破碎仪破碎细胞3次,4℃,12000 r/min离心10min后取上清,用BCA法进行蛋白定量,调整样品浓度使其相同,蛋白经10%或15% SDS-PAGE电泳后,湿转法转移至PVDF膜上后以5%脱脂奶粉封闭2 h,加入一抗(稀释倍数1∶1000)置于4℃冰箱孵育过夜,经洗涤后,再加入HRP标记的二抗(稀释倍数1∶2000),室温孵育2 h,洗涤后加入ECL显影液显影,自动成像仪采集图像后以GAPDH为内参用Quantity One灰度分析软件进行灰度分析。
1.4 免疫荧光检测FOXO1的细胞定位变化 将GIST-T1细胞以1×104个/孔的密度接种于6孔板中的玻片上,待细胞贴壁后每孔加1mL培养基,置于37℃,5%CO2培养箱内培养24 h后,血清饥饿24 h,处理组分别加入LY294002(浓度30μmol/L)、UOl26(浓度10μmol/L)、LY294002(浓度30μmol/L)和UO126(浓度10μmol/L),对照组加入等量DMSO。处理24 h后取出爬片细胞,洗涤后丙酮固定20 min,0.5%Triton-100进行细胞通透20min,然后用1%BSA封闭30 min,加入一抗(稀释倍数1∶1000)4℃孵育过夜,加入二抗室温避光孵育2 h,洗涤后DAPI染核15 min,甘油封片,荧光显微镜下观察并采集图像。
1.5 统计学方法 采用SPSS 20.0统计分析软件进行统计学分析,实验数据用±s”表示,组间比较用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2种信号通路抑制剂对GIST-T1细胞的增殖抑制作用
CCK-8结果显示,与DMSO组相比,经LY294002(浓度30 μmol/L)和UO126(浓度10μmol/L)分别处理的GIST-T1细胞,随着处理时间的增加,细胞增殖受抑制程度增强(P<0.05)。LY+UO组较LY294002组或UO126组细胞的增殖抑制作用更加显著(P<0.05),药物作用36 h时细胞大量死亡(见图1)。
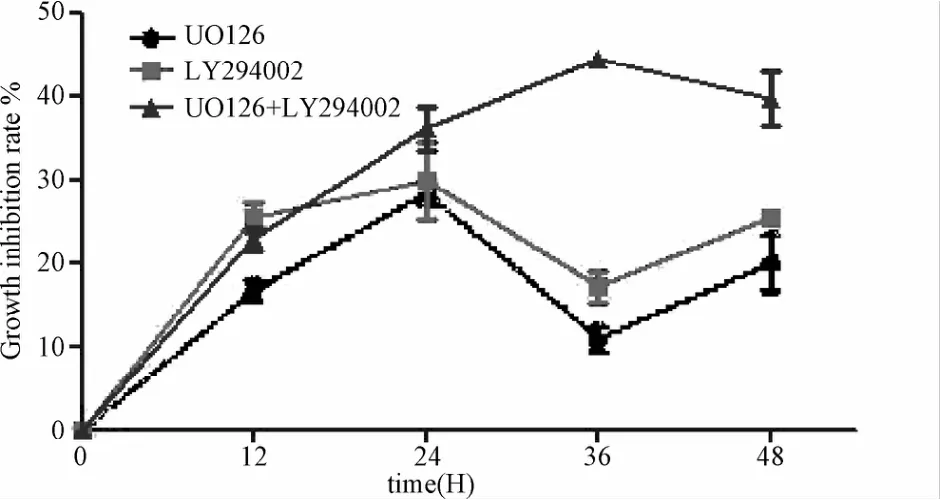
图1 单独或联合应用LY294002、UO126对胃间质瘤细胞增殖的抑制作用Fig.1 Inhibitory effect of LY294002 and UO126 alone or in combination on GIST-T1 cell proliferation
2.2 FOXO1、p-FOXO1、Bcl2、Bax蛋白表达的变化Western blot结果显示,与DMSO组相比,LY294002(浓度30 μmol/L)及UO126(浓度10μmol/L)分别或联合处理GIST-T1细胞24h均可引起细胞中的p-FOXO1、Bcl2蛋白水平下降,Bax蛋白表达水平增加,且LY+UO组p-FOXO1、Bcl2表达下降更为显著,Bax蛋白表达增加更为显著,差异均有统计学意义(P<0.05)。但LY294002组、UO126组、LY+UO组与DMSO组相比,总FOXO1蛋白表达差异无统计学意义(见图2)。
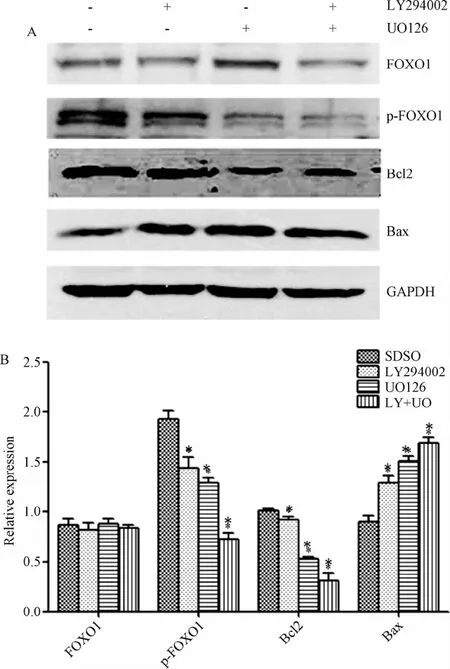
图2 单独或联合应用LY294002、UO126处理GIST-T1细胞后FOXO1、p-FOXO1、Bcl2、Bax的表达*P<0.05,与DMSO组相比Fig.2 Expression of FOXO1,p-FOXO1,Bcl2 and Bax in GIST-T1 cell after treated with LY294002 and UO126 alone or in combination *P<0.05,compared with DMSO group
2.3 FOXO1蛋白在细胞中的定位变化 免疫荧光结果显示,DMSO组FOXO1在细胞核和细胞浆中分布广泛,LY294002(浓度30μmol/L)、UO126(浓度10μmol/L)处理GIST-T1细胞24h后,细胞浆FOXO1明显减少,细胞核FOXO1相应增加,且LY+UO组FOXO1胞核移位较单独应用LY294002、UO126组更加明显(见图3)。
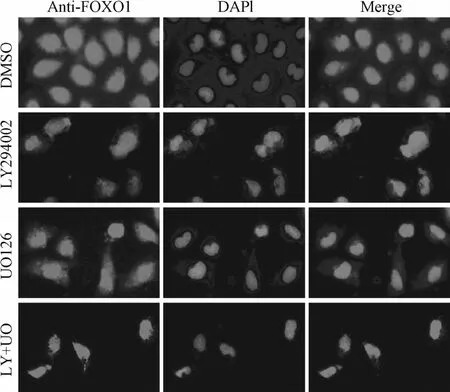
图3 单独或联合应用LY294002、UO126处理GIST-T1细胞后FOXO1定位Fig.3 Localization of FOXO1 in GIST-T1 cell after treated with LY294002 and UO126 alone or in combination
3 讨论
胃间质瘤的发病机制与细胞增殖失控和细胞凋亡抑制关系密切,FOXO1是参与细胞增殖、细胞凋亡调节的重要转录因子。有研究指出FOXO1能够参与调节包括Bcl2、Bax等凋亡相关因子的表达,其活性受到磷酸化、乙酰化等修饰方式调节[8]。而PI3K和MAPK信号通路作为FOXO1转录因子的重要调节通路,直接参与FOXO1的磷酸化修饰过程,进而影响FOXO1的转录活性及其下游靶蛋白的表达[6]。Bcl2家族是最早研究的凋亡相关基因,其中Bcl2具有抗凋亡作用,而Bax具有促凋亡作用,在多种肿瘤中发现两者的比例失调[9]。Bcl2过表达抑制细胞凋亡,而Bax过表达促进细胞凋亡[10]。FOXO1因子可以通过抑制Bcl2蛋白表达,上调Bax蛋白的表达促进细胞的凋亡[11-12]。但其确切机制尚不明确,进一步研究FOXO1对其表达的调节机制具有十分重要的意义。
有研究表明,PI3K和MAPK抑制剂能够抑制FOXO1磷酸化,使FOXO1向细胞核移位,从而调节FOXO1的转录活性,抑制细胞的增殖[13-15]。本研究采用GIST-T1细胞作为研究对象,单独或联合应用PI3K信号通路和MAPK信号通路特异性抑制剂处理细胞之后,CCK-8显示LY294002和UO126组对GIST-T1的增殖具有明显的抑制作用,LY+UO组抑制作用更为显著,且呈时间依赖性。这一结果表明,PI3K信号通路和MAPK信号通路在GIST-T1细胞增殖中起到十分重要的作用。Western blot实验显示,PI3K、MAPK抑制剂单独或联合作用24 h后,总FOXO1蛋白水平与DMSO组相比没有明显的变化,但磷酸化水平明显降低,这说明PI3K信号转导通路和MAPK信号转导通路可以通过改变FOXO1因子的磷酸化水平,影响其转录活性,调控细胞的增殖。本实验结果还提示,随着FOXO1磷酸化水平降低,Bcl2蛋白表达降低,Bax蛋白的表达水平表现出升高的趋势,且联合用药组较单独用药组变化更加显著,进一步证实PI3K信号通路和MAPK信号通路特异性抑制剂能够增强FOXO1因子的转录活性,进而影响其下游凋亡相关因子的表达。此外,免疫荧光实验观察到,GIST-T1细胞给予抑制剂处理后,FOXO1蛋白从细胞浆向细胞核内移位。同时发现联合用药组(LY+UO组)较单独用药组(LY294002组、UO126组)FOXO1蛋白胞核移位更加显著,说明两种抑制剂在调节FOXO1活性方面具有一定的协同效应。
上述实验数据表明,在胃间质瘤细胞中,PI3K和MAPK抑制剂可以通过抑制FOXO1蛋白磷酸化水平,使FOXO1蛋白向细胞核移位,进而抑制FOXO1因子的转录活性,导致Bcl2表达降低,促进Bax的表达,引起细胞周期阻滞、促进细胞凋亡,以及抑制细胞增殖。上述实验证明PI3K信号通路和MAPK信号通路在胃间质瘤发生发展中的部分作用是通过调节FOXO1因子的转录活性,影响其下游凋亡相关因子Bcl2、Bax等的表达实现的。因此,深入研究FOXO1转录因子在胃间质瘤中的作用具有重要意义,为胃间质瘤靶向治疗药物的研发提供了新的方向。
[1] Rubin BP,Heinrich MC,Corless CL.Gastrointestinal stromal tumour[J].Lancet,2007,369(9574):1731-1741.
[2]Miettinen M,Lasota J.Gastrointestinal stromal tumors[J]. Gastroentoenterol Clin N,2013,42(2):399-415.
[3]Zhao Y,Yang J,Liao W,et al.Cytosolic FoxO1 is essential for the induction of autophagy and tumour suppressor activity[J].Nat Cell Biol,2010,12(7):665-675.
[4]Prasad SB,Yadav SS,Das M,et al.Down Regulation of FOXO1 Promotes Cell Proliferation in Cervical Cancer[J].JCancer,2014,5(8):655-662.
[5]Matsumoto M,Pocai A,Rossetti L,et al.Impaired regulation of hepatic glucose production in mice lacking the forkhead transcription factor Foxo1 in liver[J].Cell Metab,2007,6(3):208-216.
[6]Roy SK,Srivastava RK,Shankar S.Inhibition of PI3K/AKT and MAPK/ERK pathways causes activation of FOXO transcription factor,leading to cell cycle arrest and apoptosis in pancreatic cancer[J].J Mol Signal,2010,5(1):1-13.
[7]Ai JZ,Duan JJ,Lv XY,et al.Overexpression of FoxO1 Causes Proliferation of Cultured PancreaticβCells Exposed to Low Nutrition[J].Biochemistry,2010,49(1):218-225.
[8]Moriishi T,Kawai Y,Komori H,et al.Bcl2 Deficiency Activates FoxO through Akt Inactivation and AcceleratesOsteoblast Differentiation[J]. Plos One,2014,9(1):1-11.
[9]Oltval ZN,Milliman CL,Korsmeyer SJ.Bcl-2 heterodimerizes in vivo with a conserved homolog,Bax,that accelerates programed cell death[J].Cell,1993,74(4):609-619.
[10]Teijido O,Dejean L.Upregulation of Bcl2 inhibits apoptosis-driven BAX insertion but favors BAX relocalization inmitochondria[J].FEBS Lett,2010,584(15):3305-3310.
[11] Kim SJ,Winter K,Nian C,et al.Glucose-dependent insulinotropic polypeptide(GIP)stimulation of pancreaticβ-cell survival is dependent upon phosphatidylinositol 3-kinase(PI3K)/protein kinase B(PKB)signaling,inactivation of the forkhead transcription factor Foxo1,and down-regulation of bax expression[J].JBiol Chem,2005,280(23):22297-22307.
[12]Muranen T,Selfors LM,Worster DT,et al.Inhibition of PI3K/mTOR leads to adaptive resistance inmatrix-attached cancer cells[J].Cancer cell,2012,21(2):227-239.
[13]Sykes SM,Lane SW,Bullinger L,etal.AKT/FOXO Signaling enforces reversible differentiation blockade in myeloid leukemias[J].Cell,2011,146(5):697-708.
[14]Asada S,Daitoku H,Matsuzaki H,et al.Mitogen-activated protein kinases,Erk and p38,phosphorylate and regulate Foxo1[J].Cellular signalling,2007,19(3):519-527.
[15]Qiang L,Banks AS,Accili D.Uncoupling of acetylation from phosphorylation regulates FoxO1 function independentof its subcellular localization[J].JBiol Chem,2010,285(35):27396-27401.
(编校:吴茜,王冬梅)
Influence of PI3K and MAPK inhibitors on proliferation and apoptosis of gastrointestinal stromal tumor cell line GISIT-T1
GAO Hua,ZHU Chang-ming,WANG Tao,BAILi-ping,KANG Xiang-peng,YAN FengΔ
(Department of Gastrointestinal Surgery,Zhongshan Hospital to Affiliated Xiamen University,Xiamen 361004,China)
ObjectiveTo research the regulatory mechanism of PI3K and MAPK signaling pathways on FOXO1 transcription factor activity and its inhibit effection on gastrointestinal stromal tumor cell proliferation and apoptosis.MethodsGastrointestinal stromal tumor cell line(GIST-T1)was handled alone or in combination with specific PI3K inhibitor LY294002 and MAPK inhibitor UO126.The proliferation of GIST-T1 CCK-8 was examined by CCK-8,the expression of FOXO1,p-FOXO1 Bcl2 and Bax was detected by western blot.The localization of FOXO1 was detected by Immunofluorescence(IF).ResultsThe growth of GIST-T1 cellswas siginificantly inhibited alone or in combination with LY294002 and UO126,and dependent on duration of the illumination.Western blot showed that the expression of p-FOXO1 and Bcl2 were obvious reduced,but the expression of Bax remarkably increased alone or in combination with LY294002 and UO126 groups(P<0.05).Significant changewith total FOXO1 was not found,and immunofluorescence showed FOXO1 was redistributed to the nucleus.The change of protein express and localization in combined group was more remarkable than single groups.ConclusionPI3K inhibitor LY294002 and MAPK inhibitor UO126 can inhibit GIST-T1 cell proliferation.PI3K and MAPK signaling pathway inhibits the transcription activity by adjusting the FOXO1 phosphorylation levels,FOXO1 inhibits GIST-T1 cell proliferation through down regulate the expression of Bcl2,up regulation of Bax and two kinds of inhibitors have synergistic effect.
FOXO1;PI3K;MAPK;gastrointestinal stromal tumor;Bcl2;Bax
R735.2
A
1005-1678(2014)09-0020-04
中国医学基金会资助项目(314.2212)
高华,男,硕士,研究方向:胃肠道肿瘤基础与临床,E-mail:gaohuadoctor@163.com;通信作者,闫峰,男,医学博士、博士后,副教授、副主任医师、硕士研究生导师,E-mail:yanfeng@xmzsh.com。

