TG2在缺氧条件下骨肉瘤MG-63细胞凋亡中的作用及可能机制
蔡文涛,林明侠,夏虹,陈安民,陈丽娟
(1.南方医科大学研究生学院,广东广州510000;2.海南省人民医院骨科二区,海南海口570311;3.广州军区广州总医院骨科医院,广东广州510000;4.华中科技大学同济医学院附属同济医院骨科,湖北武汉430030;5南京医科大学研究生院,江苏南京210029)
TG2在缺氧条件下骨肉瘤MG-63细胞凋亡中的作用及可能机制
蔡文涛1,2,林明侠2,夏虹3Δ,陈安民4,陈丽娟5
(1.南方医科大学研究生学院,广东广州510000;2.海南省人民医院骨科二区,海南海口570311;3.广州军区广州总医院骨科医院,广东广州510000;4.华中科技大学同济医学院附属同济医院骨科,湖北武汉430030;5南京医科大学研究生院,江苏南京210029)
目的探讨缺氧条件下,TG2在骨肉瘤MG-63细胞凋亡中的作用,以及TG2是否可通过阻止细胞色素C的释放和调节Caspase-3的表达及活性从而抑制细胞凋亡。方法建立骨肉瘤细胞体外缺氧培养模型,分成常氧组、单纯缺氧组、对照siRNA缺氧组、TG2 siRNA缺氧组4组,观察比较各组在培养不同时相(6、12、24、48、72 h)骨肉瘤MG-63细胞中TG2、Caspase-3表达、胞核和胞浆细胞色素C的变化及细胞凋亡率。微量滴定板法检测TG2的活性;半定量RT-PCR方法检测TG2的mRNA水平;Western blot检测TG2、Caspase-3及细胞色素C蛋白表达情况;免疫组化(SP法)检测TG2蛋白在细胞内的分布;流式细胞仪检测细胞凋亡率。结果与常氧组比较,单纯缺氧组及对照siRNA缺氧组的TG2活性、mRNA及蛋白表达水平均显著增强(P<0.01),且随缺氧时间延长明显升高;Caspase-3活性未见明显增加,而Caspase-3及细胞胞浆内细胞色素C蛋白的表达水平和细胞凋亡率轻度增加。与前3组比较,TG2 siRNA缺氧组在通过转染TG2 siRNA抑制TG2的表达时,Caspase-3活性及胞浆内细胞色素C蛋白表达水平均显著增强(P<0.01);细胞凋亡率也显著增加(P<0.01)。结论缺氧条件下,MG-63骨肉瘤细胞胞浆的TG2的活性、TG2 mRNA及蛋白表达水平均明显升高,且随缺氧时间延长而逐渐增强;TG2可以阻止细胞核内细胞色素C向胞浆释放,降低Caspase-3的表达及活性,从而抑制肿瘤细胞凋亡。
骨肉瘤;TG2;细胞色素C;Caspase-3;细胞凋亡
恶性肿瘤的形成是肿瘤细胞无限增殖的结果,增殖过快必然导致肿瘤局部组织缺氧。实验证实,在缺氧条件下可以诱导Ⅱ型谷氨酰胺转氨酶(transgiutaminase 2,TG2)的表达,且TG2参与许多肿瘤细胞的凋亡过程;研究结果显示TG2不仅具有促凋亡作用,而且还有抗凋亡作用,这种矛盾的作用取决于细胞类型、所受刺激类型及TG2在细胞内的定位和酶活性类型[1]。目前认为与骨肉瘤相关的细胞凋亡途径主要有2条:死亡受体配体途径和线粒体途径。其中线粒体途径是通过部分凋亡刺激因子刺激线粒体释放细胞色素C,释放到胞浆中的细胞色素C与凋亡蛋白酶活化因子-1(Apaf-1)结合形成多聚体;并募集Caspase-9前体与其形成凋亡小体,Caspase-9被激活并活化下游的Caspase,从而诱导细胞凋亡[2]。研究表明,在HEK293细胞,TG2通过消耗Bax、降低Caspase-3和Caspase-9、抑制细胞核内的细胞色素C释放进入细胞浆以及在Ca2+增高时线粒体膜的去极化,从而发挥抗凋亡的作用[3]。在缺氧的肿瘤细胞发现同样的机制是通过与Caspase-3交叉结合消耗Caspase-3,从而发挥抗细胞凋亡的作用[4]。这提示在缺氧环境中,TG2可能通过线粒体途径参与调节骨肉瘤细胞凋亡,但是关于TG2在骨肉瘤细胞凋亡过程中的作用及参与调节的机制还未见报道。本研究旨在通过在缺氧环境中培养骨肉瘤细胞MG-63,通过抑制TG2表达后检测细胞胞核、胞浆内细胞色素C蛋白的表达以及Caspase-3活性改变,探讨骨肉瘤MG-63细胞中TG2的抗凋亡作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞株、试剂和主要仪器:骨肉瘤细胞株MG-63由华中科技大学同济医学院附属同济医院骨科实验室惠赠。培养血清及RPMI-1640培养基购自美国Gibcol公司;鼠抗人TG2、Caspase-3单克隆抗体购自美国San Cruze公司;BCIP/NBT和丽春红显色液以及AP碱磷酶标记抗小鼠IgG和过氧化物酶标记羊抗鼠IgG的二抗购自北京中杉生物技术公司。FAC Sort流式细胞仪美国BD公司。
1.1.2 siRNA转染:所有纯化的siRNA分子均由美国赛默飞世尔科技公司设计合成。TG2转染组的siRNA序列是:正链5'-GGGCGAACCACCUGAACAATT-3',反链3'-TTCCCGCUUGGUGGACUUGUU-5'。对照组siRNA序列是:正链5'-UAGCGACUAAACACAUCAAUU-3',反链5'-UUGAUGUGUUUAGUCGCUAUU-3'。按照DharmaFECT 3试剂盒步骤进行转染,再进行下一步实验。
1.2 方法
1.2.1 细胞培养:在5%CO2、37℃培养箱中用含10%小牛血清的RPMI-1640培养液进行细胞培养。采用0.25%的胰酶消化、传代。取二、三代的对数期的细胞进行实验。
1.2.2 缺氧模型与分组:细胞置于CO2缺氧培养箱(5% CO2、95%N2)中、37℃下进行培养,建立缺氧模型。取对数期的细胞以5×105个/孔接种至2mL培养液的6孔板中,待细胞长至90%以上时分为4组:常氧组,细胞在常氧下培养;单纯缺氧组,细胞在缺氧培养箱里培养;对照siRNA缺氧组,转染对照siRNA后在缺氧培养箱里培养;TG2 siRNA缺氧组,转染TG2 siRNA后在缺氧培养箱里培养。于培养不同时段(6、12、24、48、72 h)进行相应处理,各组每个时间段设6个复孔。
1.2.3 半定量RT-PCR检测TG2 mRNA:Trizol法提取总RNA,用分光光度计进行定量和纯度检测。TG2产物序列(5'-3')上游:GGGGTGAGAGAGGAAAGACC,下游:TGCAGTCTAGGGAGCTGGAT,产物大小为167 bp,退火温度为58℃。逆转录合成cDNA后进行PCR反应,琼脂糖电泳鉴定产物,照相后灰度值分析,以目的基因与内参基因的比值作为mRNA的相对含量。
1.2.4 TG的活性检测:采用微量滴定板法来测定细胞内TG活性[5]。收集在常氧或低氧条件下培养0~72 h的细胞,5-生物素酰氨基戊胺(BP)进行标记。4℃、20000 g超速离心10 min。以细胞提取物包被96孔的微量滴定板16 h(4℃),5%牛血清蛋白PBS液室温下封闭1 h。辣根过氧化物酶标记链霉亲和素37℃下孵育45min后,以PBS洗涤,微量滴定板加入邻苯二胺盐酸盐在室温下显色5~15min,然后以1mol/L硫酸终止反应。显色后通过微孔板分光光度计490 nm处测量吸光度(A)来进行定量。
1.2.5 细胞色素C(cytochrome C)水平检测:细胞色素C从线粒体释放的检测参照Waterhouse等描述的方法[6]。分离出的细胞胞浆及线粒体成份分别用Western blot方法进行检测和分析。
1.2.6 Caspase活性测定:细胞中加入细胞裂解液作用30 min(置于冰上),然后4℃下12000 g离心10 min。将细胞蛋白提取物(每孔50μg)加入到微量滴定板孔中,每孔中混以100μL的反应缓冲液。2mM浓度的Ac-DEVD-pNa用于Caspase-3的测定。采用微孔板分光光度计405 nm处测量吸光度来进行Caspase-3的定量。对硝基苯胺用于制作标准曲线来评估确定产物的浓度。
1.2.7 Western blot检测TG2、BAX及cyt C蛋白:用试剂盒分别提取细胞核、细胞浆蛋白,考马斯亮兰蛋白定量。SDSPAGE电泳分离蛋白后,电转移将蛋白转移至硝酸纤维素膜,封闭、漂洗,然后分别加入TG2、Bax及cyt C一抗(1∶1000稀释),37℃、2 h,再加入二抗(1∶5000),37℃、1 h,丽春红显色。照相后行图像分析。
1.2.8 免疫组化(SP法)检测TG2蛋白:制1×1细胞爬片,待细胞长至70%~80%时,加入相应的干预。95%的冷丙酮固定10min,然后按照SP试剂盒说明进行染色。以PBS代替一抗作为阴性对照。结果判定:根据切片染色程度分为强、中、弱、无4个等级;同时随机观察6个高倍镜(10×20)下肿瘤细胞染色阳性的细胞个数,并计算阳性细胞率。
1.2.9 凋亡细胞检测(Sub-G1法):胰酶消化后,取2×105个细胞,70%的乙醇固定,4℃保存过夜。PBS漂洗,溴化丙啶染色后,FAC Sort流式细胞仪检测。
1.3 统计学方法 采用SPSS 13.0统计分析软件进行数据分析,正态计量数据用“±s”表示,多组间比较采用方差分析,组间两两比较采用q检验,以P<0.01为差异有统计学意义。
2 结果
2.1 各组TG2的活性比较 在常氧组未检测到原位TG2活性。单纯缺氧组与对照siRNA缺氧组TG2的活性较常氧组表达增强(P<0.01),且每个时间点TG2活性之间比较差异有统计学意义;与单纯缺氧组及对照siRNA缺氧组比较,TG2 siRNA缺氧组的TG2的活性明显减弱(P<0.01,见表1)。

表1 各组TG2活性测定结果Tab.1 The activity of TG2 in each group
2.2 各组TG2 mRNA表达水平比较 TG2 mRNA在常氧组仅见低水平的表达;而在单纯缺氧组和对照siRNA缺氧组TG2 mRNA较常氧组增高,随缺氧时间延长,TG2 mRNA水平逐渐提高,并且各个时间段之间比较差异有统计学意义(P<0.01);与单纯缺氧组和对照siRNA缺氧组比较,各个时间段TG2 siRNA缺氧组TG2 mRNA水平均显著降低(P<0.01,见图1)。

图1 各组TG2 mRNA表达比较*P<0.01,与常氧组比较;#P<0.01,与TG2 siRNA缺氧组比较Fig.1 Comparison of TG2 mRNA expression in each group*P<0.01,compared with oxygen group;#P<0.01,compared with TG2 siRNA hypoxia group
2.3 各组TG2蛋白表达水平比较 Western blot结果显示:常氧组未见明显TG2蛋白表达;单纯缺氧组和对照siRNA缺氧组TG2蛋白表达显著高于常氧组、TG2 siRNA缺氧组(P<0.01,见图2),且表达强度随缺氧时间延长明显递增。
免疫组织化学结果显示:MG-63骨肉瘤细胞的TG2蛋白定位于胞浆。常氧组,TG2蛋白表达呈阴性。单纯缺氧组和对照
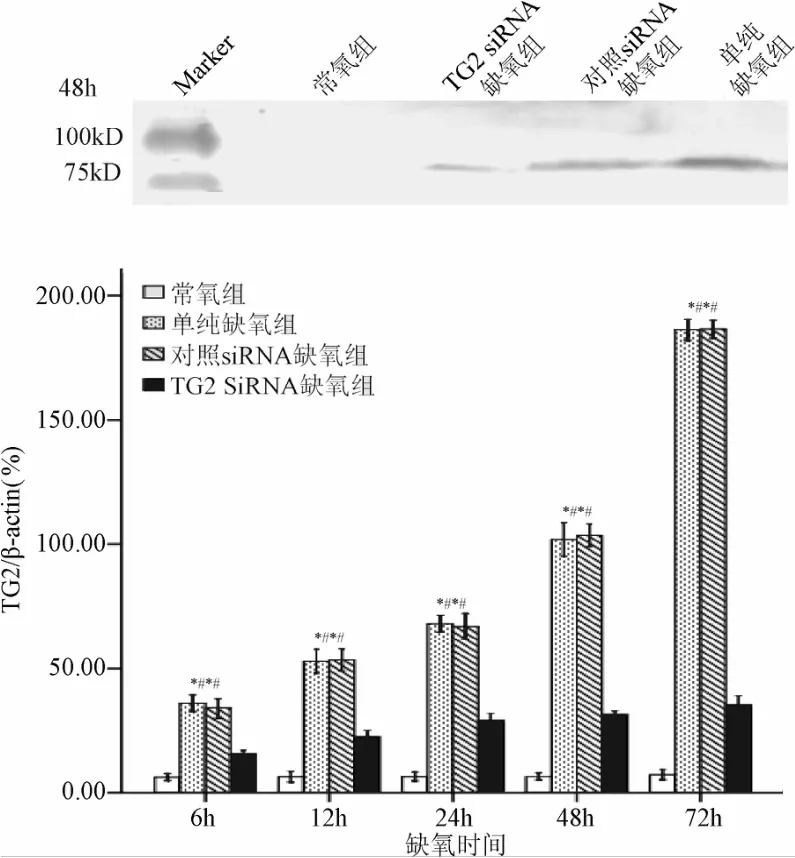
图2 Western Blot检测各组TG2(80KD)蛋白表达*P<0.01,与常氧组比较;#P<0.01,与TG2 siRNA缺氧组比较Fig.2 TG2 protein expression observed by Western Blot*P<0.01,compared with oxygen group;#P<0.01,compared with TG2 siRNA hypoxia group
siRNA缺氧组TG2阳性细胞率较常氧组显著提高(P<0.01),并且染色强度随缺氧时间延长明显增强;而与单纯缺氧组和对照siRNA缺氧组比较,TG2 siRNA缺氧组的TG2阳性细胞率显著减少(P<0.01,见表2、图3)。
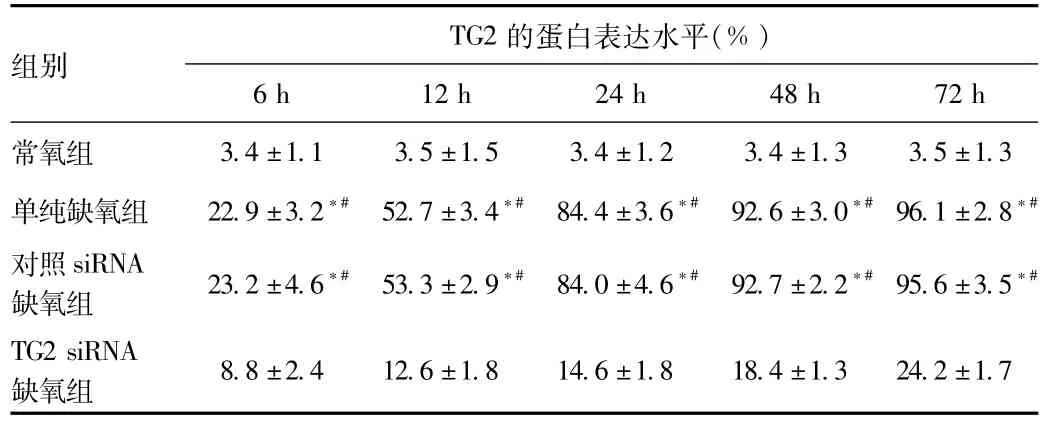
表2 各组TG2蛋白表达水平比较Tab.2 Comparison of TG2 protein levels in each group

图3 免疫组化显示各组TG2蛋白表达(48 h,SP,×200)Fig.3 TG2 protein expression observed by immunohistochemical staining(48 h,SP,×200)
2.4 缺氧条件下抑制TG2的表达对细胞色素C释放的影响 Western blot结果显示:在常氧组,细胞胞浆内仅有少量的细胞色素C;在单纯缺氧组及对照siRNA缺氧组,细胞胞浆及线粒体内的细胞色素C含量仅受轻微影响;而在TG2 siRNA缺氧组,细胞胞浆内的细胞色素C含量明显增加,而线粒体内的细胞色素C明显减少(P<0.01)。提示TG2抑制缺氧条件下骨肉瘤MG-63细胞色素C由线粒体向细胞胞浆内释放(见图4)。

图4 Western blot检测各组胞浆及胞核内细胞色素C蛋白(12kD)表达*P<0.01,与常氧组比较;#P<0.01,与TG2 siRNA缺氧组比较Fig.4 Protein expression of cytochrome C in cytosol and cyteblast at different hypoxia culture phase detected by Western blot*P<0.01,compared with oxygen group;#P<0.01,compared with TG2 siRNA hypoxia group
2.5 缺氧条件下抑制TG2表达对细胞凋亡率的影响 流式细胞仪检测结果显示:与常氧组比较,单纯缺氧组及对照siRNA缺氧组,细胞凋亡率轻度增加;而在TG2 siRNA缺氧组,细胞凋亡率较前3组均显著提高(P<0.01,见表3)。
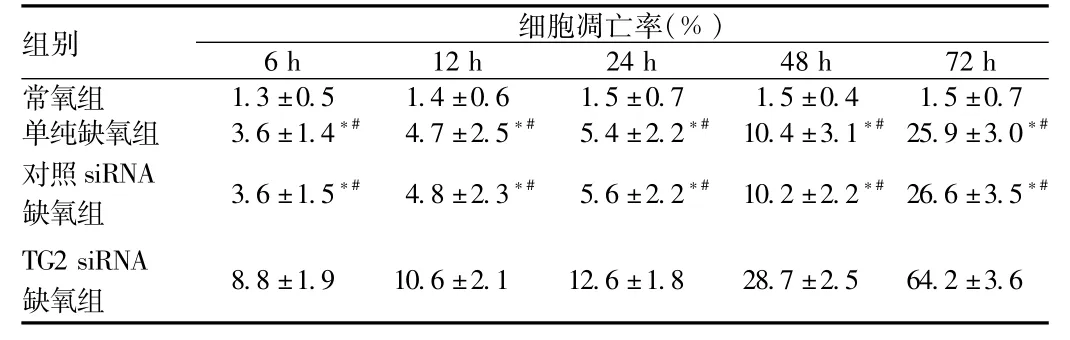
表3 流式细胞仪检测细胞凋亡率Tab.3 Apoptosis rate analyzed by flow cytometry
2.6 缺氧条件下抑制TG2表达作用下Caspase-3活性及蛋白表达的变化 与常氧组比较,单纯缺氧组与对照siRNA缺氧组的Caspase-3活性未见明显增强;而在TG2 siRNA缺氧组,Caspase-3活性随着缺氧时间延长逐渐增强(P<0.01,见表4)。Western blot结果显示在单纯缺氧组,可见弱的Caspase-3蛋白条带;而在TG2 siRNA缺氧组,Caspase-3蛋白条带明显增强(P<0.01),并且表达强度随缺氧时间延长明显递增(P<0.01,见图5)。
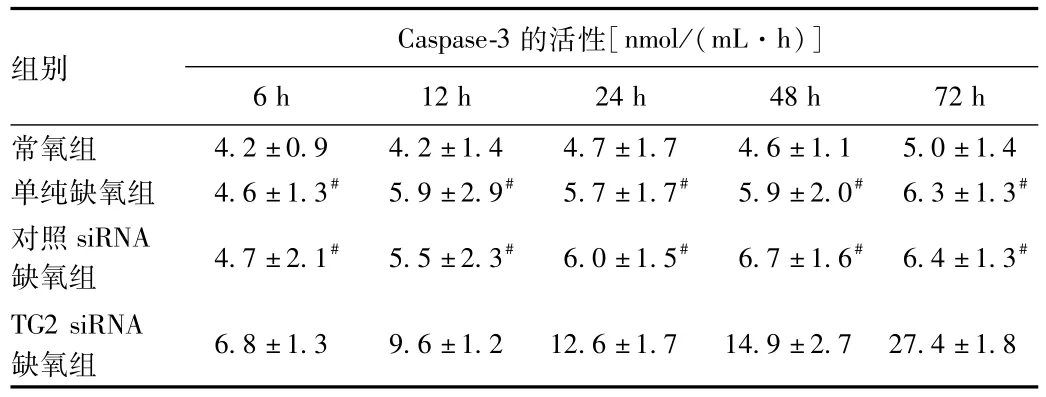
表4 各组细胞内的Caspase-3的活性比较Tab.4 Comparison of Caspase-3 activity in each group
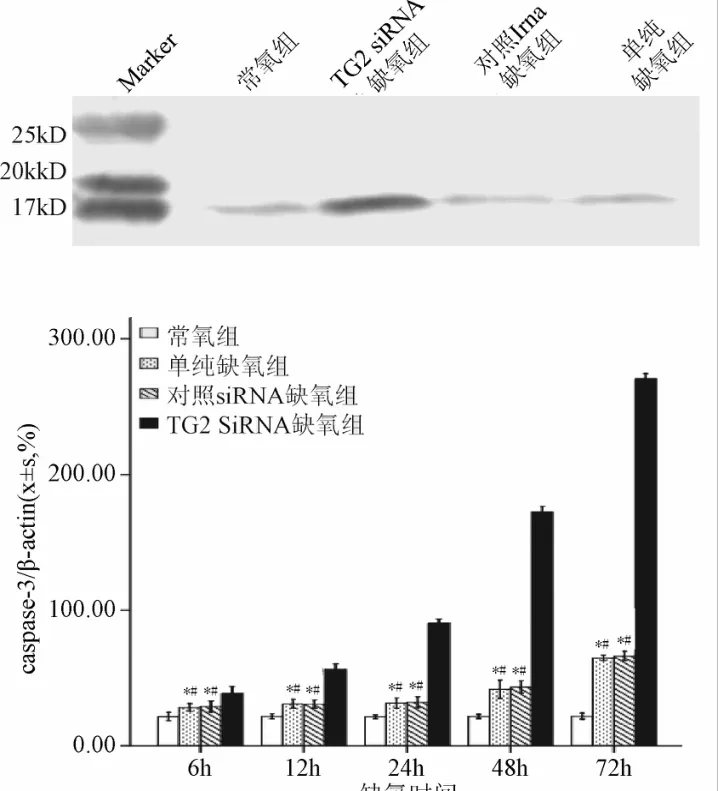
图5 Western Blot检测各组caspase-3蛋白表达*P<0.01,与常氧组比较;#P<0.01,与TG2 siRNA缺氧组比较Fig.5 Protein expression of caspase-3 observed by Western blot analysis*P<0.01,compared with oxygen group;#P<0.01,compared with TG2 siRNA hypoxia group
3 讨论
恶性肿瘤的发生和发展是细胞无限增殖所致,增殖过快必然导致肿瘤局部组织缺氧和供能与耗能之间的不平衡。在缺氧条件下,细胞内的Ca2+浓度会突然升高,引起线粒体肿胀,并激活钙依赖相关酶的活性,导致细胞凋亡[7]。但研究发现缺氧时肿瘤细胞一系列抑制细胞凋亡的机制在肿瘤的发生及发展中起重要的作用。
TG2也称作组织型谷氨酰胺转氨酶(tissue transgiutaminase,tTG),基因定位于20号染色体的q12带上,全长约32.5 kb。它的蛋白质分子量为80 kD,有687个氨基酸残基,每个单体含有4个独特的结构域。TG2是谷氨酰胺转氨酶家族中的一个独特成员,存在于细胞的多个部位,包括胞浆、胞核、线粒体、细胞膜表面以及细胞外基质。它不仅具有Ca2+依赖的催化蛋白交联的活性及GTP依赖的G蛋白的功能,还具有蛋白二硫键异构酶活性和蛋白激酶的功能[8]。研究证实TG2参与许多细胞的凋亡的调控过程。
但关于TG2在细胞凋亡中的作用存在争议[9]。许多研究结果都支持TG2的促凋亡作用,在缺氧氧化作用下,高水平的ROS触发Ca2+进入细胞内,导致TG2酶学活性增强,从而引起细胞凋亡[10]。然而最近的研究发现TG2表达和凋亡并不是完全一致的。有几种快速分裂的肿瘤细胞虽表达了高水平的TG2,却没进入凋亡。研究显示,当内皮细胞内的TG2消耗尽后导致细胞周期停止而发生细胞凋亡[11]。最新研究证实,诱导TG2的表达可以促进肾癌细胞的存活[12]。细胞核内突变的TG2(R580A)可以抵消其胞浆内的TG2的促凋亡作用[13]。这些研究结果提示TG2不仅具有促凋亡作用,而且还有抗凋亡作用,这种似乎矛盾的作用取决于细胞类型、所受刺激类型及TG2在细胞内的定位和构型[14]。
为了探讨缺氧对MG-63骨肉瘤细胞TG2表达的影响,本研究将MG-63骨肉瘤细胞放在缺氧环境下进行体外培养。免疫组化结果显示TG2蛋白表达主要定位于细胞浆内。在缺氧条件下,TG2的活性增强,而且TG2 mRNA水平及蛋白水平表达都明显增强,并且随着缺氧时间的延长逐渐增高。免疫组化提示蛋白表达主要定位于细胞浆内。说明缺氧能够诱导MG-63骨肉瘤细胞TG2的表达,而且主要是增强细胞浆内TG2的活性。通常情况下,细胞浆内TG2通过其转氨基作用来促进凋亡,但本研究结果却相反。缺氧时,TG2表达增强,但其细胞凋亡率增加不明显;通过转染TG2 siRNA抑制TG2的表达时,其细胞凋亡率增加显著。这表明缺氧诱导MG-63骨肉瘤细胞表达的TG2具有抗凋亡的作用。
为了进一步探讨在缺氧条件下骨肉瘤MG63细胞的TG2发挥抗凋亡的作用途径,探讨了TG2与细胞色素C以及其调节因子之间的关系。结果提示单纯缺氧条件下,胞浆内细胞色素C升高不明显,但是当用siRNA抑制TG2的表达时,细胞核内的细胞色素C减少,而胞浆内细胞色素C显著升高。说明TG2抑制缺氧条件下骨肉瘤MG-63细胞色素C由线粒体向细胞胞浆内释放,从而发挥抗凋亡的作用。
Caspases-3是Caspases家族中重要的效应因子,正常情况下以酶原(32KD)的形式存在于胞浆中,没有活性。在凋亡的早期阶段,它被激活;活化的Caspase-3由2个大亚基(17kD)和2个小亚基(12kD)组成,裂解相应的胞浆、胞核底物,最终导致细胞凋亡。最新研究证实,TG2可以与细胞核、细胞质及线粒体内的一些蛋白形成非共价复合物。在缺氧条件下,TG2被激活后在胞浆内形成的交联聚合体可以与Caspase-3形成不溶性复合物,从而抑制了Caspase-3的活性,抵抗缺氧诱导的凋亡[4]。这种阻止细胞凋亡的作用是不依赖于TG2转化酶作用,与TG2定位于细胞浆及其构象有关。本研究结果显示,单纯缺氧组未见Caspase-3活性表达增强,但在siRNA转染缺氧组当通过转染TG2 siRNA抑制TG2的表达时,Caspase-3活性及蛋白表达明显增强,细胞凋亡率明显增加。说明在缺氧情况下高表达的TG2可以通过抑制Caspase-3的活性从而发挥抗凋亡的作用。
综上所述,缺氧环境下,MG-63骨肉瘤细胞胞浆的TG2的活性明显增强,并且随缺氧时间延长TG2 mRNA及蛋白表达水平逐渐增强;TG2可以阻止细胞核内细胞色素C向胞浆释放,并且在胞浆内形成的交联聚合体可以与Caspase-3形成不溶性复合物,降低Caspase-3的表达及活性,从而发挥抗凋亡的作用,这可能是肿瘤的一个保护性的逃逸机制。而通过转染TG2的siRNA抑制TG2表达,可提高Caspase-3的活性及蛋白表达水平,导致细胞凋亡的增加,这为研究骨肉瘤的治疗策略寻找到一个新的切入点。
[1] Nurminskaya MV,Belkin AM.Cellular functions of tissue transglutaminase[J].2012,294:1-97.
[2]Zhang YQ,Xiao CX,Lin BY,et al.Silencing of Pokemon enhances caspase-dependent apoptosis via fas-and mitochondria-mediated pathways in hepatocellular carcinoma cells[J].PLoS One,2013,8(7):e68981.
[3]Cho SY,Lee JH,Bae HD,et al.Transglutaminase 2 inhibits apoptosis induced by calcium-overload through down-regulation of Bax[J].Exp Mol Med.2010,42(9):639-650.
[4]Jang GY,Jeon JH,Cho SY,et al.Transglutaminase 2 suppresses apoptosis bymodulating caspase 3 and NF-kappaB activity in hypoxic tumor cells[J].Oncogene,2010,29(3):356-367.
[5]Shin DM,Jeon JH,Kim CW,et al.Cell type-specific activation of intracellular transglutaminase 2 by oxidative stress or ultraviolet irradiation:implications of transglutaminase 2 in age-related cataractogenesis[J].JBiol Chem,2004,279(15):15032-15039.
[6]Waterhouse NJ,Goldstein JC,Kluck RM,et al.The(Holey)study of mitochondria in apoptosis[J].Methods Cell Biol,2001,66:365-391.
[7]Jeong SY,Seol DW.The role of mitochondria in apoptosis[J].BMB Rep,2008,41(1):11-22.
[8]Facchiano A,Facchiano F.Transglutaminases and their substrates in biology and human diseases:50 years of growing[J].Amino Acids,2009,36(4):599-614.
[9]Fésüs L,Szondy Z.Transglutaminase 2 in the balance of cell death and survival[J].FEBS Lett,2005,579(15):3297-3302.
[10]Caccamo D,Curro M,Ferlazzo N,et al.Monitoring of transglutaminase 2 under differentoxidative stress conditions[J].Amino Acids,2011,42(2-3):1037-1043.
[11]Nadalutti C,Viiri KM,Kaukinen K,et al.Extracellular transglutaminase 2 has a role in cell adhesion,whereas intracellular transglutaminase 2 is involved in regulation of endothelial cell proliferation and apoptosis[J].Cell Prolif,2011,44(1):49-58.
[12]Ku BM,Kim DS,Kim KH,etal.Transglutaminase2 inhibition found to induce p53 mediated apoptosis in renal cell carcinoma[J].FASEB J,2013,27(9):3487-3495.
[13]Colak G,Keillor JW,Johnson GV.Cytosolic guanine nucleotide binding deficient form of transglutaminase 2(R580A)potentiates cell death in oxygen glucose deprivation[J].PLoSOne,2011,6(1):e16665.
[14]Gundemir S,Johnson GV.Intracellular localization and conformational state of transglutaminase 2:implications for cell death[J].Plos One,2009,4(7):e6123.
(编校:吴茜)
Effect of hypoxia on the expression of TG2 and apoptosis of osteosarcoma cell line MG-63
CAIWen-tao1,2,LIN Ming-xia2,XIA Hong3Δ,CHEN An-min4,CHEN Li-juan5
(1.Graduate School,Southern Medical University,Guangzhou 510000,China;2.Department of Orthopaedics,Hainan Provincial People's Hospital,Haikou 570311,China;3.Department of Orthopedics,Guangzhou General Hospital of Guanzhou Military region,
Guangdong 510000,China;4.Department of Orthopaedic,Tongji Hospital of TongjiMedical College,Huazhong University of Science and Technology,Wuhan 430030,China;5.Graduate School,Nanjing Medical University,Nanjing 210029,China)
ObjectiveTo investigate the effect of hypoxia on the expression of TG2 and the relationship between TG2 and apoptosis of osteosarcoma cell line MG-63 under hypoxia environment.MethodsThe hypoxia culturemodelwas established by a hypoxia incubator and divided into four groups.The expression of TG2,cytochrome C,caspase-3 and the rate of apoptosiswere observed at differenthypoxia culture phases.Microtiter plate assay was performed tomonitor intracellular TG2 activity.Caspase-3 activitiesweremeasured using chromogenic substrates and determined bymeasuring the absorbance at405 nm according to the protocol.The reverse transcriotion PCR was used to detect themRNA expression of TG2.The protein level of TG2,cytochrome C and Caspase-3 was observed by Western blot analysis.The rate of apoptosiswere analyzed using flow cytometry.ResultsCompared with the oxygen group,the activity,themRNA level and protein expression of TG2 were increased remarkably with correspondence to the hypoxia time in the pure hypoxia group and the control siRNA hypoxia group.But the activity and protein expression of Caspase-3 didn't change significantly.Similarly,the protein level of cytochrome C in cytosol and the apoptosis rate didn't increasemarkedly.In TG2 siRNA hypoxia group,the Caspase-3 activity and the protein expression of Caspase-3 were all increased significantly(P<0.01).Besides,the protein expression of cytochrome C in cytosol and the apoptosis rate rose up significantly(P<0.01).ConclusionThe activity,the mRNA level and protein expression of TG2 increases remarkably with correspondence to the hypoxia time in the hypoxia condition.Overexpression of TG2 can inhibite the hypoxia-induced apoptosis through preventing cytochrome C releasing into the cytosol and suppressing caspase-3 activities.
book=2,ebook=7
osteosarcoma;transgiutaminase 2;cytochrome C;Caspase-3;apoptosis
R783.1
A
1005-1678(2014)09-0001-05
国家自然科学基金(81070437)
蔡文涛,男,博士,研究方向:脊柱外科,E-mail:hpph2472@yeah.net;夏虹,通信作者,男,博士生导师,研究方向:脊柱外科,E-mail:gzxiahong2@126.com。

