小鼠大脑缺氧后P53在神经细胞中的表达变化及意义
刘 刚 李 畅 曹雅东 任 强 陈为龙 朱海超 卢英强
(吉林省公安厅,吉林 长春 130000)
老年患者慢性脑缺氧与神经细胞变性疾病密切相关。P53作为转录因子,调控一系列基因的表达,其靶基因表达产物在细胞老化、细胞周期调控及凋亡的发生中发挥重要作用〔1,2〕。本研究小鼠脑缺氧后不同时间段P53表达变化。
1 材料与方法
1.1动物分组及模型建立 雄性昆明系小鼠50只,随机分为正常对照及脑缺氧组。脑缺氧组分别于术后2、8、24 h、1、3、6、9、12、16 d处死,共10组。手术结扎右侧颈总动脉,10%水合氯醛(0.35 g/kg体重)腹腔内注射麻醉,剪去颈部皮毛,消毒皮肤后沿中线切开皮肤,暴露右侧颈总动脉后,结扎后缝合皮肤,置鼠笼喂养。正常对照组仅切开颈部皮肤,但并不结扎动脉。
1.2方法
1.2.1HE染色 脑组织标本用10%甲醛溶液固定48 h,石蜡包埋,5 μm厚连续切片,常规HE染色。
1.2.2免疫组化染色检测P53 试剂盒购自武汉博士德生物工程有限公司,按试剂盒说明书操作,用已知阳性的切片做阳性对照,PBS代替一抗为阴性对照。采用CMIAS多功能真彩色病理图像分析系统测量神经细胞内平均灰度值。
1.3统计学分析 采用SPSS13.0软件行单因素方差分析和t检验。
2 结 果
2.1HE染色 脑缺氧2 h后,脑实质内神经细胞尼氏体溶解消失,损伤灶周围神经细胞尼氏体溶解消失,并伴有周围间隙增宽,呈脑水肿改变。缺氧24 h后,脑实质神经细胞出现变性坏死。缺氧120 h后,可见有小胶质细胞增生。
2.2颅脑损伤后随时间变化P53表达 在正常颈动脉未结扎脑组织中,P53表达量较少;P53在颅脑损伤8 h后表达增高,表现为平均灰度值增高,差异有统计学意义(P<0.05),且随缺氧时间延长后持续增高,缺氧3 d后达峰值。见图1,图2。
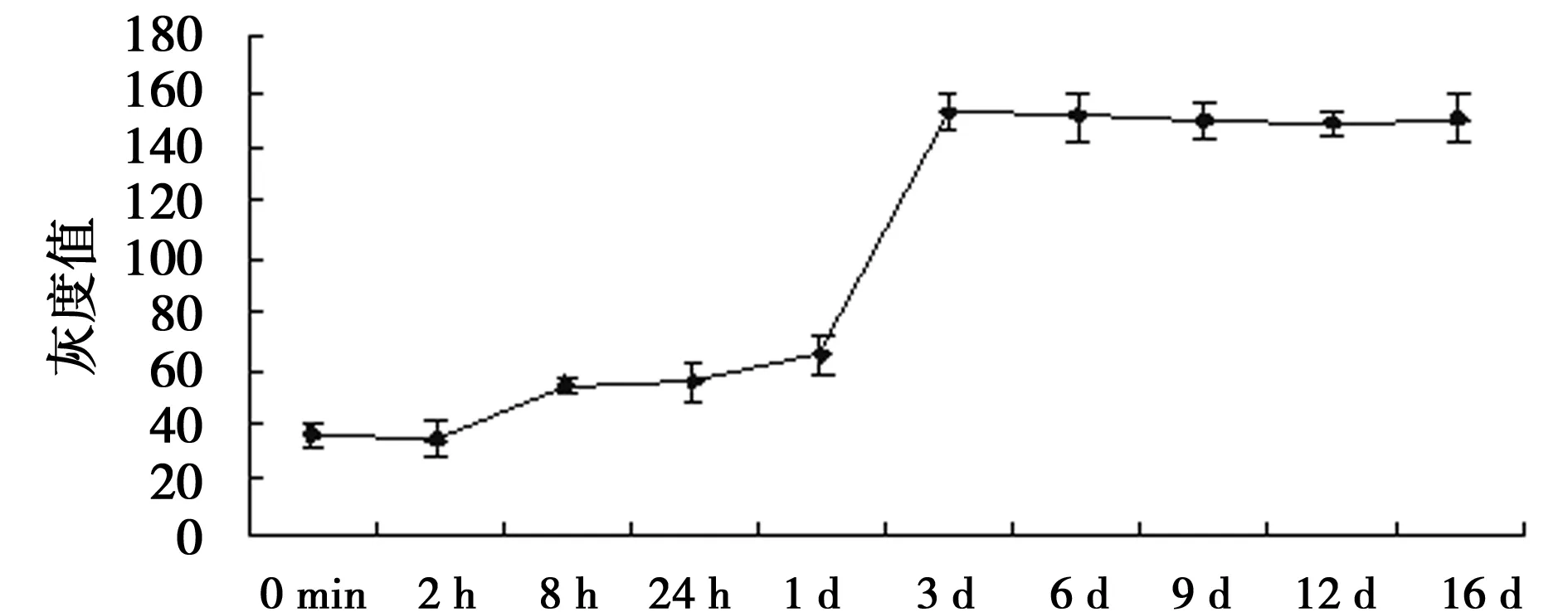
图1 小鼠大脑缺氧后P53随时间表达变化

图2 小鼠大脑缺氧后P53免疫组织化学表达变化
3 讨 论
P53是早期发现的最重要的抑癌基因之一,50%以上的恶性肿瘤P53基因会发生突变。Rubbi采用UV照射诱发DNA损伤而激活P53,他们发现P53激活后会导致细胞周期阻滞。其分子机制为当双链DNA损伤后,会抑制RNA聚合酶(Pol)Ⅰ的组装,进而导致RPL5和RPL11从核仁中释放出来。MDM2是P53特异性E3泛素化连接酶,可特异性介导P53泛素化降解,而从核仁中释放出的RPL5和RPL11可结合MDM2,拮抗其对P53的降解,从而稳定P53导致细胞内P53表达水平增加,并最终诱导细胞凋亡〔3〕。P53作为重要的凋亡参与因子,其在发育过程及组织修复重构方面的重要作用也日益受到学者们的重视〔4〕。
脑组织缺氧后,可引起一系列严重的临床症状,脑组织的长期慢性缺氧与老年患者神经退行性变的发生密切相关,而凋亡过程无疑在神经细胞退行性变的发生及发展过程中发挥着重要的作用。P53作为重要的凋亡调节因子,其在脑组织缺氧后的原位表达变化研究却鲜有报道。本研究发现,在正常脑组织中,P53表达量未见表达,说明正常情况下P53表达量较少,随缺氧时间延长后持续增高。意味着P53可作为有效的免疫组织化学指标,在脑缺氧的临床诊断方面具有重要意义。
4 参考文献
1Lujambio A,Akkari L,Simon J,etal.Non-cell-autonomous tumor suppression by p53〔J〕.Cell,2013;153(3):449-60.
2Munoz-Espin D,Canamero M,Maraver A,etal.Programmed cell senescence during mammalian embryonic development〔J〕.Cell,2013;155:1104-18.
3Rubbi CP,Milner J.Disruption of the nucleolus mediates stabilization of p53 in response to DNA damage and other stresses〔J〕.EMBO J,2003;22:6068-77.
4Tollini LA,Jin A,Park J,etal.Regulation of p53 by Mdm2 E3 ligase function is dispensable in embryogenesis and development,but essential in response to DNA damage〔J〕.Cancer Cell,2014;26(3):235-47.

