脑源性神经营养因子基因功能性多态rs6265与散发性阿尔茨海默病的相关性
李家鑫 韦斌垣 欧俐羽 李 剑
(广西医科大学第一附属医院神经内科,广西 南宁 530021)
脑源性神经营养因子(BDNF)基因与阿尔茨海默病(AD)的关系,已经引起人们的重视。BDNF能够支持前脑、海马及皮质胆碱能神经元的生存、分化和修复,并且在突触可塑性中发挥了重要的作用,因此与学习和记忆有着密切的联系。已有研究表明BDNF参与了AD的发病〔1〕,并有可能成为治疗AD的手段〔2〕。本文将从BDNF基因的功能性多态(rs6265)层面来探讨BDNF与散发性阿尔茨海默病(SAD)的关系。
1 对象与方法
1.1研究对象 选取自2010年1月至2011年3月在广西医科大学第一附属医院神经内科和江滨医院神经内科住院的SAD患者58例,其中男性40例,女18例,年龄57~76〔平均(66.66±11.82)〕岁,病程1~16年,平均发病年龄(63.03±7.24)岁,平均病程(6.62±4.565) 年。所有患者均进行了临床检查、简易智能状态检查(MMSE)和Hachinski缺血评分,并经过至少二名神经科专家诊断,均符合NINCDS-ADRDA“很可能AD”诊断标准〔3〕。排除外患严重躯体疾病、有抑郁症状和痴呆家族史者。对照组为同期52例在我院行体检的健康老年人,其中男33例,女19例,年龄56~74〔平均(63.75±9.14)〕岁。两组在年龄(U=0.953 2,P=0.339 8)和性别构成上(χ2=0.372 1,P=0.541 2)均无差异。均签署知情同意书。
1.2主要材料 MJ PTC-220 PCR仪;紫外光凝胶电泳成像分析系统;血液基因提取试剂盒(北京天根生化科技有限公司),2×TaqPCRMasterMix (北京康为世纪生物科技有限公司),琼脂糖(北京天根生化科技有限公司),Gene finder核酸染料(Takara公司),5×TBE〔生工生物工程(上海)有限公司〕,DNA marker(600 bp)(广州东盛生物科技有限公司),Eco72Ⅰ快速酶(Thermo公司);人脑源性神经营养因子(BDNF)快速检测试剂盒(CUSABIO,CSB-E04501h),Bio-RAD Imark酶标仪。
1.3血样采集 所有患者均空腹采取静脉血5 ml,将其中的2 ml沿管壁缓慢注入含肝素抗凝管中,立即于-70 ℃冷冻存放以行基因检测;余下的缓慢注入非抗凝管中,室温放置60 min后以1 000 r/min离心20 min,取血清分装于EP管中,置-70 ℃低温冰箱保存,以检测BDNF。
1.4基因检测 使用血液DNA提取试剂盒(离心柱型)提取血液DNA。BDNF基因G196A上游引物:5′-AAGAAGCAAACATCCGAGGACA-3′,下游引物:5′-GGGATTGCACTTGGTCTCGTAG-3′,引物由深圳华大基因科技有限公司合成。然后应用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术扩增目的DNA片段并进行基因分型。PCR扩增循环条件:94℃起始5 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,循环反应35次,72 ℃延伸5 min。PCR扩增产物经Eco72Ⅰ快速酶切,酶切产物即刻进行2.0%琼脂糖凝胶电泳,在紫外光凝胶电泳成像分析系统上进行扫描、拍照,并进行图像分析,对BDNF G196A进行基因分型。
1.5BDNF的检测 采用人BDNF ELISA试剂盒测定,按说明书操作,最后用酶标仪读数,取单波长450 nm,用空白孔调零,然后测定各孔光密度(OD值)。用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数2,即为样品的实际浓度。
1.6统计学分析 用SPSS13.0统计软件,样本均数比较采用t检验,构成比比较采用χ2检验;基因型频率和基因频率采用基因计数法,吻合度检验确定是否符合Hardy-Weinberg平衡。
2 结 果
2.1BDNF多态性位点分析 BDNF G196A位点PCR产物的酶切电泳结果 PCR产物长度为500 bp,当等位基因为G时,PCR产物经Eco72Ⅰ酶切后形成131和369 bp片段,在凝胶电泳图上显示2条电泳带;当等位基因为A时PCR产物不能被Eco72Ⅰ酶切,片段长度为500 bp,在凝胶电泳图上显示1条电泳带;当等位基因为杂合型A/G时,在凝胶电泳图上显示3条电泳带,见图1。
2.2BDNF Val 66 Met多态性检测
2.2.1Hardy-Weinberg 吻合度检验 两组3种基因型观察值与期望值检测符合Hardy-Weinberg平衡定律(SAD组χ2=0.064,P=0.800;对照组χ2=0.076,P=0.783),表明其基因型频率分布已达到遗传平衡,具有群体代表性。

M:Marker;2,3,5:AA基因型;4,6,7:AG基因型;1,8:GG基因型
2.2.2BDNF G196/A多态性与SAD的相关性分析 两组中AA、AG及GG3种基因型频率 (χ2=0.012 9,P=0.994)和A、G等位基因频率的差异无统计学意义(χ2=0.012 8,P=0.910)。按性别分层分析,两组男性基因型频率(χ2=0.302,P=0.860)和等位基因频率(χ2=0.117,P=0.732)差异无统计学意义;女性的基因型频率(χ2=0.780,P=0.677)和等位基因频率(χ2=0.511,P=0.475)差异无统计学意义。<65岁的人群中,等位基因(χ2=6.059 5,P=0.013)及基因型分布(χ2=6.082 6,P=0.047 8)有显著差异,而≥65的人群中则无差异。
2.3血清BDNF的表达 SAD组血清BDNF水平(17.21±3.15)ng/ml明显比对照组(21.85±5.42)ng/ml低(U=5.408 5,P<0.001);在SAD组中,AA基因型的患者血清BDNF水平(14.32±4.21)ng/ml均比AG基因型患者(17.05±3.53)ng/ml和GG基因型患者(19.42±3.36)ng/ml低(F=7.254 5,P=0.001 6),提示了基因的表达影响了BDNF的表达。
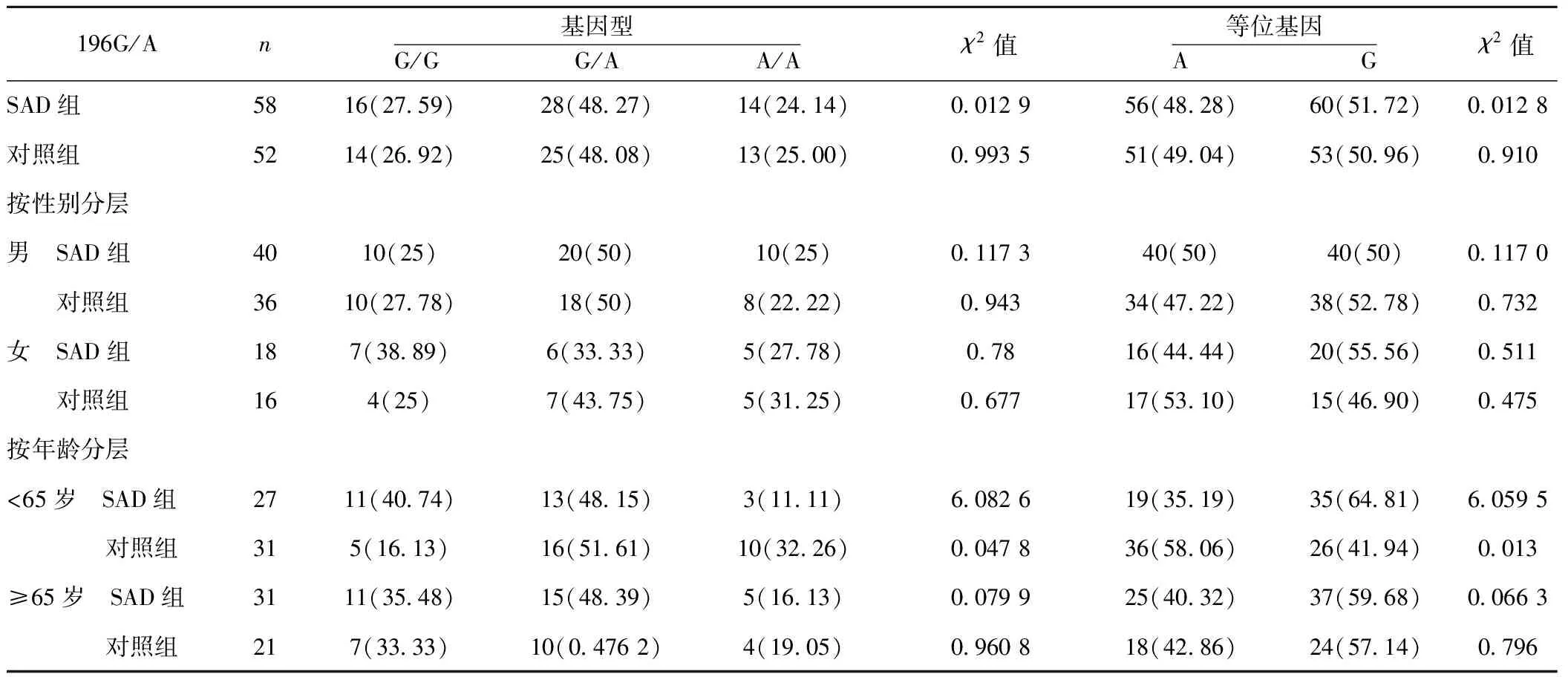
表1 BDNF基因的功能性多态(rs6265)等位基因及基因型在SAD和正常者中的分布比较〔n(%)〕
3 讨 论
BDNF作为神经营养因子中的一个重要成员,在中枢神经系统(CNS) 广泛地表达,但主要存在于海马、皮质和纹状体中,可保护神经元对抗神经毒性物质、局部缺血和氧化等各种损伤,防止内源或外源因素导致的细胞凋亡。在体内,BDNF与神经元存活、增殖、轴突生长、突触可塑性以及学习和记忆等有密切的关系〔4,5〕。如果海马内BDNF基因的缺失,可导致大鼠记忆和空间知觉能力的损害〔6〕。和正常海马相比,SAD 患者海马、颞叶皮层、内皮层及齿状回中BDNF表达明显降低〔7,8〕。本研究说明了SAD患者中,AD与 BDNF rs6265多态性相关,提示了BDNF表达水平及随后的蛋白水平的改变可能参与了SAD 的早期病理过程。
遗传多态性广泛存在于基因组中,对于研究个体的表型差异、不同群体和个体对疾病的易感性、对各种药物的耐受性以及对环境因素的反应性等具有重要的意义。单核苷酸多态性是人类基因组中最常见的一种遗传多态,因此被广泛应用于疾病易感基因的定位及连锁和关联分析。rs6265是位于BDNF基因的编码外显子,是目前已知的BDNF基因的功能性多态,其G/A多态导致第66位氨基酸密码子的改变,使编码氨基酸发生Val-Met(撷氨酸-蛋氨酸)的转换,并影响BDNF的分泌〔9〕。有报道,大鼠大脑皮层及海马和血清BDNF水平有相似的变化,且血清BDNF与皮质 BDNF 的水平呈正相关〔10〕。对AD患者BDNF表达的进一步研究显示,AA、AG及GG3种基因型中,AA基因型的患者的血清BDNF水平最低,提示了AA基因型能降低BDNF的表达,与Ventriglia等〔11,12〕报道的携带 A/A基因型者患AD 的危险性比携带G等位基因者明显增高的结论相似。由于BDNF通过刺激生长激素抑制素的表达,从而增加β-淀粉样蛋白的降解〔13〕,因此,AD患者的BDNF水平下降,β-淀粉样蛋白的降解速度减慢,从而导致β-淀粉样蛋白的沉积。而β-淀粉样蛋白(Aβ)的沉积在AD的发病中起重要作用,胞外Aβ的增加和沉积是神经原纤维缠结、神经元功能丧失和神经元死亡的始动环节,也就是AD发生的起始〔14〕。
综上,BDNF基因的功能性多态-rs6265降低了BDNF的表达,引起了SAD的早期病理过程。
4 参考文献
1Mattson MP,Maudsley S,Martin B.BDNF and 5-HT:a dynamic duo in age-related neuronal plasticity and neuro-degenerative disorders〔J〕.Trends Neurosci,2004;27(10):589-94.
2Fumagalli F,Racagni G,Riva MA.The expanding role of BDNF:a therapeutic target for Alzheimer's disease〔J〕.Pharmacogenomics J,2006;6(1):8-15.
3McKhann G,Draehmn AD,Folstein M,etal.Clinical diagnosis of Alzheimer's disease:report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's disease〔J〕.Neurology,1984;34:939-44.
4Poo MM.Neurotrophins as synaptic modulators〔J〕.Nat Rev Neurosci,2001;2(1):24-32.
5YamADa K,Mizuno M,Nabeshima T.Role for brain-derived neurotrophic factor in learning and memory〔J〕.Life Sci,2002;70(7):735-44.
6Heldt SA,Stanek L,Chhatwal JP,etal.Hippocampus-specific deletion of BDNF in Adult mice impairs spatial memory and extinction of aversive memories〔J〕.Mol Psychiatry,2007;17(3):656-70.
7Hock C,Heese K,Hulette C,etal.Region-specific neurotrophin imbalances in Alzheimer disease:decreased levels of brain-derived neurotrophic factor and increased levels of nerve growth factor in hippocampus and cortical areas〔J〕 .Arch Neurol,2000;57:846-51.
8Kunugi H,Ueki A,Otsuka M,etal.A novel polymorphism of the brain- derived neurotrophic factor (BDNF) gene associated with late - onset Alzheimer's disease〔J〕 .Mol Psychiatry,2001;6(1):83-6.
9Egan MF,Kojinma M,Callicott JH,etal.The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function〔J〕.Cell,2003;112(2):257-69.
10Karege F,Schwald M,Cisse M.Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets〔J〕.Neurosci Lett,2002;3(328):261-4.
11Ventriglia M,Bocchio Chiavetto L,Benussi L,etal.Association between the BDNF 196A/G polymorphism and sporADic Alzheimer′s disease〔J〕.Mol Psychiatry,2002;7(2):136-7.
12Matsushita S,Arai H,Matsui T,etal.Brain-derived neurotrophic factor gene polymorphhisms and Ahzheimer′s disease〔J〕.J Neural Transm,2005;112(5):703-71.
13Villuendas G,Sanchez-Franco F,Palacios N,etal.Involvement of VIP on BDNF-induced somatostatin gene expression in cultured fetal rat cerebral cortical cells〔J〕.Brain Res Mol Brain Res,2001;94(1-2):59-66.
14Iqbal K,Grundke-Iqbal Ⅰ.Alzheimer neurofibrillary degeneration:significance,etiopathogenesis,therapeutics and prevention〔J〕.J Cell Mol Med,2008;12(1):38-55.

