DhHP-6及Exenatide对胰岛β细胞的协同作用
雷莉妍,王 迪,张广吉,郭佑铭,王丽萍,2
(1.吉林大学生命科学学院,长春 130012;2.吉林大学中日联谊医院急救医学科,长春 130033)
DhHP-6及Exenatide对胰岛β细胞的协同作用
雷莉妍1,王 迪1,张广吉1,郭佑铭1,王丽萍1,2
(1.吉林大学生命科学学院,长春 130012;2.吉林大学中日联谊医院急救医学科,长春 130033)
采用葡萄糖和棕榈酸钠(Glu-Pal)联合诱导大鼠胰岛瘤RINm-5F细胞凋亡,用噻唑蓝比色(MTT)实验检测次血红素六肽(DhHP-6)和Exenatide分别或联合作用对细胞凋亡的影响.结果表明:DhHP-6和Exenatide均显著抑制Glu-Pal诱导β细胞凋亡,但二者无协同作用;DhHP-6和Exenatide均明显促进RINm-5F细胞增殖,且有显著的协同作用.
次血红素六肽;Exenatide;胰岛β细胞;协同作用
1 材料与方法
1.1 细胞株及主要试剂
大鼠胰岛瘤细胞RINm-5F(美国ATCC公司);DhHP-6和Exenatide由吉林大学生命科学学院生物大分子实验组合成;葡萄糖(北京化工厂);棕榈酸钠(美国Sigma公司);PCR试剂及总RNA抽提试剂盒(美国Invitrogen公司);RPMI 1640和OPTI-MEM培养基(美国Life Techologies公司);胎牛血清(美国Hyclone公司).
1.2 实 验
1.2.1 细胞培养 将RINm-5F细胞置于RPMI 1640培养基(含体积分数为10%的胎牛血清、2mmol/L谷氨酰胺和1.0mmol/L丙酮酸钠)中,在37℃,体积分数为5%的CO2培养箱内培养.
1.2.2 Glu-Pal诱导RINm-5F细胞凋亡模型的建立 将密度为每孔2×104个的RINm-5F细胞接种于96孔板中过夜培养,使细胞充分贴壁.弃去细胞上层培养基,加入含不同浓度配比的葡萄糖与棕榈酸钠的新鲜培养基,培养48h,利用噻唑蓝比色(MTT)实验检测细胞凋亡率,建立细胞凋亡模型.
1.2.3 DhHP-3与Exenatide单独及联合作用对Glu-Pal诱导RINm-5F细胞凋亡的影响 将密度为每孔2×104个的RINm-5F细胞接种于96孔板中,待细胞贴壁后,弃去旧培养基,分别加入含不同浓度的DhHP-6和Exenatide或不同浓度配比的DhHP-6和Exenatide的新鲜培养基,培养1h,加入Glu-Pal诱导RINm-5F细胞凋亡,继续培养48h.用MTT实验检测细胞凋亡率.
1.2.4 PCR检测凋亡相关基因mRNA水平 将密度为每孔106个的RINm-5F细胞接种于6孔板中,当细胞生长至80%融合时,分为空白组、凋亡模型组、DhHP-6保护组和Exenatide保护组,培养48h后提取mRNA.经反转录PCR(RT-PCR)和实时定量PCR(real time-PCR)检测相关基因表达情况.以βctin作为内参[12],各基因的特异性引物序列列于表1.
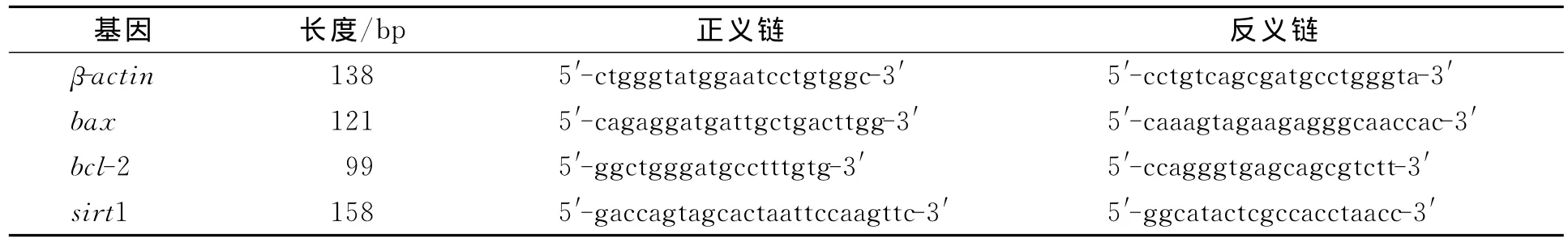
表1 凋亡相关基因的特异性引物序列Table 1 Primers for genes related to apoptosis
1.2.5 DhHP-3与Exendin-4单独及联合作用对RINm-5F细胞增殖的影响 将密度为每孔2×104个的RINm-5F细胞接种于96孔板中过夜培养.弃去旧培养基,分别加入含不同浓度的DhHP-6和Exenatide或不同浓度比的DhHP-6和Exenatide培养基培养24h.用MTT实验检测细胞相对增殖率.
1.3 统计学处理
用统计学软件SPSS 10.0进行统计学分析.数据经方差齐性检验,符合正态分布.结果以±SD表示,组间比较采用t检验,若p<0.05,则数据视为具有统计学差异.
2 结果与讨论
2.1 Glu-Pal诱导RINm-5F细胞凋亡模型的建立
研究表明,长期高糖高脂能诱导胰岛β细胞凋亡[13].本文用Glu和Pal联合诱导RINm-5F细胞凋亡,检测了不同浓度比例的Glu和Pal作用48h对RINm-5F细胞存活率的影响,结果如图1所示.由图1可见:高浓度的Pal对细胞存活率影响较大,且作用不稳定;当12.5mmol/L Glu和0.1mmol/L Pal作为凋亡诱导条件时,细胞凋亡率较合适(41.8%),且作用较稳定.
2.2 DhHP-6及Exenatide对Glu-Pal诱导RINm-5F细胞凋亡的影响
当c(Glu)=12.5mmol/L,c(Pal)=0.1mmol/L时,DhHP-6及Exanatide对Glu-Pal诱导RINm-5F细胞凋亡的影响如图2所示.由图2可见,二者的保护作用均具有浓度依赖性.其中DhHP-6对细胞凋亡的抑制作用较强,当DhHP-6的浓度为24μmol/L时,基本能完全抑制Glu-Pal诱导的细胞凋亡.
2.3 DhHP-6及Exenatide对RINm-5F细胞中凋亡相关基因mRNA表达量的影响
高糖和高脂可引起bcl-2基因家族一些成员表达发生变化而诱导β细胞凋亡[14].DhHP-6和Exenatide对RINm-5F细胞中凋亡相关基因mRNA的影响如图3所示.由图3可见:与空白对照组相比,模型组抗凋亡基因bcl-2和sirt1mRNA表达量下降(分别为对照组的0.21和0.29倍),凋亡基因bax的mRAN表达量提高(约为对照组的1.43倍);加入DhHP-6后,sirt1和bcl-2的mRNA表达量提高(分别为对照组的0.52和0.97倍),bax的mRNA表达量显著下降(约为对照组的0.7倍);加入Exenatide后,sirt1和bcl-2的mRNA表达量提高(分别为各自对照组的0.33和0.42倍),bax与模型组的mRNA表达量相比变化较小.DhHP-6和Exenatide对凋亡相关基因sirt1和bcl-2具有类似的作用,但对bax的影响完全不同,表明二者可能通过不同的信号途径发挥抗凋亡作用.
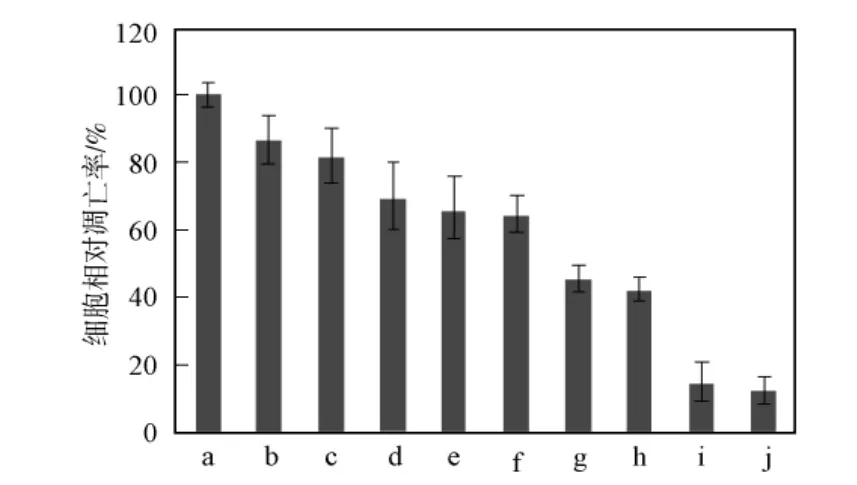
图1 Glu-Pal诱导RINm-5F细胞凋亡Fig.1 Apoptosis of RINm-5Fcells induced by Glu-Pal

图2 DhHP-6(A)及Exenatide(B)对Glu-Pal诱导的RINm-5F细胞凋亡的影响Fig.2 Effects of DhHP-6(A)and Exenatide(B)on the apoptosis of RINm-5Fcells induced by Glu and Pal
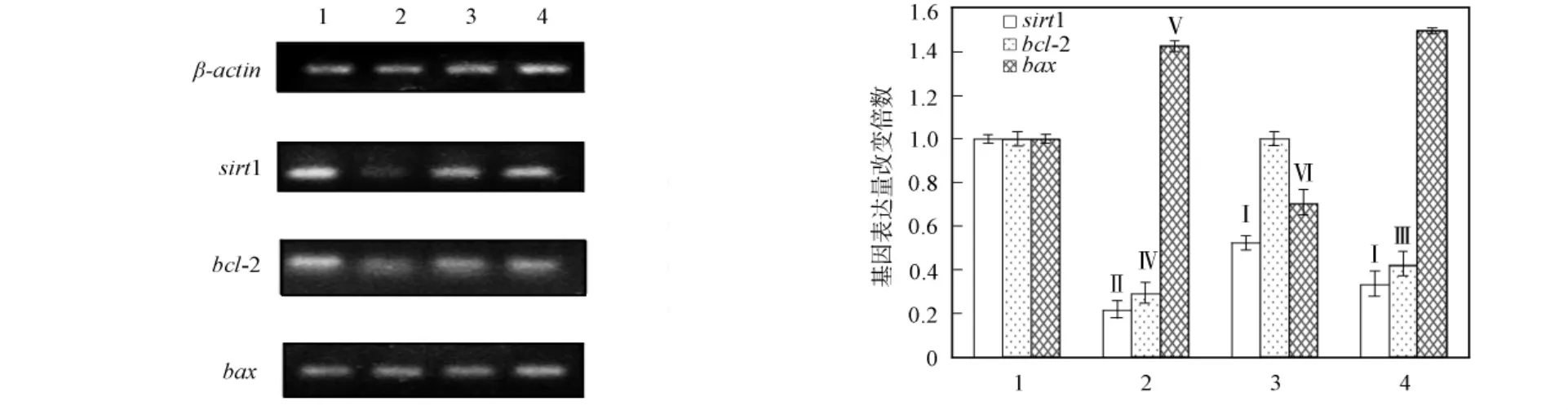
图3 DhHP-6和Exenatide对RINm-5F细胞中凋亡相关基因mRNA表达量的影响Fig.3 Effects of DhHP-6and Exenatide on mRNA level of genes related to apoptosis in RINm-5Fcells
2.4 DhHP-6及Exenatide对RINm-5F细胞增殖的影响
利用不同浓度的DhHP-6或Exenatide处理RINm-5F细胞24h,通过MTT实验检测细胞的增殖情况,结果如图4所示.由图4可见,DhHP-6及Exenatide均显著刺激RINm-5F细胞增殖,且二者的作用均具有浓度依赖性,其中DhHP-6的增殖活性更强.
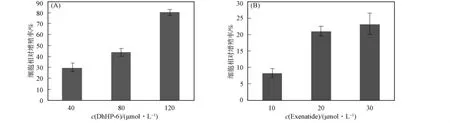
图4 DhHP-6(A)和Exenatide(B)对RINm-5F细胞增殖的影响Fig.4 Effects of DhHP-6(A)and Exenatide(B)on the proliferation of RINm-5Fcells
2.5 DhHP-6和Exenatide联合作用对RINm-5F细胞凋亡的影响
选择c(DhHP-6)∶c(Exenatide)=1∶2.5,并进行梯度稀释研究二者在抗RINm-5F细胞凋亡过程中的协同作用.用A表示DhHP-6对β细胞凋亡的抑制率,用B表示Exenatide对细胞凋亡的抑制率,AB表示二者联合作用对细胞凋亡的抑制率.若AB>A+B,则可判断AB作用具有协同性.当c(Glu)=12.5mmol/L,c(Pal)=0.1mmol/L时,不同浓度的DhHP-6与Exenatide联合作用对RINm-5F细胞凋亡的影响如图5所示.由图5可见,DhHP-6和Exenatide联合作用均大于DhHP-6和Exenatide单独作用对RINm-5F细胞凋亡的抑制率,但小于DhHP-6和Exenatide单独作用对细胞凋亡的抑制率之和,因此二者的抗RINm-5F细胞凋亡作用没有协同性.
2.6 DhHP-6和Exenatide联合作用对RINm-5F细胞增殖的影响
选用c(DhHP-6)∶c(Exenatide)=4,并进行梯度稀释,处理RINm-5F细胞24h,通过MTT实验检测细胞的相对增殖率,结果如图6所示.由图6可见,DhHP-6和Exenatide联合作用效果大于DhHP-6和Exenatide单独作用效果之和,因此二者对促进RINm-5F细胞增殖具有协同作用.
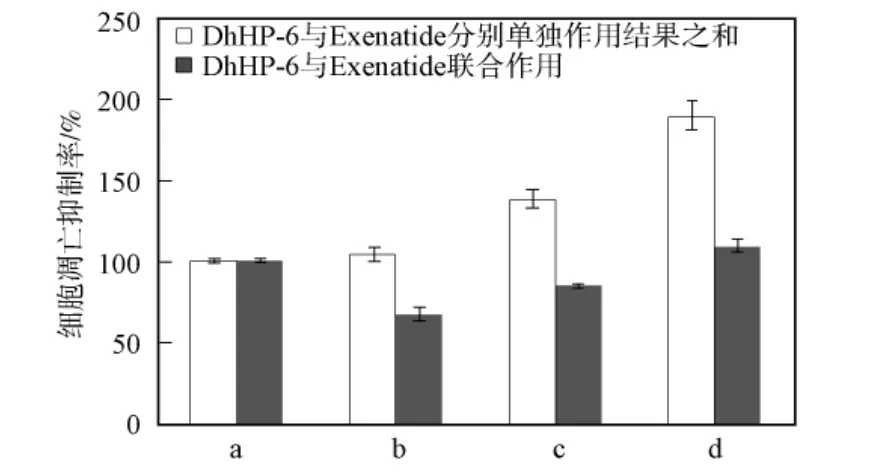
图5 DhHP-6和Exenatide联合作用对RINm-5F细胞凋亡的影响Fig.5 Effect of DhHP-3combined with Exenatide on the apoptosis of RINm-5Fcells
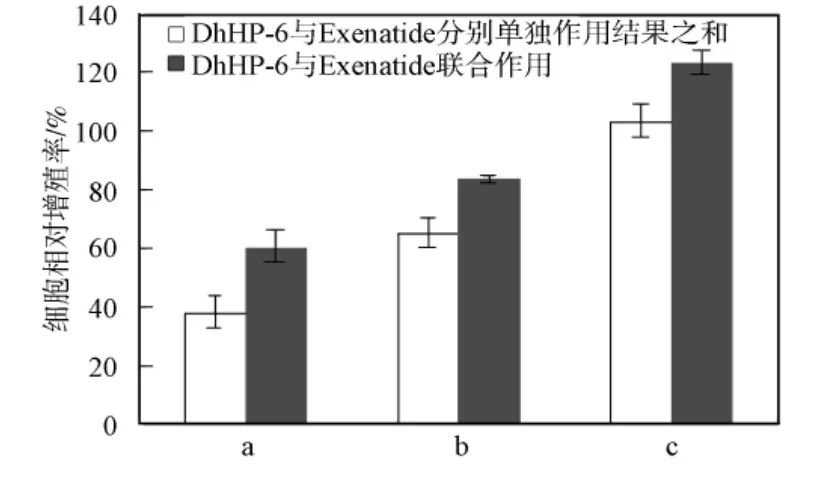
图6 DhHP-6和Exenatide联合作用对RINm-5F细胞增殖的影响Fig.6 Effect of DhHP-6combined with Exenatide on the proliferation of RINm-5Fcells
综上所述,DhHP-6和Exenatide均显著抑制Glu-Pal诱导RINm-5F细胞凋亡,在促进RINm-5F细胞增殖时具有显著的协同作用.
[1] Wild S,Roglic G,Green A,et al.Global Prevalence of Diabetes:Estimates for the Year 2000and Projections for 2030[J].Diabetes Care,2004,27(5):1047-1053.
[2] Bensellam M,Laybutt D R,Jonas J C.The Molecular Mechanisms of Pancreaticβ-Cell Glucotoxicity:Recent Findings and Future Research Directions[J].Mol Cell Endocrinol,2012,364(1/2):1-27.
[3] Chepurny O G,Hussain M A,Holz G G.Exendin-4as a Stimulator of Rat InsulinⅠGene Promoter Activity via bZIP/CRE Interactions Sensitive to Serine/Threonine Protein Kinase Inhibitor Ro 31-8220[J].Endocrinology,2002,143(6):2303-2313.
[4] Park S,Hong S M,Sung S R.Exendin-4and Exercise Promotes Beta-Cell Function and Mass through IRS2 Induction in Islets of Diabetic Rats[J].Life Sci,2008,82(9/10):503-511.
[5] Ferdaoussi M,Abdelli S,Yang J Y,et al.Exendin-4Protects Beta-Cells from Interleukin-1Beta-Induced Apoptosis by Interfering with the c-Jun NH2-Terminal Kinase Pathway[J].Diabetes,2008,57(5):1205-1215.
[6] 王丽萍,金鑫,黄磊,等.DhHP-6延长秀丽线虫寿命的作用机制[J].吉林大学学报:理学版,2012,50(5):1045-1048.(WANG Liping,JIN Xin,HUANG Lei,et al.Mechanism of DhHP-6on Extending Life Span in Caenorhabditis elegans[J].Journal of Jilin University:Science Edition,2012,50(5):1045-1048.)
[7] 郭常闰,关树文,黄磊,等.次血红素六肽对纳米金诱导线虫热激损伤的保护作用 [J].吉林大学学报:理学版,2012,50(1):153-156.(GUO Changrun,GUAN Shuwen,HUANG Lei,et al.DhHP-6Protection of Caenorhabditis elegans from Heat Shock Injury Induced by Au Nanopartices[J].Journal of Jilin University:Science Edition,2012,50(1):153-156.)
[8] Guan S,Li P,Luo J,et al.A Deuterohemin Peptide Extends Lifespan and Increases Stress Resistance in Caenorhabditis elegans[J].Free Radic Res,2010,44(7):813-820.
[9] Huang L,Li P,Wang G,et al.DhHP-6Extends Lifespan of Caenorhabditis elegans by Enhancing Nuclear Translocation and Transcriptional Activity of DAF-16[J].Free Radic Res,2013,47(4):316-324.
[10] Kola I,Landis J.Can the Pharmaceutical Industry Reduce Attrition Rates[J].Nat Rev Drug Discov,2004,3(8):711-716.
[11] Bolognesi M L,Cavalli A,Melchiorre C.Memoquin:A Multi-target-directed Ligand as an Innovative Therapeutic Opportunity for Alzheimer’s Disease[J].Neurotherapeutics,2009,6(1):152-162.
[12] Unger R H,ZHOU Yanting.Lipotoxicity of Beta-Cells in Obesity and Other Causes of Fatty Acid Spill Over[J].Diabetes,2001,50(Suppl 1):S118-S121.
[13] YANG Fan,Knethen A,Von,Brüne B.Modulation of Nitric Oxide Voked Apoptosis by the P53Downstream Target p21(WAF1/CIP1)[J].J Leukoc Biol,2000,68(6):916-922.
[14] Zamzami N,Brenner C,Marzo I,et al.Subcellular and Submitochondrial Mode of Action of Bcl-2-Like Oncoproteins[J].Oncogene,1998,16(17):2265-2282.
(责任编辑:单 凝)
Synergistic Effects of DhHP-6and Exenatide on PancreaticβCells
LEI Liyan1,WANG Di1,ZHANG Guangji1,GUO Youming1,WANG Liping1,2
(1.College of Life Science,Jilin University,Changchun130012,China;2.Department of Emergency,China-Japan Union Hospital,Jilin University,Changchun130033,China)
Apoptosis of pancreaticβcell RINm-5Fwas induced by glucose coupled with sodium palmitate.Effects of DhHP-6or/and Exenatide on the apoptosis of RINm-5Fcell were detected by methyl thiazolyl tetrazolium(MTT)assay.DhHP-6and Exenatide decreased the apoptosis induced by Glu-Pal significantly without no synergistic effect between them.In addition,we also found that DhHP-6and Exenatide both stimulated the proliferation of RINm-5Fcells,and there was a synergistic effect between them.
DhHP-6;Exenatide;pancreaticβcell;synergistic effect
Q28
A
1671-5489(2014)04-0835-05
2型糖尿病是一种慢性代谢综合症[1],高糖是其显著的临床特征.由于高糖和高脂具有的细胞毒性会导致胰岛β细胞凋亡[2],因此2型糖尿病患者的胰岛β细胞数量均减少.
Exenatide是治疗2型糖尿病的药物,是一种胰高血糖素样肽1(GLP-1)类似物,但比GLP-1拥有更好的血浆稳定性.Exenatide与胰岛β细胞上的GLP-1受体有高度的亲和性,在治疗2型糖尿病过程中,Exenatide可促进胰岛素分泌,并具有促进胰岛β细胞增殖、分化和抗β细胞凋亡的作用[3-5].次血红素六肽(DhHP-6)是由吉林大学生命科学学院生物大分子实验组设计并合成的过氧化物酶模拟物[6-8].目前,多基因、多组织疾病,如肿瘤和糖尿病,单个靶点的药物在治疗时很难达到预期疗效[9].而针对多靶点的药物联合治疗能同时调节疾病网络中的多个环节,并且药物间常表现出协同作用,具有突出的效果,在重大疾病治疗中的应用越来越广泛[10-11].本文探讨DhHP-6与Exenatide在胰岛β细胞凋亡和增殖过程中的协同作用.
10.13413/j.cnki.jdxblxb.2014.04.40
2013-09-29.
雷莉妍(1985—),女,汉族,博士研究生,从事药物筛选的研究,E-mail:liyanlei-2005@163.com.通信作者:王丽萍(1967—),女,汉族,博士,教授,博士生导师,从事药物筛选的研究,E-mail:wanglp@jlu.edu.cn.
吉林省自然科学基金(批准号:201015171)、吉林省科技发展计划项目(批准号:201205017)、吉林省医药产业发展专项基金(批准号:YYZX201150-2)和长春市科技局社会发展科技支撑计划项目(批准号:12SF23).

