H2S气体分子及相关药物研究进展*
杨 雪,刘 洁,吴晓明,徐进宜
中国药科大学药学院药物化学教研室,南京 210009
随着生命科学的迅猛发展,气体小分子在生命活动中的意义受到越来越多的关注。伴随着气体信号分子NO和CO的发现,Wang等[1]在2002年又发现了第三种新型气体信号分子,即H2S气体信号分子。研究发现,生理浓度下的H2S分子参与体内多个生理环节的调节,尤其在高血压、肺动脉高压、帕金森、阿尔兹海默等疾病的发病过程中发挥着重要作用。
1 内源性H2S的合成与代谢
1.1 H2S的体内合成过程
H2S是一种无色,易燃,具有臭鸡蛋气味的气体分子。在哺乳动物组织内,它的内源性合成以L-半胱氨酸为底物,主要依赖于两种5’-磷酸吡哆醛依赖性酶,胱硫醚-β-合成酶(cystathionine β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine γlyase,CSE)[2]。这两种酶的分布具有组织特异性:CBS主要催化脑组织以及神经组织内H2S的生成,并在肝脏和肾脏中高度表达;CSE主要在肝脏以及血管/非血管平滑肌中高度表达,并且在啮齿类动物的小肠以及胃中也检测到低浓度的CSE[2-3]。同时发现,在线粒体中,巯基丙酮酸硫转移酶(3-mercaptopycurate sulfurtransferase,3MST)也可以催化半胱氨酸生成 H2S[4](见图 1)。Shibuya等[5]在 2012 年发现在小脑和肾脏中,D-半胱氨酸可以在氨基酸氧化酶(D-amino acid oxidase,DAO)和巯基丙酮酸硫转移 酶(3-mercaptopyruvate sulphur transferase,3-MST)的作用下生成H2S。
1.2 体内H2S的代谢过程
体内生成的H2S有1/3以气体形式存在,另外2/3则以NaHS的形式存在,并且两者处于一种动态平衡。H2S在体内的主要代谢途径是经氧化代谢形成硫酸盐。在代谢过程中体内的硫化物先转化为硫代硫酸盐,再经硫代硫酸盐还原酶或硫代硫酸盐硫基转移酶的作用下转化为亚硫酸盐,亚硫酸盐在谷胱甘肽的参与下氧化为硫酸盐,从肾脏排出。另外少部分硫化物则代谢为蛋白加合物,经甲基化代谢而形成毒性较低的甲硫醇和甲硫醚[6](见图1)。
2 外源性H2S供体类型
如图2所示,外源性的H2S供体主要包括7种类型:(1)Na2S、NaHS、CaS 等含硫化盐[7-8];(2)劳森试剂(二硫代磷酸酯类)衍生物(如 GYY4137)[9];(3)天然产物中大蒜素类(如二烯丙基三硫化物(DATS))[10];(4)二硫代硫酮类衍生物(如去甲茴三硫)[11];(5)N-(苯甲酰基)-硫代苯甲酰胺类衍生物[12];(6)S-乙酰基过硫类化合物[13];(7)硫代氨基酸类化合物[14]。
3 H2S的主要生理活性
3.1 血管扩张活性

图1 哺乳动物细胞中H2S生成与代谢过程
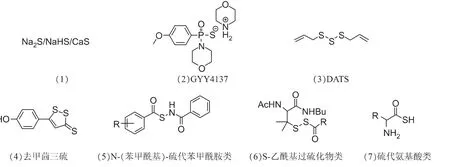
图2 7种外源性H2S供体类型
原发性高血压患者中存在同型半胱氨酸和H2S的代谢不平衡,经治疗的高血压患者组的血浆H2S浓度明显低于正常对照组。在经治疗的高血压患者中,随着血压水平的增加,H2S水平均逐渐降低,三级高血压水平患者的H2S浓度均明显低于血压控制良好者,该研究结果表明H2S在高血压的发生和发展中均具有重要作用[15]。
敲除小鼠的CSE基因会导致血浆、心脏、主动脉条等组织内H2S浓度的显著下降,进而引起小鼠内皮依赖的扩血管活性下降,血压出现明显上升[4]。Zhao等[16]发现H2S通过开放血管平滑肌细胞ATP敏感的钾通道(KATP)使收缩的血管呈浓度依赖性舒张。当静脉推注H2S会使大鼠血压出现12~30 mmHg的短暂下降,该降血压活性类似吡那地尔(KATP开放剂),并可被格列本脲(KATP阻滞剂)拮抗。为进一步确定H2S对KATP通道的作用,研究者采用全细胞膜片钳技术将单个细胞以300 μm的H2S孵育后,检测发现KATP通道电位峰值和时程宽度显著增大。KATP通道对细胞总电流的增加会直接引起细胞膜的超极化,进而松弛血管平滑肌。其后对一组细胞进行同样监测,发现H2S能够增加电压依赖性钾通道总电流。当洗去H2S后,KATP通道兴奋性消失。以上研究表明,与NO及CO通过激活cGMP通路产生扩血管活性不同,H2S舒张血管平滑肌的功能是通过开放血管平滑肌细胞的KATP通道来实现的。
2008年,Yang等[3]标记小鼠的CSE基因,以野生型小鼠(基因型CSE+/+)为对照组,选择突变的纯合子鼠(基因型 CSE-/-)和杂合子鼠(基因型 CSE-/+)作为研究对象。与野生型鼠相比,用苯肾上腺素收缩肠系膜动脉条后,乙酰甲胆碱对突变型鼠肠系膜动脉的舒张作用显著下降。对于剥除内皮的野生型小鼠和突变小鼠,乙酰甲胆碱的血管舒张活性均基本消失。因此确证,H2S扩血管作用机制还依赖于内皮衍生化松弛因子(Endothelium Derived Relaxing Factor,EDFR)[3]。乙酰甲胆碱对内皮细胞的刺激会导致1,4,5-三磷酸肌醇的大量生成,进而与肌浆网上的1,4,5-三磷酸肌醇受体结合,激活细胞内Ca2+释放通道,增加细胞内Ca2+的浓度。受到Ca2+激活的钙调蛋白,通过形成活化的Ca2+-钙调蛋白复合物,再与CSE结合从而增加酶活力,催化内源性H2S的生成。
Mustafa等[17]的进一步研究表明,H2S对内皮松弛作用也可归因于超极化作用,即内皮衍生超极化因 子(endothelium-derived hyperpolarizing factor,EDHF)的效果。生物体内源性H2S分子正是通过激活血管内皮和平滑肌细胞中ATP敏感的中电导以及小电导钾通道来产生超极化和扩血管效应(见图3)。这也阐明了H2S开放KATP通道的作用机制。
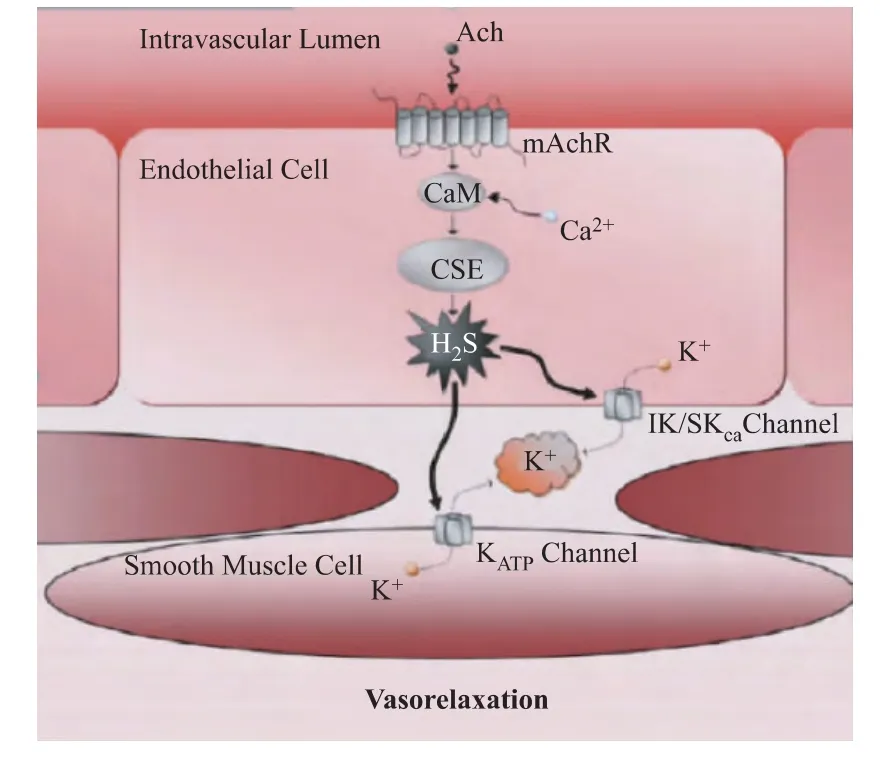
图3 H2S的血管扩张活性机制[16]
3.2 抑制血管平滑肌的增殖
Du等[18]发现内源性H2S可以通过下调丝裂原活化蛋白激酶(Mitogen Activated Protein Kinase,MAPKs)的活性,进而剂量依赖地抑制大鼠动脉血管平滑肌细胞的增殖。其后,Yang等[19]探究了CSEH2S系统对CSE过度表达的HEK-293细胞增殖的抑制作用,结果显示,CSE的过度表达会激活细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)的级联反应,并增强上游p21Cip/WAK-1基因的表达,从而抑制平滑肌细胞增殖。此外,近年来研究表明,内源性CSE-H2S通路参与体内多种心血管疾病(自发性高血压[20]、N-硝基-L-精氨酸甲酯诱导的高血压[21]、低氧肺动脉高压[22]以及败血性和内毒素休克[23])的发病与转归。因此,研究和开发能改善CSE生理活性或者调节H2S所介导通路的药物,对心血管疾病(尤其是高血压)的治疗具有极其重要的借鉴意义。
3.3 神经调节作用
生理浓度下的H2S可以激活腺苷酸环化酶(Cyclic adenosine monophosphate,cAMP)和蛋白激酶 A(proteinkinase A,PKA)的级联反应,从而增强N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDA)介导的反应,并诱导海马体的长时程增强(long-term potentiation,LTP)[24]。此外,研究者们发现,H2S通过L型/T型钙离子通道和细胞膜上的NMDA受体作用来增加神经元细胞、星形胶质细胞以及小神经细胞内Ca2+的动态平衡[25]。最后,在原代培养大鼠星形胶质细胞和小胶质细胞中,研究者们发现H2S可以通过调控Cl-/HCO3-交换和Na+/H+交换来调节细胞内pH水平[26]。因此,H2S通过调节神经细胞Ca2+的动态平衡和细胞内pH稳态,从而介导神经元细胞和星形胶质细胞之间的信号传递,调节突触活动,发挥神经调节作用。
3.4 抗炎作用
白细胞粘附作用是炎症反应的第一步,与免疫反应、血管损伤、动脉粥样硬化及血栓形成等过程有密切关系。研究发现,H2S供体不仅可以剂量依赖性地抑制由阿司匹林引起的白细胞粘附,而且也可以抑制阿司匹林引起的的白细胞以及内皮细胞上粘附因子表达[27]。此外,还发现H2S供体对炎症部位的白细胞浸润以及角叉菜胶诱导大鼠足肿模型都有明显的抑制作用[28]。
H2S介导的抗炎机制对神经细胞也具有保护作用。2007年,Hu等[29]发现在原代培养的神经胶质细胞、星形胶质细胞以及永生化小鼠的BV2胶质细胞中,NaHS可以抑制脂多糖诱导的NO等炎症因子生成和释放、减少肿瘤坏死因子α的分泌。其后,Lee等[30]也证实H2S供体型化合物在神经炎症中对神经元具有保护作用,例如去甲茴三硫、S-双氯芬酸钠、S-阿司匹林(见图4)。研究发现,H2S可能通过抑制炎症因子的生成并促进抗炎细胞因子的生成来减轻神经元细胞炎症反应。当给予小胶质细胞和神经胶质细胞适当刺激后,这两种神经胶质细胞会产生致炎因子,从而导致神经炎症反应的发生。H2S可以上调如白介素-4/10等抗炎因子,并抑制肿瘤坏死因子(TNF-α)、白介素-1β以及NO等炎症因子的产生,从而保护神经细胞免受炎症因子的进攻(见图 5)。
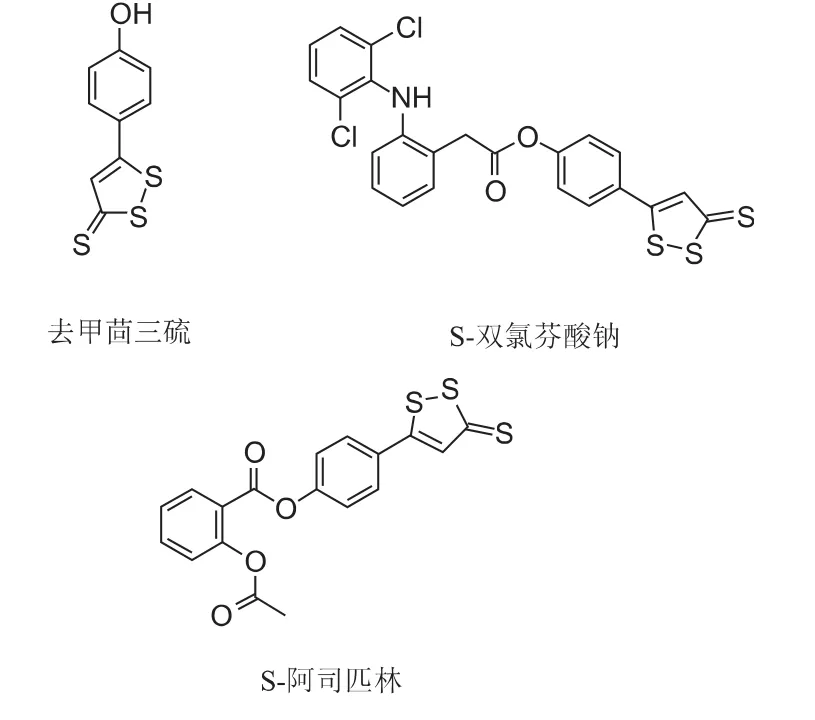
图4 H2S供体型化合物
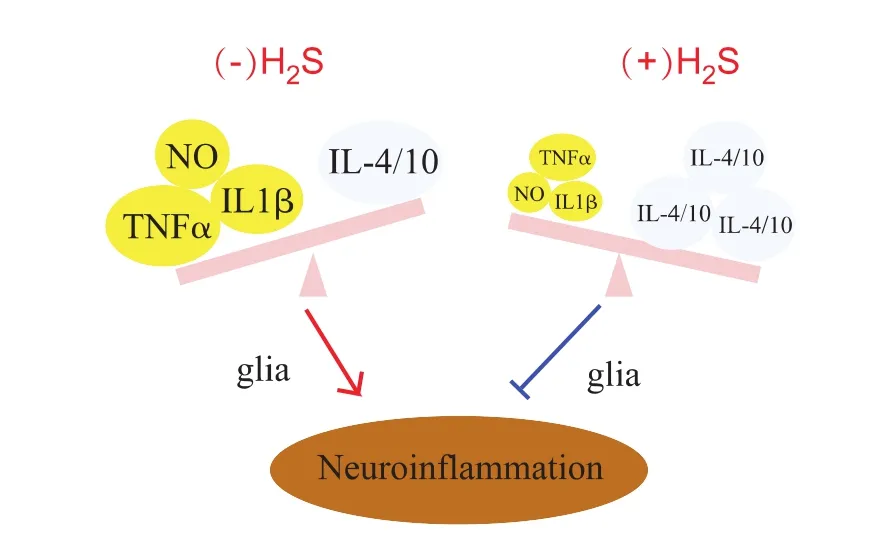
图5 H2S对小胶质细胞和星形胶质细胞抗炎机制[30]
4 内源性H2S分子的检测手段
随着化学、生物学和材料科学的交叉越来越深入,利用荧光手段研究有机小分子在生物体中的作用机制成为研究热点。其中用于检测H2S释放和定位的小分子荧光探针更是飞速发展。这些小分子荧光探针主要包括利用H2S还原反应的叠氮类荧光探针[31],基于迈克尔加成反应的荧光探针[32],离子络合类荧光探针[33]以及近红外比率型荧光探针[34]。其中,近红外感受器具有低背景干扰以及高细胞穿透力的特点,使其对H2S在低稳态浓度下的定量检测更为准确。因此,研究者们可以尝试利用近红外的荧光性质来设计灵敏度更高、响应时间更短的探针,从而简化对细胞内H2S释放的检测。
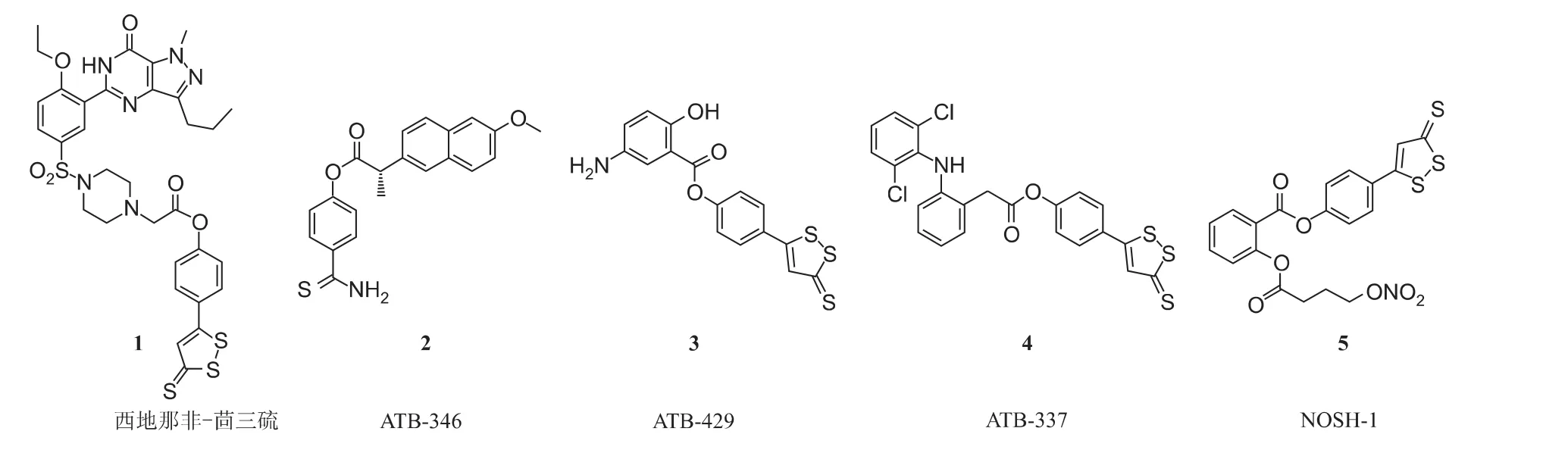
图6 H2S供体型化合物
5 H2S供体型药物的发展
从天然植物中提取含硫化合物曾受到研究者广泛关注。例如大蒜提取物中的二烯丙基多硫化物可在红细胞中通过硫醇依赖性的方式生成硫化氢,这也是大蒜实现降血压、保护心血管的主要机制。
随着H2S在生物体内释放指征的明确,研究者们可以设计更多H2S释放的供体靶向药物。目前,在现有药物基础上进行基团改造使之释放H2S,也是当代药物研发的一个分支。例如,因为H2S供体可以抑制磷酸酯酶,参与勃起功能障碍的调节,专门研发硫化氢供体类型药物的CTG-Pharma公司将H2S供体的化合物与西地那非拼合,合成了西地那非-茴三硫,用于松弛阴茎海绵体平滑肌,其对磷酸酯酶的抑制强于西地那非[35](见图6-1)。
为了减弱非甾体抗炎药(Nonsteroidal Anti-inflammatory Drugs,NSAIDs)对胃肠道、肝、肾以及血液系统等不良反应,研究者常常将H2S供体基团和NSAIDs拼合,从而形成新的化学实体。如Antibe Therapeutics公司将H2S供体(4-羟基硫代苯甲酰胺)和萘普生拼合得到ATB-346(见图6-2),以期待用于改善骨关节炎的治疗。与萘普生相比,ATB-346不仅可以更有效地抑制COX-2的活性,还可以减少对胃肠道的损伤,加速已有胃溃疡病灶的愈合[36],目前ATB-346已处于临床前有效性和毒理测试阶段。拼合去甲茴三硫的双氯芬酸钠衍生物ATB-337(见图6-4),不仅白细胞粘附作用下降,抗炎活性增强,而且胃肠道副作用减小,降低药物副作用[11]。此外,Antibe Therapeutics公司将美沙拉嗪和去甲茴三硫拼合的化合物ATB-429,针对伴随炎症性肠胃病的内脏痛,其镇痛效果显著[37](见图6-3)。
值得一提的是,Kodela等[38]将NO供体和H2S供体同时和阿司匹林拼合,形成NO和H2S双供体型阿司匹林化合物NOSH-1(见图6-5)。在角叉菜胶大鼠足肿胀模型中,NOSH-1抗炎活性和阿司匹林相当。而在抗肿瘤活性筛选实验中,NOSH-1对HT-29结肠癌细胞的IC50为48±3 nm,其抑制作用远远高于阿司匹林。NOSH-1以4倍IC50浓度孵育细胞24小时,其乳酸脱氢酶释放小于10%,证明了NOSH-1是选择性杀死肿瘤细胞的活性化合物。对大肠癌异种移植的大鼠连续给药6天后,其肿瘤体积明显缩小。Chattopadhyay等[39]确证NOSH-1能够通过诱导细胞凋亡及细胞G0/G1周期停滞来抑制肿瘤细胞增殖,这也为硫化氢供体型化合物的研发拓展了新的领域。
6 展 望
综上所述,H2S对人体各个系统的调节作用不可小觑。作为一种新型的气体信号分子,其在扩张血管平滑肌、抑制平滑肌增殖、神经保护以及抗炎中均发挥了重要的作用。在此基础上,拼合硫化氢供体型药物的问世也引起当代新药研发的关注。然而,由于对H2S释放指征的缺乏,H2S从生理组织产生到作用部位的释放过程还有待阐明,其在病理条件下的生物学功能以及信号转导通路也有待进一步的探究。随着越来越多检测手段的发展,研究者们对H2S在人体生理系统内的调控将越来越明确,这必将进一步促进H2S及其供体型药物在临床的应用。
[1]Wang R.Two's company,three's a crowd∶can H2S be the third endogenous gaseous transmitter?[J].FASEB J,2002,16(13)∶1792-8.
[2]Kamoun P.Endogenous production of hydrogen sulfide in mammals[J].Amino Acids,2004,26(3)∶243-54.
[3]Yang G,Wu L,Jiang B,et al.H2S as a physiologic vasorelaxant∶hypertension in mice with deletion of cystathionine gamma-lyase[J].Science,2008,322(5901)∶587-90.
[4]Shibuya N,Mikami Y,Kimura Y,et al.Vascular endothelium expresses 3-mercaptopyruvate sulfurtransferase and produces hydrogen sulfide[J].J Biochem,2009,146(5)∶623-6.
[5]Shibuya N,Koike S,Tanaka M,et al.A novel pathway for the production of hydrogen sulfide from D-cysteine in mammalian cells[J].Nat Commun,2013,4∶1366.
[6]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator[J].J Neurosci,1996,16(3)∶1066-71.
[7]Deleon E R,Stoy G F,Olson K R.Passive loss of hydrogen sulfide in biologicalexperiments[J].Anal Biochem,2012,421(1)∶203-7.
[8]Calvert JW,Coetzee WA,Lefer DJ.Novel insights into hydrogen sulfide——mediated cytoprotection[J].Antioxid Redox Signal,2010,12(10)∶1203-17.
[9]Li L,Whiteman M,Guan YY,et al.Characterization of a novel,water-soluble hydrogen sulfide-releasing molecule (GYY4137)∶new insights into the biology of hydrogen sulfide[J].Circulation,2008,117(18)∶2351-60.
[10]Benavides GA,Squadrito GL,Mills RW,et al.Hydrogen sulfide mediates the vasoactivity of garlic[J].Proc Natl Acad Sci U S A,2007,104(46)∶17977-82.
[11]Wallace JL,Caliendo G,Santagada V,et al.Gastrointestinal safety and anti-inflammatory effects of a hydrogen sulfide-releasing diclofenac derivative in the rat[J].Gastroenterology,2007,132(1)∶261-71.
[12]Zhao Y,Wang H,Xian M.Cysteine-activated hydrogen sulfide (H2S)donors[J].J Am Chem Soc,2011,133(1)∶15-7.
[13]Zhao Y,Bhushan S,Yang C,et al.Controllable hydrogen sulfide donors and their activity against myocardial ischemia-reperfusion injury[J].ACS Chem Biol,2013,8(6)∶1283-90.
[14]Zhou Z,Von Wantoch Rekowski M,Coletta C,et al.Thioglycine and L-thiovaline∶biologically active H2S-donors[J].Bioorg Med Chem,2012,20(8)∶2675-8.
[15]孙宁玲,喜 杨,杨松娜,等.新型气体信号分子硫化氢与同型半胱氨酸在高血压患者中的变化探讨 [J].中华心血管病杂志,2007,(12):1145-8.
[16]Zhao W,Zhang J,Lu Y,et al.The vasorelaxant effect of H2S as a novel endogenous gaseous K(ATP)channel opener[J].EMBO J,2001,20(21)∶6008-16.
[17]Mustafa AK,Sikka G,Gazi SK,et al.Hydrogen sulfide as endothelium-derived hyperpolarizing factor sulfhydrates potassium channels[J].Circ Res,2011,109(11)∶1259-68.
[18]Du J,Hui Y,Cheung Y,et al.The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J].Heart Vessels,2004,19(2)∶75-80.
[19]Yang G,Cao K,Wu L,et al.Cystathionine gammalyase overexpression inhibits cell proliferation via a H2S-dependent modulation of ERK1/2 phosphorylation and p21Cip/WAK-1[J].J Biol Chem,2004,279(47)∶49199-205.
[20]Yan H,Du J,Tang C.The possible role of hydrogen sulfide on the pathogenesis of spontaneous hypertension in rats[J].Biochem Biophys Res Commun,2004,313(1)∶22-7.
[21]Zhong G,Chen F,Cheng Y,et al.The role of hydrogen sulfide generation in the pathogenesis of hypertension in rats induced by inhibition of nitric oxide synthase[J].J Hypertens,2003,21(10)∶1879-85.
[22]Chunyu Z,Junbao D,Dingfang B,et al.The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats[J].Biochem Biophys Res Commun,2003,302(4)∶810-6.
[23]Hui Y,Du J,Tang C,et al.Changes in arterial hydrogen sulfide (H2S)content during septic shock and endotoxin shock in rats[J].J Infect,2003,47(2)∶155-60.
[24]Kimura H.Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor[J].Biochem Biophys Res Commun,2000,267(1)∶129-33.
[25]Lee SW,Hu YS,Hu LF,et al.Hydrogen sulphide regulates calcium homeostasis in microglial cells[J].Glia,2006,54(2)∶116-24.
[26]Lu M,Choo CH,Hu LF,et al.Hydrogen sulfide regulates intracellular pH in rat primary cultured glia cells[J].Neurosci Res,2010,66(1)∶92-8.
[27]Fiorucci S,Antonelli E,Distrutti E,et al.Inhibition of hydrogen sulfide generation contributes to gastric injury caused by anti-inflammatory nonsteroidal drugs[J].Gastroenterology,2005,129(4)∶1210-24.
[28]Zanardo RC,Brancaleone V,Distrutti E,et al.Hydrogen sulfide is an endogenous modulator of leukocyte-mediated inflammation[J].FASEB J,2006,20(12)∶2118-20.
[29]Hu L F,Wong P T,Moore P K,et al.Hydrogen sulfide attenuates lipopolysaccharide-induced inflammation by inhibition of p38 mitogen-activated protein kinase in microglia[J].J Neurochem,2007,100(4)∶1121-8.
[30]Lee M,Sparatore A,Del Soldato P,et al.Hydrogen sulfide-releasing NSAIDs attenuate neuroinflammation induced by microglial and astrocytic activation[J].Glia,2010,58(1)∶103-13.
[31]Wang K,Peng H,Ni N,et al.2,6-dansyl azide as a fluorescent probe for hydrogen sulfide[J].J Fluoresc,2014,24(1)∶1-5.
[32]Liu C,Peng B,Li S,et al.Reaction based fluorescent probes for hydrogen sulfide[J].Org Lett,2012,14(8)∶2184-7.
[33]Galardon E,Tomas A,Roussel P,et al.New fluorescent zinc complexes∶towards specific sensors for hydrogen sulfide in solution[J].Dalton Trans,2009,(42)∶9126-30.
[34]Wang X,Sun J,Zhang W,et al.A near-infrared ratiometric fluorescent probe for rapid and highly sensitive imaging of endogenous hydrogen sulfide in living cells[J].Chem Sci,2013,4(6)∶2551-6.
[35]Shukla N,Rossoni G,Hotston M,et al.Effect of hydrogen sulphide-donating sildenafil(ACS6)on erectile function and oxidative stress in rabbit isolated corpus cavernosum and in hypertensive rats[J].Bioinspir Biomim,2009,103(11)∶1522-9.
[36]Wallace JL,Caliendo G,Santagada V,et al.Markedly reduced toxicity ofa hydrogen sulphide-releasing derivative of naproxen (ATB-346)[J].Blumea,2010,159(6)∶1236-46.
[37]Distrutti E,Sediari L,Mencarelli A,et al.5-Amino-2-hydroxybenzoic acid 4-(5-thioxo-5H-[1,2]dithiol-3yl)-phenyl ester(ATB-429),a hydrogen sulfide-releasing derivative of mesalamine,exerts antinociceptive effects in a model of postinflammatory hypersensitivity[J].J Pharmacol Exp Ther,2006,319(1)∶447-58.
[38]Kodela R,Chattopadhyay M,Kashfi K.NOSH-Aspirin∶A Novel Nitric Oxide-Hydrogen Sulfide-Releasing Hybrid∶A New Class of Anti-inflammatory Pharmaceuticals[J].ACS Med Chem Lett,2012,3(3)∶257-62.
[39]Chattopadhyay M,Kodela R,Olson KR,et al.NOSH-aspirin(NBS-1120),a novel nitric oxide-and hydrogen sulfide-releasing hybrid is a potent inhibitor of colon cancer cell growth in vitro and in a xenograft mouse model[J].Biochem Biophys Res Commun,2012,419(3)∶523-8.

