左卡尼汀在全肠外营养大鼠短肠综合征模型中的作用
梁 冰 王斯闻
(中国医科大学附属第四医院急诊科,辽宁 沈阳 110032)
短肠综合征是由于大量小肠切除后,机体不能吸收足够的营养以维持生理代谢的需要,而导致整个机体处于营养不足的状况, 继而出现器官功能衰退,代谢功能障碍,免疫功能下降,由此而产生的一系列综合征〔1,2〕。左卡尼汀是机体脂肪代谢所必需的辅助因子,它能够促进脂肪酸氧化,又能使脂肪转化成为能量,通过增加ATP含量,预防和减轻心肌损伤,改善肝脏的脂质代谢、减少脂肪沉积,为短肠综合征患者的全肠外营养治疗提供了新的方向〔3,4〕。本研究通过观察左卡尼汀对短肠综合征模型大鼠全肠外营养(TPN)治疗后丙二醛(MDA)浓度、超氧化物歧化酶(SOD)活性和三磷酸腺苷(ATP)酶活力、肝功能及脂质代谢的影响,为进一步阐明左卡尼汀可减少心肌细胞损伤及肝脂肪变性的临床应用提供理论基础,并为短肠综合征中肠外营养的治疗提供新的治疗方案。
1 资料和方法
1.1实验动物 健康雄性Wistar大鼠共50只,SPF级,鼠龄6~7 w,体重180~200 g,购自中国医科大学动物部。随机分为5组,各组均有10只小鼠,第1组为假手术组,其余4组分别为生理盐水对照组、左卡尼汀低剂量组(50 mg·kg-1·d-1)、中剂量组(100 mg·kg-1·d-1)、高剂量组(200 mg·kg-1·d-1);5组均予全肠外营养液支持治疗。
1.2左卡尼汀及对照组 使适应3 d的Wistar雄性大鼠体重增长至190~220 g后,禁食12 h,予1%戊巴比妥钠腹腔内注射麻醉,颈下及背部、腹部备皮,碘酒、酒精消毒。大鼠腹部行纵向正中切口长约5 cm,逐层打开腹腔,切除大约75%的小肠,空肠近端保留约10 cm,回肠末端也保留约10 cm,端-端全层吻合后关腹,造成大鼠肠切除短肠模型。大鼠颈下稍偏右纵向剪开长1.0 cm的切口,皮下分离出右侧颈外静脉,下穿两根丝线,结扎远心端。用眼科剪剪一V形口,以直径1.2 cm的硅胶管向心脏端插入1.5 cm,结扎固定。大鼠背部肩胛骨之间剪长1.5 cm的切口,用弯止血钳在皮下由背部向颈下打一隧道,把硅胶管由背部引出,缝合颈下切口。硅胶管再从带背扣的弹簧内穿出,接由蠕动泵控制流速的输液器,弹簧经背扣固定在大鼠背部,整个手术过程遵循无菌操作。假手术组:同左卡尼汀及对照组手术方法打开腹腔,距回盲瓣10 cm处切断回肠后再用6-0可吸收缝线全层间断端端吻合,0号丝线关腹,术后处理同前。
1.3术后处理 各组大鼠术后当天禁食、不禁水,术后第1天将微量输液泵与旋转输液装置连接,建立TPN支持通道。所有大鼠均给予等氮、等热量的TPN支持7 d,每天摄入氮量1.0 g/kg,非蛋白热量627.6 kJ/kg,糖脂比例为1∶1,将氨基酸、脂肪乳剂、葡萄糖、电解质、水溶性和脂溶性维生素以及适量的微量元素(均由华瑞制药有限公司提供)配制成全静脉营养混合液。经微量输液泵24 h匀速输入,输液速度为0.1 ml·h-1·kg-1。导管置入上腔静脉后,当天给予大鼠等渗盐水,术后第1天给予半量TPN,第2天起给予全量 TPN,直至术后第7天。术后8 d,用乙醚麻醉后开胸阻断升主动脉后立即切开右心房,从冠状静脉窦抽取新鲜血液3~5 ml,置于-80℃液氮中保存待检测相关指标。
1.4观察指标 采用黄嘌呤氧化法和硫代巴比妥酸显色法分别测定大鼠血清MDA浓度和SOD活力,并按试剂盒说明书操作测钠钾ATP酶活力,并检测肝功能及脂质代谢水平。
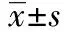
2 结 果
2.1左卡尼汀对MDA浓度的影响 左卡尼汀及生理盐水对照组大鼠MDA含量均显著高于假手术组(均P<0.05)。与对照组相比,左卡尼汀组大鼠MDA含量明显降低;不同浓度左卡尼汀组大鼠的MDA含量也有差异,随左卡尼汀给药浓度增加MDA下降水平也会增加,呈现剂量依赖性,左卡尼汀200 mg·kg-1·d-1对大鼠MDA含量的抑制作用最显著,见表1。
2.2左卡尼汀对SOD活性的影响 如表1所示,左卡尼汀及生理盐水对照组大鼠SOD活性均低于假手术组。左卡尼汀组大鼠SOD活性显著高于对照组;大鼠SOD活性与左卡尼汀亦呈浓度依赖性,随左卡尼汀给药浓度增加SOD活性逐渐增加,左卡尼汀200 mg·kg-1·d-1时大鼠SOD活性最强。
2.3左卡尼汀对ATP酶活力的影响 相对于对照组而言,左卡尼汀组大鼠ATP酶活力显著提高,同样呈现左卡尼汀剂量依赖性,左卡尼汀浓度越高其ATP酶活力越强,左卡尼汀200 mg·kg-1·d-1时大鼠ATP酶活力也最强。
2.4左卡尼汀对肝功能及脂质代谢的影响 与生理盐水对照组相比,不同浓度左卡尼汀组大鼠肝组织TG和TC含量显著下降,而血清ALT和AST活性显著升高,左卡尼汀200 mg·kg-1·d-1时大鼠TG和TC下降最明显而ALT和AST活性升高最明显,见表1。

表1 各组MDA浓度、SOD活性和ATP酶活力、肝功能及脂质代谢的差异
3 讨 论
左卡尼汀在脂肪代谢中起重要作用〔5〕。是脂肪酸进入线粒体进行β-氧化所必需的辅助因子,与脂肪酸的利用厦能量生成密切相关〔6〕。左卡尼汀对心肌缺血低氧的保护作用受到公认,它在临床上广泛应用于心肌梗死、中重度心力衰竭及体外循环手术患者〔7〕,但关于其在短肠综合征治疗中的作用,目前尚知之甚少。
本实验证明随左卡尼汀给药浓度增加MDA下降水平也会增加,呈现剂量依赖性,并且当左卡尼汀给药浓度越高对大鼠MDA含量的抑制作用也越显著。对于对照组而言,左卡尼汀组大鼠SOD活性、ATP酶活力显著提高,呈现左卡尼汀剂量依赖性,左卡尼汀浓度越高其SOD活性逐渐增加、ATP酶活力也越强。与生理盐水对照组相比,不同浓度左卡尼汀组大鼠肝组织TG和TC含量显著下降,而血清ALT和AST活性显著升高,左卡尼汀浓度越高时大鼠TG和TC下降最明显而ALT和AST活性升高最明显,与对照组比差异有统计学意义。研究表明,短肠综合征病人在很大程度上依赖肠外营养(PN)支持得以生存,而长期PN可产生各种并发症,从而使得PN难以继续,严重者甚至危及病人生命〔8〕。早期并发症主要是水电解质平衡问题,而晚期并发症则包括贫血、营养不良、必需脂肪酸缺乏、维生素微量元素缺乏、低钙低镁、肝损害、胆汁淤积、骨病等〔9〕。本实验证明,左卡尼汀能够促进脂肪酸氧化,又能使脂肪转化成为能量,通过增加ATP含量,预防和减轻心肌损伤,改善肝脏的脂质代谢、减少脂肪沉积,为短肠综合征患者的全肠外营养治疗显示出良好效果。
本文结果证明,左卡尼汀可能有助于减少短肠综合征模型大鼠全肠外营养治疗后心力衰竭、肝功能损伤等情况的发生。
4 参考文献
1Westergaard H.Short bowel syndrome 〔J〕.Semin Gastrointest Dis,2002;13(4):210-20.
2Cole CR,Ziegler TR.Small bowel bacterial overgrowth:a negative factor in gut adaptation in pediatric SBS〔J〕.Curr Gastroenterol Rep,2007;9(6):456-62.
3杨 勇,贾国良,郭文怡,等.左旋卡尼汀对培养乳鼠心肌细胞模拟缺血再灌注损伤的保护作用〔J〕.第四军医大学学报,2004;25(2):134-7.
4郭文怡,杨 勇,贾国良,等.左旋卡尼汀对缺氧/复氧诱导的心肌细胞氧化,凋亡影响的体外研究〔J〕.中国病理生理杂志,2005;21(1):72-6.
5He MD,Xu SC,Lu YH,etal.L-carnitine protects against nickel-induced neurotoxicity by maintaining mitochondrial function in Neuro-2a cells 〔J〕.Toxicol App Pharmacol,2011;253(1):38-44.
6Serati AR,Motamedi MR,Emami S,etal.L-carnitine treatment in patients with mild diastolic heart failure is associated with improvement in diastolic function and symptoms 〔J〕.Cardiology,2010;116(3):178-82.
7Di Nicolantonio JJ,Lavie CJ,Fares H,etal.L-carnitine in the secondary prevention of cardiovascular disease:systematic review and meta-analysis 〔J〕.Mayo Clin Proc,2013;88(6):544-51.
8袁 磊,吴国豪.短肠综合征病人的营养支持〔J〕.中国实用外科杂志,2005;25(11):691-3.
9任建安,黎介寿.短肠综合征代谢并发症的防治〔J〕.中国实用外科杂志,2005;25(11):653-5.

