键合表阿霉素纳米胶束在移植性肝癌大鼠体内分布及药效
宋晓斌 李晨玉 杨 威 方晓白 刘铜军 景遐斌
(吉林省人民医院急诊外科,吉林 长春 130021)
表阿霉素(EPI)是目前肝癌治疗的一线用药,但传统的小分子化疗药缺乏肿瘤特异性,会同时杀伤正常组织细胞。纳米靶向控释系统与药物的结合可以提高药效和降低药物副作用,本文以EPI为前体药物,选择具有肿瘤靶向呈递作用的聚乙二醇-b-聚乳酸-co-碳酸酯聚合物〔PEG-b-P(LA-co-DHP)〕为载体材料,制备具有靶向控释作用的键合EPI纳米胶束(EPI-NPs),通过肝动脉灌注给药应用于大鼠移植性肝癌模型,利用EPI具有自发荧光的特点研究EPI-NPs在大鼠体内脏器的分布,探讨EPI-NPs的靶向控释机制及抑瘤效果。
1 材料与方法
1.1材料 EPI原药纯度约98%,购自浙江海正制药有限公司。空白胶束及EPI-NPs由中国科学院长春应用化学研究所制备。EPI-NPs平均粒径为86 nm,EPI的质量含量为14.7%。Walker-256瘤株购自北京医科院肿瘤研究所。Wistar幼鼠(120~140 g)、Wistar大鼠(180~220 g)由吉林大学动物研究中心提供,均为雄性。
1.2Walker-256细胞的复苏及传代 复苏Walker-256瘤株,体外培养至细胞数2×106ml-1。取1 ml细胞悬液注入幼鼠腹腔,制作传代鼠。7 d后从传代鼠腹腔内抽取癌性腹水观察,见腹水呈乳白色或淡血性。将腹水原液离心、洗涤、再次离心,弃上清液保留下层的半液态物,以生理盐水调整细胞数为3.5×107个/ml,注入幼鼠腹腔继续传代或试验用。按上述方法每7 d传代1次。
1.3直接注射法制作大鼠转移性肝癌模型 麻醉、固定样本大鼠,小切口开腹后均选取肝左叶种植肿瘤。用1 ml注射器抽取前述瘤细胞悬液,斜行进针刺入肝被膜,然后进针方向改为水平并做迷路穿刺,将肿瘤细胞0.05 ml注入肝被膜下。拔针后按压穿刺点止血并关腹。
1.4肝动脉灌注给药 于种瘤后8 d,麻醉模型鼠,再次开腹后显露肝脏及肿瘤,游标卡尺测定肿瘤长短径。手术显微镜下分离肝动脉,用1 ml胰岛素注射器行肝动脉穿刺并缓慢注药。注药结束后立即以无菌棉签按压动脉穿刺口止血。
1.5药物体内分布观察 将模型鼠(n=84只)随机分为EPI组和EPI-NPs组,均按EPI含量2 mg/kg给药。设7个时间点,每组大鼠于每个时间点均随机选取6只处死,进行匀浆荧光检测。从肝脏剥离肿瘤并称重;摘取模型鼠体内脏器(肝、脾、肺、肾、心、脑),于每个脏器不同部位随机剪取6块组织并称重。将上述组织按照20 ml/g的比例添加双蒸水,使用组织匀浆机(T10 basic ULTRA-TURRAX)分别匀浆。取匀浆液200 μl加至96孔板,使用酶标仪对荧光强度做定量分析。
1.6药效观察 (1)抑瘤率:①动物分组:在肝脏移植肿瘤8 d后,将肿瘤直径约1.0 cm的模型鼠(CT扫描证实,n=30)随机分为生理盐水组、EPI组和EPI-NPs组(n=10)。给药前先用游标卡尺测量瘤径,计算治疗前肿瘤体积;按前述剂量、方法给药。②药效观察:给药1 w后处死大鼠,从肝脏完整剥离肿瘤,测量瘤径并称重,计算治疗后肿瘤体积及瘤重。按下面公式计算体积抑瘤率和质量抑瘤率(△V=治疗后体积-治疗前体积)。体积抑瘤率(%)=(1-实验组△V/生理盐水组△V)×100%;质量抑瘤率(%)=(1-实验组平均瘤重/生理盐水组平均瘤重)×100%。(2)生存分析:动物分组及给药方式同上。自然饲养,术后常规肌注青霉素预防感染,观察大鼠存活时间并做生存分析。
1.7统计学方法 采用SPSS17.0统计软件进行Student-t检验和Kaplan-Meier生存分析。
2 结 果
2.1匀浆荧光定量检测EPI和EPI-NPs在大鼠体内分布 除脑组织外,EPI荧光在模型鼠其他脏器组织的分布及变化趋势基本一致,在EPI进入体内后有个“减弱-增强-再减弱-消失”的过程,在给药2 h后再次形成分布高峰,但低于起始荧光强度。在脑组织,起始荧光强度较低,而后逐渐增强并在2 h亦出现分布高峰,此时其荧光强度同其他组织比较无统计学差异。EPI-NPs组各组织中药物荧光强度表现为肿瘤>肝>脾、肺、肾>心>脑,除脑外的其他脏器组织药物荧光变化趋势基本一致,分别在15 min、2 h形成2个分布高峰,第2峰高于第1峰。8 h时,在除了心和脑外的其他组织仍保持了一定程度的荧光富集。脑组织在所有时间点上检测不到荧光。见图1。
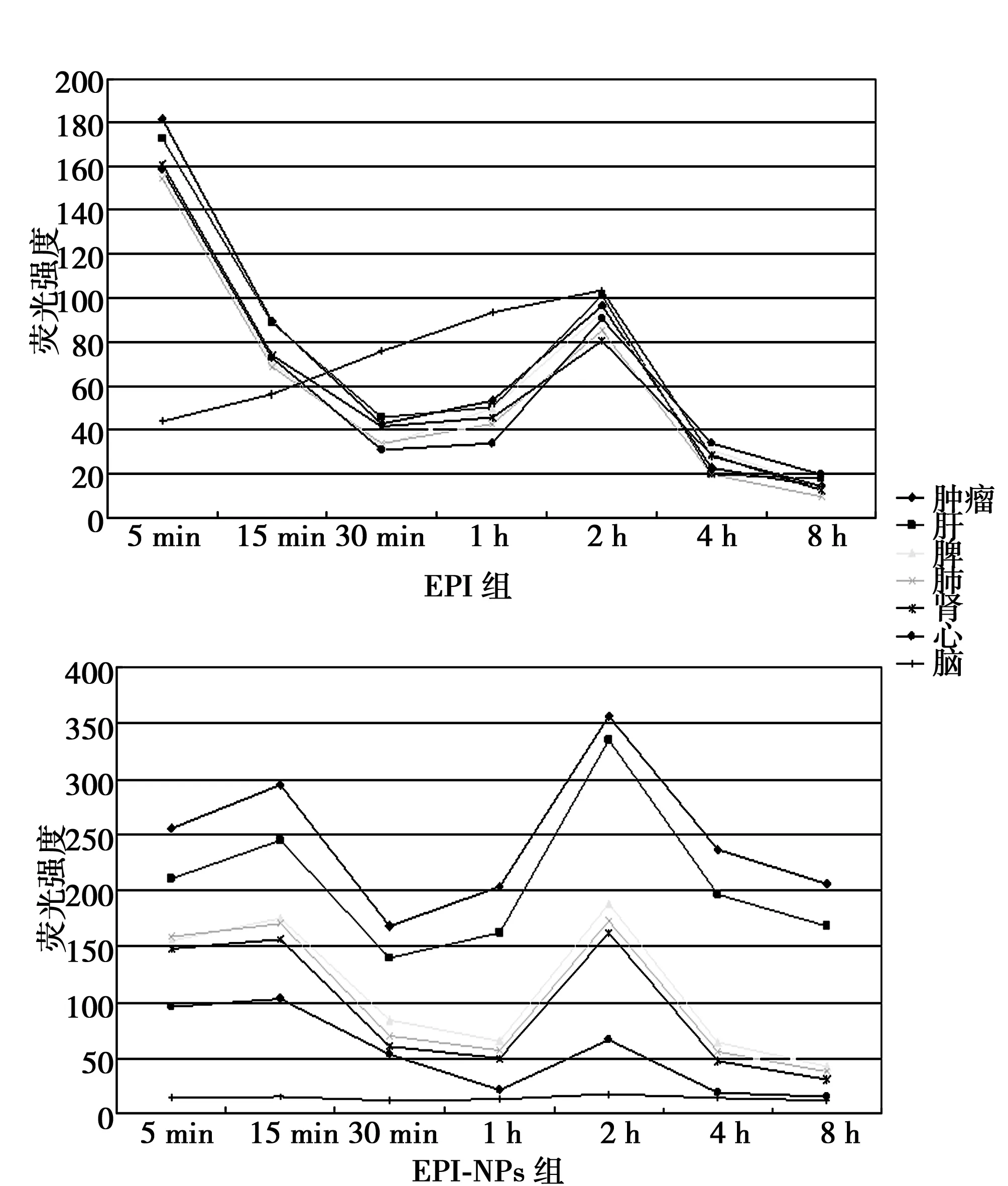
图1 EPI和EPI-NPs组药物荧光在模型鼠体内的分布
2.2药物的抑瘤效果检测 各组大鼠给药后1 w,体积抑瘤率及质量抑瘤率分析均提示EPI-NPs组的抑瘤效果明显高于EPI组(P<0.05),而EPI组的抑瘤效果明显高于生理盐水组(P<0.05),即EPI-NPs组>EPI组>NS组,见表1。

表1 各组体积抑制率和质量抑制率比较
2.3生存分析 生理盐水组、EPI组、EPI-NPs组大鼠的中位生存时间分别为(16±0.93)、(27.2±2.25)、(43.3±3.98)d,3组差异显著(P<0.01),并且EPI-NPs组有2只大鼠60 d实验结束时仍然存活,表明EPI和EPI-NPs对肿瘤治疗有效,可以延长荷瘤大鼠存活时间, EPI-NPs效果更为显著。见图2。
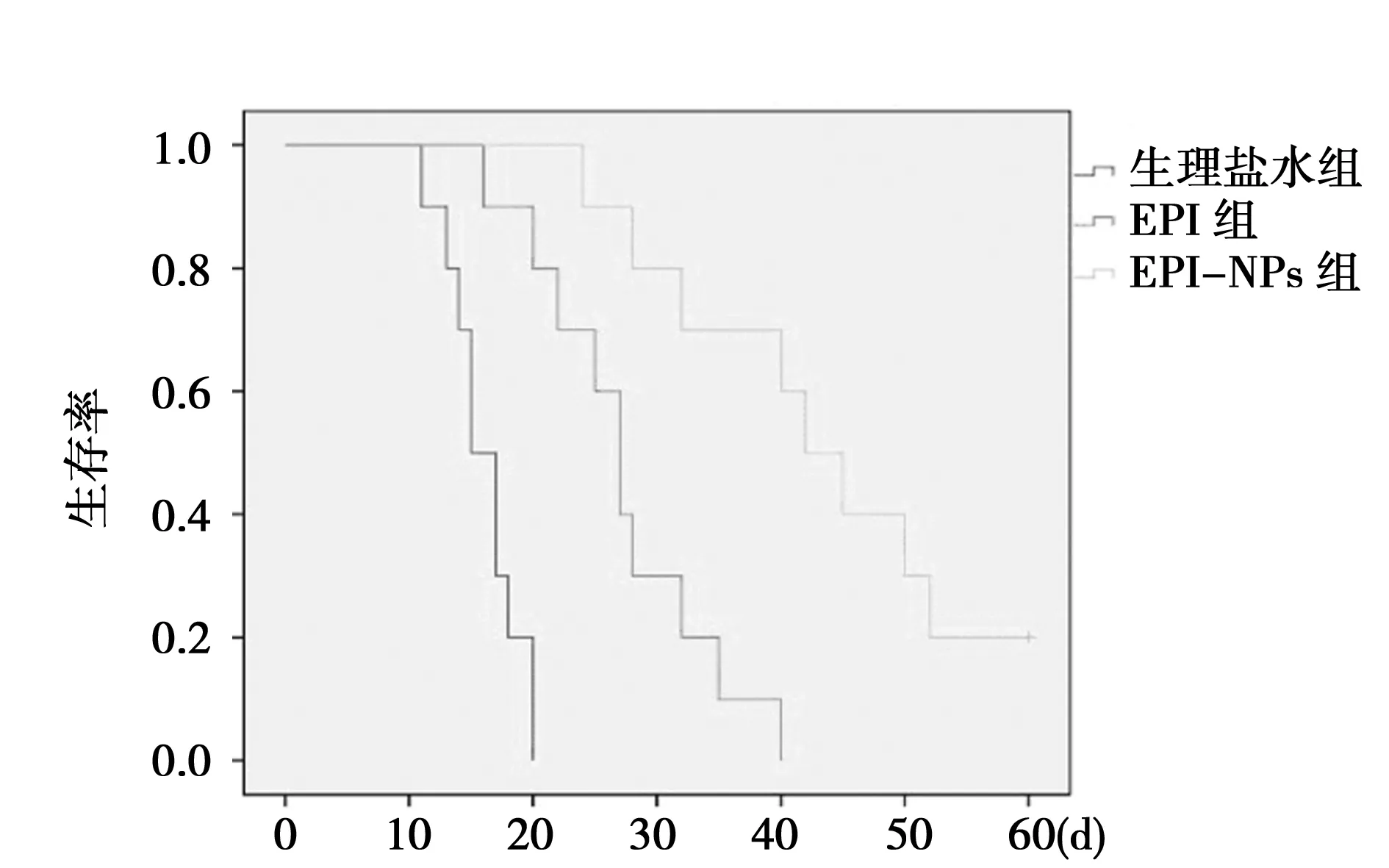
图2 NS组、EPI组和EPI-NPs组生存率的比较
3 讨 论
传统的EPI小分子药在体内是平均分布的,为了使该药能够在靶器官和靶组织达到有效的药物浓度,提高药物疗效并降低其全身副作用,将EPI通过酸降解的腙键与纳米载体键合形成EPI-NPs,使其具有良好的pH靶向性和被动靶向功能〔1〕,进而实现EPI在靶器官和靶组织的重分布。
通过肝动脉灌注直接给药,富含药物的肝动脉血基本上提供了肿瘤组织的全部血供〔2,3〕,而EPI-NPs平均粒径为86 nm,“增强的通透性和滞留效应”(EPR效应)使高分子键合药在肿瘤局部发生滞留〔4~6〕,所以肿瘤组织的EPI荧光强度高于体内其他脏器,体现了键合药良好的组织靶向性。肝脏亦有大量药物荧光富集,这是纳米药物“肝脏被动靶向机制”的具体体现〔7,8〕,说明键合药具有良好的器官靶向性。肝内含有丰富的网状内皮系统(RES),大量吞噬EPI-NPs后成为了药物“贮库”。在吞噬细胞内酸性的环境中,键合药良好的pH靶向性(载体连接药物的腙键为酸降解性)使小分子EPI从键合载体上游离出来并持续释放入肝血窦,这样就在一定程度上控制了药物在靶器官内的缓慢释放。载药纳米粒首先要经过肝而被肝内RES大量吞噬,然后再随血液循环陆续通过同样富含RES的肺、脾、肾,且首过效应亦使部分EPI在肝内被代谢和灭活,从而使药物在上述脏器分布有所降低。在脑组织中未测到药物荧光,这同血脑屏障的存在有关:正常血液的pH值是7.4,酸降解的键合大分子药在血液循环过程中很难释放出可以通过血脑屏障的EPI小分子药,这就形成了脑组织中基本无药物分布的状态〔9〕。
除了脑组织外,各脏器药物荧光在15 min和2 h形成了两个分布高峰,出现“双峰现象”。分析这是由肝脏的双峰现象引起〔10〕:15 min时的“第一峰”同键合药在肿瘤组织的滞留有关,即因为EPR效应,纳米药物离开靶组织的速度要低于进入速度,药物在肿瘤组织中出现了蓄积。而2 h形成的“第二峰”则考虑同药物的“肝肠循环”有关。肝内药物浓度升高引起循环血药浓度增加,继而使肺、心、脾、肾的药物分布的增加。“双峰现象”不仅延长了药物在靶器官的作用时间,而且增加了靶器官内药物的分布比例,这对于肝脏肿瘤的化疗无疑是有利的。本文结果证明EPI-NPs可以通过其靶向和控释机制,将EPI靶向释放于肝组织特别是肝内的肿瘤组织,降低了EPI的全身及肝脏局部的毒副作用,使大鼠存活时间得以延长。
综上,具有被动靶向和pH靶向的双重靶向特点EPI-NPs可以较精确地靶向于肝组织和肿瘤组织,不仅保证了对肿瘤细胞足够的细胞毒性,也降低了EPI的全身毒副作用,提高了EPI的生物利用度。
4 参考文献
1宋晓斌,刘铜军,胡秀丽,等.键合表柔比星纳米胶束对Walker-256细胞株的增殖抑制作用〔J〕.中国老年医学杂志,2011;31(5):843-6.
2Caperuto EA,Tomatieli RV,Colquhoun A,etal.β-Hydroxy-β-methylbutyrate supplementation affects Walker 256 tumor-bearing rats in a time-dependent manner〔J〕.Clin Nut,2007;26:117-22.
3Liu X,Heng WS,Paul A,etal.Novel polymeric microspheres containing norcantharidin for chemoembolization〔J〕.J Control Release,2006;116(1):35-41.
4李 坚,张阳德,赵劲风,等.表阿霉素聚氰基丙烯酸正丁酯磁性纳米粒靶向治疗裸鼠移植性肝癌〔J〕.中华实验外科杂志,2011;28(7):1111-4.
5Maeda H,Wu J,Sawa T,etal.Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review〔J〕.J Control Release,2000;65:271-84.
6Arias JL.Drug targeting strategies in cancer treatment:an overview〔J〕. Mini Rev Med Chem,2011;11(1):1-17.
7Jin C,Qian N,Zhao W,etal.Improved therapeutic effect of DOX-PLGA-PEG micelles decorated with bivalent fragment HAb18 F(ab') for hepatocellular carcinoma〔J〕.Biomacromolecules,2010;11:2422-31.
8Yuan L,Wang J,Shen WC.Reversible lipidization of somatostatin analogues for the liver targeting〔J〕.Eur J Pharm Biopharm,2008;70:615-20.
9宋晓斌.键合表阿霉素纳米胶束肝动脉灌注靶向治疗大鼠移植性肝癌的实验研究〔D〕.长春:吉林大学博士学位论文,2011:100-2.
10李晨玉,宋晓斌,杨 威,等.表阿霉素纳米胶束靶向治疗大鼠移植性肝癌〔J〕.中华实验外科杂志,2013;30(10):2052-5.

