硫辛酸对糖尿病肾病大鼠的血清晚期糖基化终末产物及氧化应激的影响
孙凤娟 刘亚平
(济宁市第一人民医院内分泌二科,山东 济宁 271000)
近年来,氧化应激在糖尿病肾病(DN)发病机制中作用引起人们的广泛关注〔1〕,而高糖介导的肾小球和肾小管细胞凋亡是引起肾功能恶化的一个重要原因〔2〕,有研究指出,高糖高脂饲料联合链脲佐菌素(STZ)诱导的糖尿病大鼠造模成功后喂养6~8 w,肾脏已出现形态学改变〔3〕,本研究探讨硫辛酸(LA)对DN大鼠的血清晚期糖基化终末产物(AGEs)及氧化应激的影响,并观察肾脏AGE(RAGE)的表达情况。
1 材料和方法
1.1材料 3月龄健康雌性Wistar大鼠30只〔山东大学实验动物中心提供,合格证号:SCXR(鲁)20030004〕,平均体重(276.36±7.79)g。普通饲料和高糖高脂饲料(普通饲料中添加10%猪油、10%蛋黄粉和20%蔗糖)〔4〕均由山东大学实验动物中心提供。STZ购自Sigma公司,用前以0.1 mmol/L,pH4.2的柠檬酸盐缓冲液溶解,新鲜配成2%STZ溶液,经滤菌器除菌。
1.2方法
1.2.1造模 实验前大鼠适应性喂养1 w,按体重编号,随机取6只作正常组,喂以普通饲料。余24只大鼠作糖尿病造模组,高糖高脂饲料喂养8 w(不限每日热量),禁食12 h后左下腹腔注射STZ(30 mg/kg,隔2 w 1次,共2次),正常对照组注射等量柠檬酸盐缓冲液。末次STZ注射1 w后糖尿病造模组尾静脉行腹腔内葡萄糖耐量试验(IPGTT)〔5〕。以空腹血糖(FPG)≥7.0 mmol/L,或糖负荷后2 h血糖≥11.1 mmol/L者为糖尿病造模成功鼠〔6〕。继续喂养8 w,糖尿病大鼠以随机血糖≥16.0 mmol/L伴胰岛素敏感性下降,并出现微量白蛋白尿为糖尿病肾病造模成功鼠〔3〕,剔出因感染死亡和造模未成功的大鼠,入选DN造模成功鼠为16只,按血糖水平随机分为DN组和LA组,每组8只,分别给予生理盐水和LA(50 mg·kg-1·d-1)1 ml腹腔注射4 w,每周按体重调整各组注射剂量。
1.2.2观察指标 成模后所有大鼠每周固定时间测随机血糖和体重,共观察4 w。实验结束时,三组大鼠留取24 h尿,检测尿蛋白,次日空腹8 h后颈动脉穿刺取血处死。分离血清以检测FPG、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白酶固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)(比色法,全自动生化分析仪);血清胰岛素(FINS)(试剂盒购自天津九鼎医学生物有限公司,批内变异系数<10%,批间变异系数<15%,由我院核医学科测定)、丙二醛(MDA)、硫代巴比妥酸(TBA)分光光度法、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)(试剂盒均购自南京建成);抗凝血糖化血红蛋白(GHbA1c)(比色法,试剂盒购自南京建成);用荧光分光光度计在340 nm波长激发光和456 nm发射光下,考马斯亮蓝法测定稀释液的蛋白质浓度,以此血清AGEs含量间接反映肾组织AGEs含量。提取三组大鼠肾脏总RNA,利用RT-PCR方法检测大鼠肾脏RAGE基因表达。计算胰岛素敏感指数(IAI)=In(1/FINS×FPG),HOMA-IR=FPG×FINS/22.5〔2〕。
1.2.3仪器设备 RF5301PC型紫外荧光分光光度计(日本岛津)、MDF-382E型Ultra-low Temperature Freezer(日本SANYO电子化学有限公司)、ZDX-35型自动不锈钢座式压力蒸汽灭菌器(上海申安医疗器械厂)、DYY-12型电泳槽(北京六一仪器厂)、Alpha MutiImage Light Cabinet Filter Positions凝胶成像系统。
1.3统计学处理 应用SPSS14.0统计软件进行t检验和方差分析。
2 结 果
2.1三组大鼠体重、随机血糖的变化 与普通饲料喂养的正常组大鼠比较,造模组大鼠高脂饮食8 w后体重明显增加(P<0.01),增重8.8%,此后DN组及LA组体重有所下降,至实验结束,DN组大鼠体重显著高于正常组,LA组与正常组无显著性差异;单纯高脂饮食8 w,两组大鼠血糖没有显著性差异,注射两次STZ 1 w后DN造模组大鼠血糖明显升高并且高血糖症持续存在,随机血糖平均(16.82±7.68)mmol/L,LA组随机血糖平均(13.36±5.72)mmol/L。
2.2三组大鼠血AGEs、胰岛素及胰岛素抵抗(IR)等的变化 与正常组比较,DN组和LA组大鼠血AGEs、GHbA1c、FPG、FINS及HOMA-IR均升高,IAI下降(P<0.01),说明存在IR;与DN组大鼠比较,LA组大鼠血AGEs、GHbA1c、FPG、FINS及HOMA-IR下降(P<0.05),IAI上升(P<0.05)。见表1。
2.3三组大鼠血脂、24 h尿蛋白水平的变化 与正常组比较,DN组大鼠血TC、TG、LDL-C、24 h尿蛋白均升高(P均<0.05),说明存在脂代谢、肾功能紊乱;与DN组大鼠比较,LA组大鼠血TC、TG、LDL-C、24 h尿蛋白下降(P<0.05);三组大鼠HDL-C无明显变化。见表2。
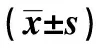
表1 三组大鼠血AGEs、GHbA1c、FPG、FINS、IAI、HOMA-IR的比较
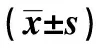
表2 三组大鼠血脂的比较
2.4三组大鼠氧化应激指标的变化 与正常组比较,DN组大鼠血MDA、SOD均升高(P<0.05),与DN组比较,LA组血MDA、SOD均下降,血GSH-Px增加,但差异无显著性(P>0.05)。见表3。
2.5三组大鼠RAGE的RT-PCR结果 肾组织总RNA OD260/OD280均介于1.7~2.0之间,说明总RNA纯度较高,基本没有蛋白质污染。甲醛变性琼脂糖凝胶电泳示28S与18S的光密度比值约为2,说明总RNA的完整性较好,基本无降解。LA组和DN组均检测到肾脏组织RAGE的表达,正常对照组未检测到RAGE表达。见图1。
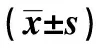
表3 三组大鼠血MDA、GSH-Px、SOD的比较
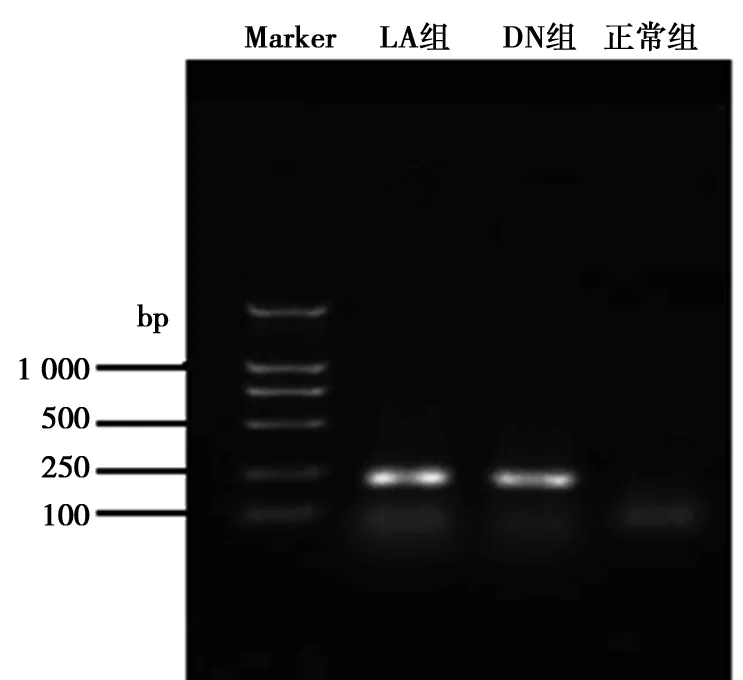
图1 三组大鼠肾脏RAGE基因的PT-PCR
3 讨 论
肥胖患者体内氧化应激水平升高,容易诱发多种慢性疾病,如肿瘤、糖尿病、心脑血管疾病等〔7〕,使用有效的抗氧化剂对降低上述慢性疾病的发生具有重要意义。本实验对以往的研究方法〔3,5〕,采用高糖高脂饲料喂养结合腹腔两次小剂量STZ注射的方法诱导建立雌性大鼠糖尿病模型,结果该模型大鼠的血糖、GHbA1c升高,空腹FINS、HOMA-IR升高,高糖高脂喂养8 w后体重增重8.8%,并具有脂代谢紊乱的特点,比较接近人类2型糖尿病的发病特征,继续喂养8 w造模组大鼠24 h尿蛋白显著升高,是研究人类2型DN较理想的动物模型。LA干预后,上述指标均有显著性下降,提示其可以针对自由基对胰岛细胞、血管内皮的攻击产生保护作用〔8〕。本实验糖尿病组大鼠SOD升高,可能是机体采取的适应性反应〔9〕。
糖尿病时,葡萄糖等还原糖可与蛋白质、脂质、核酸在非酶糖化条件下形成AGEs并在体内沉积;炎症、肾功能不全和神经衰退性疾病时,氧化应激增加也可产生大量的AGEs〔10〕,程序性死亡配体(PDL)1与其受体PD1途径传递抑制信号,减弱免疫应答,抑制细胞增殖及释放细胞因子,杜宣等〔11〕发现AGEs作用下的人脐静脉血管内皮细胞株(HUVEC)表面PDL1分子呈上调性表达,进一步实验证实,外源性AGEs可诱导HUVEC过量表达单核细胞趋化蛋白1、细胞间黏附分子(ICAM)1、血管细胞黏附分子(VCAM)1等促炎因子〔12〕,而LA能逆转此现象,可以推测LA减轻糖尿病患者血管炎症部位的内皮细胞的炎性反应。在糖尿病人或动物模型时,视网膜、系膜细胞和主动脉上均有伴AGEs沉积的高水平的RAGE表达。AGEs-RAGE结合后,可诱导产生氧化应激,生成大量氧自由基,从而激活对氧自由基敏感的转录因子核因子(NF)-κB,从而诱导细胞因子胰岛素样生长因子(IGF)-1、肿瘤状死因子(TNF)-α和黏附分子的产生,导致肾小球、肾小管细胞的分化、生成和作用受损。本实验提示LA可能通过干预上述通路发挥肾脏保护作用。
DN的发病机制中存在氧化应激〔1,13〕,体外试验证实高糖本身直接加剧体外培养的内皮细胞和肾小球系膜细胞的氧化应激〔14,15〕。饮食中加入抗氧化剂能预防和减轻糖尿病慢性并发症,Craven等〔16,17〕指出维生素E、维生素C、α-LA等能减轻糖尿病肾损害,每天大剂量维生素E摄入(1 600~1 800 IU/d)或者短期(3个月)口服LA(300~600 mg/d)能减轻1型和2型临床糖尿病肾病患者的尿蛋白,并且减轻1型糖尿病患者早期肾脏高滤过〔18〕,与此同时Melhem等〔17〕发现糖尿病大鼠每天摄入维生素C(1 g/kg)、维生素E(100 IU/kg)2个月,并没有持续抑制尿白蛋白排泄率、肾小球体积、肾小球或肾小管TGF-β含量、肾小球Ⅳ型胶原α1含量,相反,每天给予LA(30 mg/kg)组糖尿病大鼠,上述指标及MDA显著性下降,提示LA通过氧化应激参与有效的肾脏保护机制。本实验与前述研究结果相符。
本实验LA干预后血AGEs含量减少,肾组织中检测出RAGE表达,支持李雪竹等〔19〕的研究,其实验指出LA治疗组24 h尿蛋白定量减少,肾小球系膜扩张、基质增生、肾小管上皮空泡变性等病理改变减轻,MDA和尿中DNA氧化损伤标志物8-羟基脱氧鸟苷(8-OHdG)水平下降,过氧化物酶(CAT)和GSH增加,血AGEs含量减少,RAGE表达下调,提示DN时循环和肾组织局部AGEs含量增高,RAGE表达上调,LA可通过减少氧化应激而抑制AGEs生成及下调RAGE表达,进而改善DN大鼠肾组织结构和肾功能,在防治DN方面有良好的应用前景。
4 参考文献
1Vasavada N,Agarwal R.Role of oxidative stress in diabetic nephropathy〔J〕.Adv Chronic Kidney Dis,2005;12(2):146-54.
2Menini S,Iacobingi C,Oddi G,etal.Increased glomerular cell(podocyte) apoptosis in rats with streptozotocin-induced diabetes mellitus:role in the development of diabetic glomerular disease 〔J〕.Diabetologia, 2007;50(12):2591-9.
3宋恩峰,刘晶晶,贾汝汉.2型糖尿病肾病大鼠模型制备研究〔J〕.实用医学杂志,2007;23(18):2840-2.
4李爱卿,王志慧,赵跃斌.高糖高脂饲料诱导2型糖尿病大鼠模型〔J〕.临床医药实践杂志,2005;14(2):130-1.
5Vital P,Larrieta E,Hiriart M.Sexual dimorphism in insulin sensitivity and susceptibility to develop diabetes in rats〔J〕.Endocrinol,2006;190:425-32.
6司晓晨,尚文斌,卞慧敏,等.链脲佐菌素加高脂膳食诱导2型糖尿病大鼠模型〔J〕.安徽中医临床杂志,2003;15(5):383-5.
7Packer L,Kraemer K,Rimbach G.Molecular aspects of lipoic acid in the prevention of diabetes complications 〔J〕.Nutrition,2001;17:888-95.
8Bhatti F,Mankhey RW,Asico L,etal.Mechanisms of antioxidant and pro-oxidant effects of alpha-lipoic acid in the diabetic and non-diabetic kidney〔J〕.Kidney Int,2005;67(4):1371-80.
9Arivazhagan P,Ramanathan K,Panneerselvam C.Effect of DL-lipoic acid on mitochondrial enzymes in aged rats〔J〕.Chem Biol Int,2001;138(2):189-98.
10Sousa MM,Du Yan S,Fernandes R,etal.Familial amyloid polyneuropathy:receptor for advanced glycation end products-dependent triggering of neuronal inflammatory and apoptotic pathways〔J〕.Neurosci,2001;21:7576-86.
11杜 宣,施毕旻,陈永井,等.硫辛酸对AGEs作用下血管内皮细胞PDL1表达的影响〔J〕.江苏医药,2011;37(3):249-51.
12Basta G,Schmidt AM,de Caterina R.Advanced glycation end products and vascular inflammation:implications for accelerated atherosclerosis in diabetes〔J〕.Cardiovasc Res,2004;63(4):582-92.
13Baynes J,Thorpe S.The role of oxidative stress in diabetic complications:a new perspective on an old paradigm〔J〕.Diabetes,1999;48:1-19.
14Nishikawa T,Edelstein D,Du XL,etal.Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage〔J〕.Nature,2000;404:787-90.
15Du XL,Edelstein D,Rossetti L,etal.Hyperglycemia-induced mitochondrial superoxide overproduction activates the hexosamine pathway and induces plasminogen activator inhibitor-I expression by increasing Sp1 glycosylation〔J〕.Proc Natl Acad Sci USA,2000;97:12222-6.
16Craven P,DeRubertis R,Kagan VE,etal.Effects of dietary supplementation with vitamin C or E on albuminuria,glomerular TGFβ and size in diabetes〔J〕.Am Soc Nephrol,1997;8:1405-7.
17Melhem MF,Craven PA,de Rubertis FR.Effects of dietary supplementation of α-lipoic acid on early glomerular injury in diabetes〔J〕.Am Soc Nephrol,2001;12:124-33.
18Bursell S,Clermont A,Aiello LP,etal.High-dose vitamin E supplementation normalizes retinal flow and creatinine clearance in patients with type 1 diabetes〔J〕.Diabetes Care,1999;22:1245-51.
19李雪竹,严海东,王 俊,等.银杏叶提取物、α-硫辛酸对糖尿病大鼠肾组织中糖基化终产物及其受体RAGE表达的影响〔J〕.中国中西医结合杂志,2011;31(4):525-31.

