糖尿病肾病患者血清血管内皮生长因子和血管生成素-2的测定及临床意义
张丰姣 康志强 王继萍 杨楠楠 何 丽 李清楚
(郑州大学附属郑州中心医院内分泌科,河南 郑州 450000)
研究显示,糖尿病肾病(DN)发展过程中存在着细胞因子介导的慢性低水平炎症反应〔1〕。血管内皮生长因子(VEGF)及血管生成素(Ang)-2可能参与DN 的发生和发展。本研究通过测定DN患者血清VEGF及Ang-2水平,探讨其在DN发生发展中的关系。
1 资料与方法
1.1对象 郑州大学附属郑州中心医院2010年9月至2013年6月部分住院2型糖尿病(T2DM)患者68例,其中糖尿病非肾病(DM1组):尿微量白蛋白排泄率(UAER)<20 μg/min,26例,男14例,女12例,平均年龄(53.1 ±10.0)岁,病程5.0 ~14.9年;DN患者分为两组,DM2组(UAER 20~200 μg/min)24例,男10例,女12例,平均年龄(54.4 ±12.8)岁,病程4.6~12.9年;DM3组(UAER>200 μg/min)18例,男8例,女10例,平均年龄(54.0 ±10.3)岁,病程4.6~12.9年。对照组20例,平均年龄(54.5 ±10.1)岁。入选标准:①DM组均按照WHO诊断标准诊断为T2DM;②对照组空腹血糖及糖耐量均正常。排除急性感染期、糖尿病酮症及心脏、肾脏疾病患者,同时伴有肿瘤、自身免疫性疾病者亦除外。
1.2方法 均于清晨采集空腹静脉血约3 ml,测定VEGF、Ang-2及糖化血红蛋白(HbA1c)。采用酶联免疫吸附试验ELISA法检测VEGF及Ang-2,试剂盒均购自深圳晶美生物工程有限公司,严格按试剂盒说明操作。
1.3统计学处理 采用SPSS19.0统计软件进行t检验。
2 结 果
2.1各组血清VEGF、Ang-2、HbA1c水平比较 DM组VEGF、Ang-2水平与对照组有显著差异(P<0.05);不同UAER DM组VEGF、Ang-2水平有显著差异(P<0.05)。见表1。
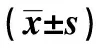
表1 各组血清VEGF和Ang-2水平比较
2.2VEGF、Ang-2相关性分析 DN患者血清VEGF与Ang-2水平呈正相关(r=0.93,P<0.05)。
3 讨 论
糖尿病肾病主要病理表现为肾小球毛细血管基膜增厚、肾小球细胞外基质积聚引起的微血管病变以及肾小球毛细血管通透性增高〔2〕,其实质是血流动力学及代谢紊乱导致的微血管病变,高血糖导致的代谢和血流动力学改变,触发细胞内信号分子,导致血管生长因子和细胞因子的异常激活,如VEGF和血管生成素,其在肾小球滤过屏障及结构功能改变中起重要作用。Ang-2和VEGF均与血管新生密切相关。研究显示,VEGF在DN的发生发展中起重要作用〔3〕。VEGF主要作用于血管内皮细胞的丝裂原,其基因表达受多种因素调控,如缺氧、缺血、高糖、高血压等,一般情况下其表达处于低水平,仅维持血管密度的生理稳态,在特殊因素刺激下其基因表达明显升高〔4〕,可通过改变内皮细胞的结构和功能、增加肾小球毛细血管的通透性、肾脏肥大等机制参与 DN 进展。Ang-2参与引发血管的重新塑型和内膜去稳定作用〔5〕。Ang-1及Ang-2均可与受体Tie2结合,Ang-1可诱导Tie2的磷酸化从而促进血管稳定;相反,Ang-2与Tie-2结合却拮抗Ang-1/Tie-2受体信号介导的血管内皮稳定作用〔6〕,使血管处于不稳定、可塑状态,形成不稳定渗漏性的血管;同时受其他促血管生成因子的刺激,在VEGF 存在时促进血管生成,缺乏时促进血管萎缩〔7〕。Benest等〔8〕体外研究也显示,Ang-2是多血管通透性诱导因子的关键。已有研究显示,Ang-2和VEGF与糖尿病视网膜病变相关,其水平与视网膜病变程度正相关〔9〕。Martynov等〔10〕的研究显示,VEGF和Ang-2水平与DN及其损害程度以及贫血相关。越来越多的证据表明低水平炎症反应在DN、视网膜病变及神经病变等微血管病变中起重要作用。也有研究指出把Ang-2及VEGF作为早期DN治疗的有效靶点的可能性。在糖尿病大鼠实验中,VEGF表达增加,而拮抗VEGF治疗后肾小球超滤状态、蛋白尿、肾小球肥大均有所改善〔11,12〕。
综上所述,VEGF和Ang-2均参与了DN 的发生、发展过程,其水平与DN严重程度呈正相关。因此,动态观察患者血清VEGF和Ang-2水平可帮助评价DN的病变程度。
4 参考文献
1Mora C,Navarro JF.The role of inflammation as a pathogenic factor in the development of renal disease in diabetes〔J〕.Curr Diab Rep,2005;5(6):399-401.
2Stehouwer CD,Schaper NC.The pathogenesis of vascular complications of diabetes mellitus:one voice or many〔J〕?Eur J Clin Invest,1996;26(7):535-43.
3辛 颖,娄能俊,邢海燕,等.血管内皮生长因子、转化生长因子在糖尿病肾病的改变及治疗后的变化〔J〕.细胞与分子免疫学杂志,2008;24(4):380-1.
4杨曦明,谢印芝,张东祥.血管内皮细胞生长因子与高原肺水肿发病的关系〔J〕.中华医学杂志,2000;80(12):931.
5Maisonpierre PC,Suri C,Jones PF,etal.Angiopoietin-2,a natural antagonist for Tie2 that disrupts in vivo angiogenesis〔J〕.Science,1997;277(5322):55-60.
6Thomas M,Augustin HG.The role of the angiopoietins in vascular morphogenesis〔J〕.Angiogenesis,2009;12(2):125-37.
7Satchell SC,Mathieson PW.Angiopoietins:microvascular modulators with potential roles in glomerular pathophysiology〔J〕.J Nephrol,2003;16(2):168-78.
8Benest AV,Kruse K,Savant S,etal.Angiopoietin-2 is critical for cytokine-induced vascular leakage〔J〕.PloS One,2013;8(8):e70459.
9Watanabe D,Suzuma K,Suzuma I,etal.Vitreous levels of angiopoietin 2 and vascular endothelial growth factor in patients with proliferative diabetic retinopathy〔J〕.Am J Ophthalmol,2005;139(3):476-81.
10Martynov SA,Shestakova MV,Kutyrina IM,etal.Role of circulating angiogenic factors in diabetic kidney disease〔J〕.Vestn Ross Akad Med Nauk,2013;2:35-42.
11Khoury CC,Ziyadeh FN.Angiogenic factors〔J〕.Contrib Nephrol,2011;170:83-92.
12de Vriese AS,Tilton RG,Elger M,etal.Antibodies against vascular endothelial growth factor improve early renal dysfunction in experimental diabetes〔J〕.J Am Soc Nephrol,2001;12(5):993-1000.

