转化生长因子β1对大鼠血管平滑肌细胞Smurf2和Ⅰ型胶原表达的影响
刘怡菲 褚昀赟 岑畅飞 刘先哲
(三峡大学人民医院,湖北 宜昌 443002)
转化生长因子β1(TGF-β1)作为强大的促纤维化细胞因子,与平滑肌细胞(SMCs)上受体结合活化胞内Smad信号通路,刺激细胞外基质(ECM)合成〔1〕,增加动脉粥样斑块的稳定性。Smad泛素调节因子2(Smurf2)是泛素连接酶E3 HECT家族成员,其能干扰TGF-β1细胞内经典的Smad信号转导途径中多个环节阻断TGF-β1信号转导〔2〕,从而减弱 TGF-β1纤维化作用。虽然Raines等〔3〕肾纤维化疾病中研究发现在肾小管上皮细胞中TGF-β1促进Smurf2基因和蛋白的表达水平,但在血管平滑肌细胞(VSMCs)中二者之间的关系尚未阐明。本实验选择以动脉粥样硬化为背景,研究在VSMCs中TGF-β1对Smurf2的作用,探讨不同浓度TGF-β1对Smurf2以及其后续产物ECM中Ⅰ型胶原(ColⅠ)的影响。
1 材料与方法
1.1材料 大鼠VSMCs A7r5(中科院上海细胞库)。低糖DMEM培养基、胎牛血清(FCS)(美国Gibco),TGF-β1(广州奕源生物科技有限公司),胰蛋白酶-EDTA(武汉博士德生物工程有限公司),反转录试剂盒(大连TAKARA公司),GoTaq GreenMaster Mix(美国Promega),TRIzol(上海华舜),Smurf2引物(上海生工生物工程技术服务有限公司),兔抗大鼠Smurf2抗体(美国Santa Cruz公司),辣根过氧化物酶标记山羊抗兔IgG(北京中山公司),大鼠ColⅠ ELISA试剂盒(上海蓝基生物科技有限公司)。
1.2方法
1.2.1细胞培养 A7r5用含10%胎牛血清的DMEM培养液,37℃,5% 二氧化碳(CO2)恒温条件下培养。取对数生长期细胞用于试验。随机分为:对照组(不含干预因素的正常培养的细胞)、TGF-β1(1、5、10 μg/L)3种浓度分别刺激24 h,每组均为4瓶细胞。
1.2.2RT-PCR法检测A7R5细胞中Smurf2 mRNA的表达量 根据 Trizol RNA说明书提取细胞总RNA。根据GenBank内的序列,采用Primer Premier5.0设计引物,序列如下:Smurf 2引物:正链 5′-GGG AAC GCC CAA CAA GAC-3′,反链 5′-ATT GCG GAT CTC CCA CCC-3′,368 bp;β-actin正链:5′-GCCATGTACGTAGCCATCCA-3′,反链:5′-GAACCGCTCATTGCCGATAG-3′,375 bp,逆转录条件按说明书操作即可。PCR扩增条件:94℃预变性5 min、94℃变性35 s、56℃复性35 s,72℃延伸45 s条件扩增30次。72℃补充延伸5 min。PCR产物经1.5%琼脂糖凝胶电泳,以1 000 bp DNA梯度标记上样作为分子量标记;以UVP凝胶图像扫描系统测目的基因与β-actin吸光度A比值,设对照组为1,试验重复3次。
1.2.3Western印迹检测Smurf2蛋白的表达 用4℃预冷的PBS洗细胞3次,加入300 μl含有蛋白酶抑制剂的细胞裂解缓冲液,置于冰上30 min,收刮细胞,4℃ 12 000 r/min离心15 min,取上清,BCA法测蛋白质浓度。各组取50 μg待测蛋白质样本,与蛋白质分子量标准品共同进行SDS-PAGE电泳,聚丙酰胺的积层胶浓度为5%,分离胶浓度为8%,将蛋白质转移至PVDF膜上,置5%脱脂奶粉封闭缓冲液中37℃ 60 min,TBS漂洗后分别加入兔抗大鼠Smurf 2抗体(1∶500),4℃过夜用TBS漂洗,充分洗膜后与辣根过氧化物酶标记山羊抗兔二抗(1∶3 000)37℃ 60 min,然后用TBS漂洗,ECL法显色,X光胶片曝光显影。试验重复3次。
1.2.4ELISA测细胞培养物上清中ColⅠ的表达 提取细胞上清液,10 000 r/min离心10 min除颗粒和聚合物,将标本放于-20℃或-80℃保存,用ELISA定量测定ColⅠ的浓度,按说明书操作即可。
1.3统计学分析 采用SPSS13.0软件进行单因素方差分析。
2 结 果
2.1TGF-β1对大鼠VSMCs Smurf2 mRNA水平的影响 对照组有一定量的Smurf2 mRNA表达(0.264 8±0.008 74),用TGF-β1(1、5、10 μg/L)分别刺激大鼠VSMCs 24 h后, Smurf2 mRNA的表达明显减弱(0.240 5±0.009 42、0.180 8±0.014 83、0.131 4±0.007 43),分别下降9.177%、31.722%和50.378%,且呈剂量依赖性,与对照组比较有显著差异(P<0.05),见图1。
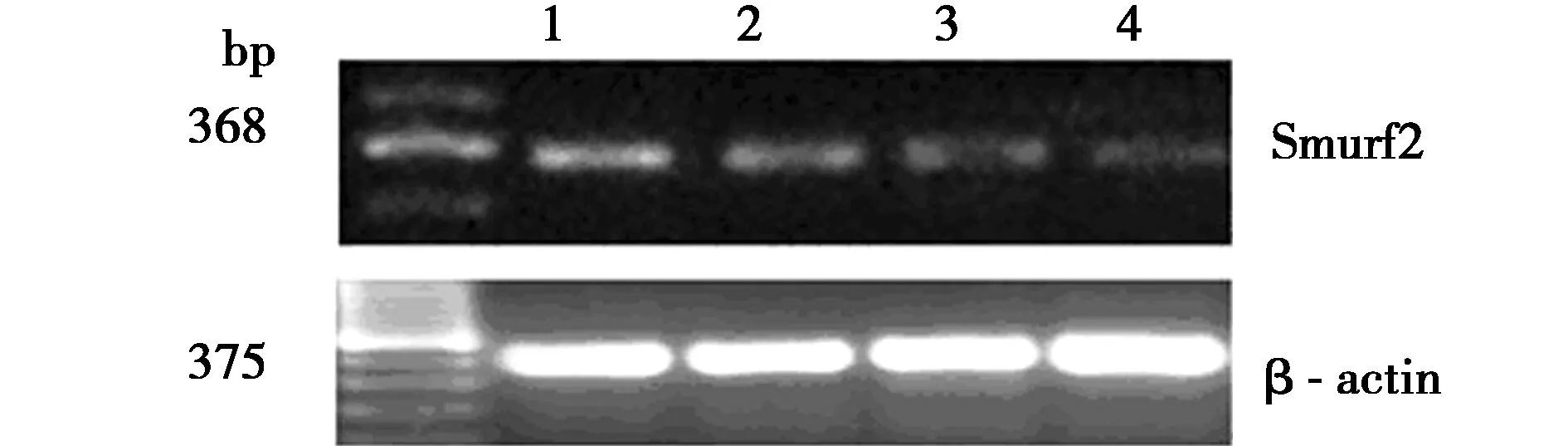
1:对照组; 2:TGF-β1(1 μg/L); 3:TGF-β1(5 μg/L); 4:TGF-β1(10 μg/L),下图同
2.2TGF-β1对大鼠VSMCs Smurf2蛋白表达的影响 对照组有一定量的Smurf2蛋白表达,用TGF-β1(1、5、10 μg/L)刺激大鼠VSMCs 24 h后, Smurf2蛋白的表达均明显降低,与对照组比较,分别下降了14.78%、18.63%和35.28%(P<0.05),且呈剂量依赖性。见图2。
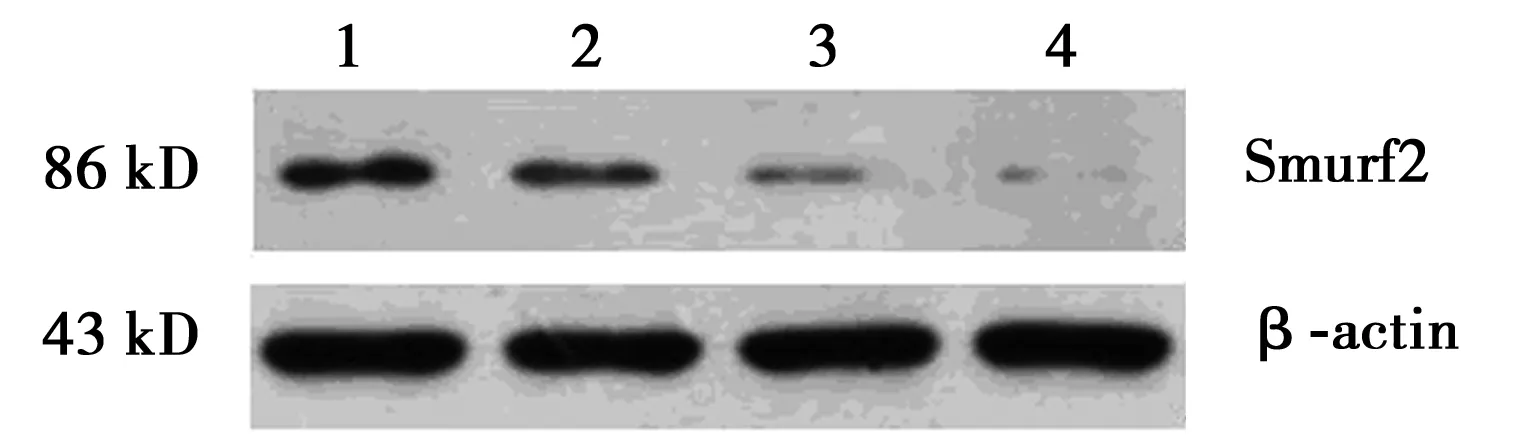
图2 不同浓度TGF-β1作用下Smurf2和内参蛋白免疫印迹结果
2.3TGF-β对大鼠VSMCs ColⅠ表达的影响 不同浓度TGF-β1作用于大鼠VSMCs 24 h后,ELISA检测细胞上清液中ColⅠ蛋白的表达量发现:同对照组相比,不同浓度TGF-β1作用下ColⅠ蛋白表达量均升高,分别是对照组的1.276 8、121.448 5和1.635 5倍(P<0.01),见图3。

图3 Ⅰ型胶原标准曲线
3 讨 论
既往的研究表明VSMC,是动脉粥样硬化斑块中最主要的细胞成分,各种生长因子对VSMC,转型、增殖的调节已成为动脉粥样硬化发病机制研究的热点〔4〕。Stefroni等〔4〕通过做血透发现伴有冠心病的患者血中TGF-β1水平明显低于无冠心病的患者,血TGF-β1水平每降低1 μg/L,心血管疾病相关威胁性增加9%,表明TGF-β1水平降低是导致动脉粥样硬化的独立威胁因子。进一步研究发现TGF-β1是强大的催纤维化因子,可刺激VSMCs产生ECM,增加纤维帽厚度〔1〕。这些研究结论与本研究结果是一致的。
Smurf2是C2-WW-HECT 结构域的E3 泛素连接酶家族的一员,在多种生物过程中扮演重要角色。Smurf2能干扰TGF-β1信号转导途径的多个重要环节阻断其信号转导〔5〕。高表达的Smurf2能降低TGF-βRI的表达水平〔6〕,最近研究表明TGF-βRⅡ也可以被Smurf2降解〔7〕。Smurf2能与Smad 2的脯-酪氨酸(PPXY)序列紧密结合,通过HECT结构域催化降解Smad 2。虽然Smad4分子的序列中没有PPXY模序,当Smurf2与I-Smad共同存在时,Smad 4与Smad 7通过各自的MH2区相结合,由Smad7介导其多泛素化而降解〔8~12〕。Smurf2通过对TGF-β1胞内Smad通路精细复杂地调节影响其细胞外基质的合成,在维持动脉粥样斑块的稳定性中起重要作用。
本研究结果显示TGF-β1可抑制VSMCs中Smurf2的表达,促进ColⅠ的表达。TGF-β1作为动脉粥样硬化中的保护因子,随浓度的升高逐渐促进ColⅠ的产生,与以往文献报道相符〔1,13〕,并随浓度依赖性抑制Smurf2表达,由此推断在VSMCs中,TGF-β1提高其信号强度,增加ECM的产生,抑制Smurf2的表达可能是其作用机制的一种。
4 参考文献
1Grainger DJ.Protective cytokine hypothesis transforming growth factor-β and atherosclerosis:so far,so good for the protective cytokine hypothesis〔J〕.Arterioscler Thromb Vasc Biol,2004;24(3):399-404.
2Wiesner S,Ogunjimi AA,Wang HR,etal.Autoinhibition of the HECT-type ubiquitin ligase Smurf 2 through its C2 domain〔J〕.Cell,2007;130(4):651-62.
3Raines EW,Ross R.Smooth musele cells and the pathogenesis of the lesion of atheroselerosis〔J〕.Br Heart J,1993;69(S1):30-7.
4Stefroni S,Cianeiolo G,Donati G,etal.Low TGF-beta1 serum levels are a risk factor for atherosclerosis disease in ESRD patients〔J〕.Kidney Int,2002;61(1):324-35.
5Yang Q,Chen SP,Zhang XP,etal.Smurf2 participates in human trophoblast cell invasion by inhibiting TGF-β type Ⅰ receptor〔J〕.Histochem Cytochem,2009;57(6):605-12.
6Fukasawa H,Yamamoto T,Fujigaki Y,etal.Reduction of transforming growth factor-beta type II receptor is caused by the enhanced ubiquitin-dependent degradation in human renal cell carcinoma〔J〕.Int J Cancer,2010;127(7):1517-25.
7Akashi Togawa,Tatsuo Yamamoto,Hiroyuki Suzuki,etal.Ubiquitin-dependent degradation of Smad2 is increased in the glomeruli of rats with anti-thymocyte serum nephritis〔J〕.Am J Pathol,2003;163(4):1645-52.
8Zhang Y,Chang C,Gehling DJ,etal.Regulation of Smad degradation and activity by Smurf2,an E3 ubiquitin ligase〔J〕.Proc Natl Acad Sci USA,2001;98(3):974-9.
9Wu Q,Kim KO,Sampson ER,etal.Induction of an osteoarthritis-like phenotype and degradation of phosphorylated Smad3 by Smurf2 in transgenic mice〔J〕.Arthritis Rheum,2008;58(10):3132-44.
10Anita Moreén,Imamura T,Miyazono K,etal.Degradation of the tumor suppressor Smad4 by WW and HECT domain ubiquitin ligases〔J〕.J Biol Chem,2005;280(23):22115-23.
11Ohashi N,Yamamoto T,Uchida C,etal.Transcriptional induction of Smurf2 ubiquitin ligase by TGF-beta〔J〕.FEBS Lett,2005;579(12):2557-63.
12Tan RY,He WC,Lin X,etal.Smad ubiquitination regulatory factor-2 in the fibrotic kidney:regulation,target specificity and functional implication〔J〕.Am J Physiol Renal Physiol,2008;294(5):F1076-83.
13Mallat Z,Gojova A,Marchiol-Fournigault C,etal.Inhibition of transforming growth factor-beta signaling accelerates atherosclerosis and induces an unstable plaque phenotype in mice〔J〕.Circ Res,2001;89(10):930-4.

