猪小肠黏膜下层海绵的三维重建、表面修饰和细胞黏附性
田 伟 王效杰
(沈阳医学院解剖教研室,辽宁 沈阳 110034)
细胞与材料的相互作用是组织工程研究的重要内容〔1〕,种子细胞的功能有赖于细胞外基质的存在〔2〕。目前,皮肤组织工程研究的热点之一在于寻找理想的支架材料。因为其不仅影响种子细胞的生物学特性和培养效率,而且决定组织工程皮肤移植后能否适应受体并与之结合,实现修复皮肤缺损的目的。小肠黏膜下层(SIS)是近年来利用物理和化学的方法处理而得到的无细胞的天然细胞外基质〔3,4〕,其结构与皮肤十分相似,但是其孔径率和孔径大小并不利于种子细胞长入。本实验利用化学-物理-材料力学的方法对SIS进行改建,以骨髓基质干细胞为种子细胞,体外进行联合培养,通过观察骨髓间充质干细胞(BMSCs)在SIS上的生长情况,确定SIS的生物相容性,为利用SIS作为支架材料构建组织工程皮肤提供依据。
1 材料与方法
1.1实验材料 Wistar大鼠10只,雌雄不限。猪小肠由河北省蓟州肉食加工公司购买。胃蛋白酶和1-Ethyl-3-EDC由sigma公司购买。TritonX- 100由美国圣路易斯化工有限公司购买
1.2实验方法
1.2.1猪SIS的准备 小肠用清水冲洗干净后, 采用文献2的方法处理得到无细胞的SIS。
1.2.2猪SIS海绵的制备 将准备好的SIS 用剪刀剪成1 cm2大小的组织块,放入含有0.2%的胃蛋白酶3%的乙酸水溶液,SIS以不同的1~4wt%浓度配比,在37℃磁力搅拌器中搅拌72 h,等到SIS充分溶解以后,倒入培养皿中,冷冻24 h后,在冷冻干燥机中24 h,将所得的SIS海绵剪成直径在1 cm圆形,放入12孔的培养板中,分成三组,用含有50、100和150 mmol/L EDC的体积比为95∶5酒精水溶液进行交联24 h,然后取出在40℃的水浴中反复冲洗,取出未反应的SIS,再次冷冻干燥,并使用环氧乙烷消毒(沈阳市中心医院),4℃冰箱中保存备用〔5〕。
1.2.3猪SIS海绵的形态学观察 (1)苏木素-伊红(HE)染色:取SIS海绵,大小1 cm×2 cm,石蜡常规切片,做HE染色,以SIS为对照。(2)扫描电镜观察: SIS海绵置于预冷的2.5%戊二醛溶液内,浸泡12 h,取出样品块放入0.1 mol/L磷酸缓冲液(PBS)(pH7.2)中过夜,系列梯度酒精脱水,醋酸异戊酯置换,二氧化碳临界点干燥,真空喷金,JSM-T300扫描电镜观察并摄片,以SIS为对照。(3)孔径大小的测量:取HE染色的石蜡切片,共9组,每组随机抽取10个切片,每个切片4个视野,用Luzex-F实时图像分析系统进行分析,计算孔径大小及孔径率,以SIS为对照。(4)吸水率的测定:用20 ml去离子水浸泡0.05 g的100 nm的1wt%~4wt%的SIS海绵 ,每组5个样品,每24 h将多余的水分吸去,直至烧杯中无肉眼可以鉴别的水分,测量浸泡前后重量的变化,连续5 d,计算水的吸收能力由方程W =( F- 0.05/0.05)×100%,其中,W是SIS海绵的吸水率, F是浸泡后SIS海绵的重量,然后计算平均值。(5)SIS海绵降解率的测定:将一定质量的支架材料浸入在含0.1%胃蛋白酶的3%乙酸溶液中,60 min后,待材料吸收了充分的溶液后称重记为W1,放置在37℃水浴振荡器中,维持温度并同时对其震荡,每隔24 h,取出支架材料,用滤纸将材料表面的液体擦干,称重记为W2,支架材料的降解率为:D= (W1-W2)/W1×100%,每个样品测3个样,求其平均值。
1.2.4BMSCs复合SIS海绵的形态学观察 (1)BMSCs的培养:取昆明小白鼠20只,雌雄不限,1月龄,体重约18 g,1%戊巴比妥钠腹腔注射麻醉,无菌条件下暴露股骨,去除干净附带的肌肉和骨膜,取中段股骨,用加入肝素的PBS液进行冲洗,冲洗液加入10 ml离心管中1 000 r/min 10 min离心,弃上清,加3 ml DMEM培养基(LG)进行吹打,接种于20 ml培养瓶,加入5 ml DMEM培养基,置于5%CO2,37℃,饱和湿度的CO2孵箱中进行培养,2 d后进行首次换液以去除混杂的血细胞和单核细胞,以后每2天换液,每日倒置镜下观察,2 w后细胞长满单层,进行传代培养,取一部分细胞进行碱性磷酸酶染色及光、电镜观察。(2)BMSCs和SIS海绵的联合培养、取第2代的BMSCs,将细胞浓度调整为1.1×104/ml,加入预先准备的12孔培养板中,让每孔中SIS海绵充分润湿,置于5%CO2,37℃饱和湿度的CO2孵箱中进行培养, 6 h后更换培养液,以后每2 d换1次液,联合培养1、2、3 w后,分别将复合物取出。部分以10%甲醛固定,石蜡包埋,切片,行HE染色。部分标本以2.5%戊二醛固定,做扫描电镜观察。
1.3统计学分析 统计学处理:应用SPSS11,软件进行分析,差异显著性采用方差分析。
2 结 果
2.1肉眼、HE染色 肉眼观察SSIS呈海绵状,韧性强,光镜下显示呈蜂窝状,结构较规整,没有极性,孔隙分布均匀,内部和外部的结构一致,没有分层现象。见图1,图2。
2.2扫描电镜观察 SIS浓度升高,出现了孔径大小和密度的变化,在2wt%时孔径大小约为100~150 μm,但是随着SIS浓度增加,孔径逐渐下降,而且结构出现松散的现象。见图3。
2.3SIS海绵孔径大小的测量 冷冻干燥法制备的SIS海绵为多孔连通性分布,1wt%组的平均孔径为100~150 μm,而2wt%组支架平均孔径为150~200 μm,其他各组的孔径在逐渐下降。此外,以2wt%组的支架,各层之间的连接多为较细的似纤维的结构,造成整个支架的内部结构较粗糙,而对于以1wt%组的支架,各层之间的连接多光滑,材料内部的相对粗糙度较小,不利于细胞的黏附,而且1wt%、2wt%组和3wt%、4wt%组的差异显著(P<0.05)。见表1 。

图1 SIS海绵和单层SIS膜的比较
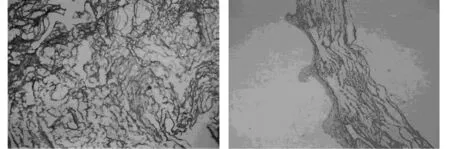
图2 SIS海绵的HE染色(以SIS对比,×40)

图3 100 mmol/L组1wt%SIS海绵的电镜特点(×500)

表1 不同浓度的EDC 100 nm的SIS海绵的孔径短轴大小的两两比较
2.4吸水率的测定 在去离子水中浸泡1~5 d的100 nm EDC不同的质量分数的SIS海绵组,不同浓度的SIS海绵中,1wt%的吸水能力比2wt%高出均2倍,吸水率均数为0.654 1 vs 0.485 4;但是其他两组的吸水能力和2wt%的区别不是特别明显,3wt%、4wt%组吸水率均数分别为0.366 8、0.331 7。结构显示,1wt%的结构更加利于水分的流动和变化,而且和PBS对比没有大的区别,但是4wt%组吸水力已经没有明显的改变。
2.5SIS海绵降解率的测定 各组材料从外形上看,5 d时,每组支架都有不同程度的降解,1wt%、2wt%组均保持了原有的外观,但是其他两组,尤其4wt%组变化明显,各组材料1wt%组与其他3组比较差异显著(P<0.05);各组支架在第2天时降解速度较快,特别是按4wt%比例制备的材料,在第5天就已降解约30%,其余三组各组间进行比较差异显著 (P<0.05),支架材料的降解率随含SIS海绵比例的增加,降解速度加快。1wt%组每周约降解14%,2wt%平均降解15%, 3 wt%平均为18%,1∶4平均为30%,表2。
2.6BMSCs的联合培养

表2 不同质量浓度的SIS海绵的残余重量均数
2.6.1细胞形态 刚接种时,骨髓细胞悬液中的细胞呈圆形,大小不一,不能辨认细胞核;2 d后,细胞开始贴壁,形态不一,以多角形为主,其次还有梭形,三角形细胞,换液后悬浮的血细胞逐渐被清除,大约2次换液后基本完成纯化过程。大约7 d后形成细胞集落,无接触抑制,大部分呈不规则形,层次不清,2 w后细胞长满全层。见图4A。
2.6.2细胞鉴定 取1 w的细胞传代,将多聚赖氨酸包被的载玻片放入培养瓶中,待铺满后,取出,钙鈷法碱性磷酸酶染色呈弱阳性。扫描电镜观察,小鼠BMSCs以星形和多角形为主,这和光镜的观察结果一致。见图4B,图4C。
2.6.3BMSCs和SIS海绵的联合培养 在联合培养中,第1天细胞在不同的海绵中表现都是圆形,未见有明显的变形和贴服,光镜下,可见细胞在支架内分布均匀,大小一致,细胞局部出现集中现象和重叠分布,电镜可以明显发现细胞发出了许多凸起和接触。随着培养天数的增加,细胞的形态由圆形变成了星型和长梭型,尤其以孔隙的附近,重叠的现象比较多见。电镜下,细胞的形态出现铺路石样的改变,将支架表面大部分覆盖,而且在周围出现了大量颗粒样物质,尤其在细胞集中的位置多见,在不同SIS浓度的支架材料中,随着浓度的增加,细胞的变形特点逐渐在培养中变得不明显,以2wt%组明显,而且细胞的集中现象和细胞周围的颗粒现象也逐渐消失或变得非常微弱。在由圆形变为长梭形的过称中,1wt%组的细胞变形比较快和完整,但随着浓度的增加,变形的特点和数量在减弱。在孔隙的位置,细胞的形态比较大,而且外形接近长梭型,数目比较多,而孔隙的周围细胞的形态比较小,类似于圆盘形,数目较少。见图4D。

A

B

C

D
A:小鼠BMSCs 2 w时的相差观察(×100);B:小鼠BMSCs钙鈷法碱性磷酸酶染色呈弱阳性(×100);C:小鼠BMSCs扫描电镜(×1 500);D:小鼠BMSCs在SIS海绵表面生长(×1 500)
图4BMSCs联合培养后细胞形态
3 讨 论
组织工程材料适宜的孔径以及孔径分布,对于的细胞生长和物质能量交换十分重要,并且材料的空隙率也会影响吸收过程 ,此外,将会利于干细胞在其上黏附、增殖和分化〔6,7〕。本研究通过胃蛋白酶-EDC冷冻干燥法制备了SIS海绵支架,构建出仿生的人工皮肤复合基质,进而对其孔隙率、吸水率、干细胞在其上的黏附性能和分布等进行了考察,以确定所制备的支架材料作为组织工程皮肤支架的可行性。
随着SIS溶液浓度的升高,支架的密度以及孔径都有所增大,但空隙率却有所降低。这主要是由于随着SIS溶液浓度的升高,支架材料孔壁加厚,再加上酰胺基密度升高造成基团排斥力增大,从而使支架的密度和孔径升高,但由于大部分体积被SIS本身占据,孔隙率却有所下降。
SIS主要呈线性结构,强度较弱,通常需要对其进行交联,使其形成三维的网状结构,以增强其机械强度〔8〕。本研究尝试普遍选用的低毒无污染的交联剂EDC,考察其对整个支架材料性能的影响。
理想的组织工程三维支架应该模拟体内细胞生存的微环境,诱导干细胞与其密切接触并使其与材料很好的黏附,并最终在其上伸展、增殖以及分化〔9〕。本文制备的SIS海绵,就是以此理念构建的具有良好细胞相容性的人工基质材料。在此材料中,胶原蛋白海绵为细胞提供了一定密度的正电荷,通过静电作用对细胞膜上带有负电荷的细胞更有亲和力〔10〕。此外,BMSCs包面带有大量的负电荷,同时,胶原蛋白又是细胞生存所必需的细胞外基质,所以,本研究所构建的经表面修饰的SIS海绵与细胞外基质结构和功能相类似,可以维持BMSCs黏附、伸展和增殖,可作为组织工程皮肤较理想的支架。
4 参考文献
1Yang K, Zhang Y, Zhang N,etal.Recent progress of small intestinal submucosa in application research of tissue repair and reconstruction〔J〕. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2013;27(9):1138-43.
2卢洪凯, 任安吉, 孙晓璐, 等. 复合雪旺细胞的猪小肠黏膜下层对大鼠海绵体神经损伤勃起功能恢复的实验研究〔J〕. 中华男科学杂志,2010;16(9):834-9.
3Shi L, Ronfard V. Biochemical and biomechanical characterization of porcine small intestinal submucosa (SIS): a mini review〔J〕. Int J Burns Trauma,2013;3(4):173-9.
4Horiguchi A. Editorial comment to outcome of small intestinal submucosa graft for repair of anterior urethral strictures〔J〕. Int J Urol,2013;20(6):629-30.
5Villoldo GM, Loresi M, Giudice C,etal. Histologic changes after urethroplasty using small intestinal submucosa unseeded with cells in rabbits with injured urethra〔J〕. Urology,2013;81(6):1380-1.
6张开刚, 曾炳芳, 张长青. 小肠黏膜下层的制备及细胞相容性的实验研究〔J〕. 中华创伤骨科杂志,2005;7(4):344-8.
7Ding JX, Zhang XY, Chen LM,etal. Vaginoplasty using acellular porcine small intestinal submucosa graft in two patients with Meyer-von-Rokitansky-Kuster-Hauser syndrome: a prospective new technique for vaginal reconstruction〔J〕. Gynecol Obstet Invest,2013;75(2):93-6.
8苏 琰, 张长青, 张开刚, 等. 小肠黏膜下层与雪旺细胞生物相容性的研究〔J〕. 中华创伤骨科杂志,2007;9(2):153-6.
9Lin HK, Godiwalla SY, Palmer B,etal. Understanding roles of porcine small intestinal submucosa in urinary bladder regeneration:identification of variable regenerative characteristics of small Intestinal submucosa〔J〕. Tissue Eng Part B Rev,2013;20(1):73-83.

