舒尼替尼对小鼠晚期乳腺癌模型的抑瘤作用
杨 超 边青召 崔志超 刘运江
(河北医科大学第四医院乳腺中心,河北 石家庄 050011)
传统化疗为目前治疗晚期乳腺癌的主要手段,但化疗出现的恶心、呕吐、乏力及骨髓抑制等化疗毒副反应而使许多患者被迫减量甚至放弃化疗。近年来,随着对分子基因学及肿瘤细胞信号转导途径研究的不断深入,新型靶向抗肿瘤药物的研发与设计越来越受到人们的关注。舒尼替尼是酪氨酸激酶抑制剂(TKI)的代表性药物。本实验旨在探讨舒尼替尼单药作用、与传统化疗联合作用与传统化疗相比较的优势,能否替代传统化疗成为晚期转移性乳腺癌的一种治疗手段,或是与传统化疗结合能否提高疗效。
1 材料和方法
1.1材料 4T1乳腺癌细胞株由河北医科大学科研中心馈赠;BALB/c小鼠,雌性,6~8周龄,体重15~18.5 g,购自河北医科大学实验动物中心;舒尼替尼由美国辉瑞公司生产;多西他赛由深圳万乐药业有限公司生产,IRDye 800CW EGF探针购自美国LI-COR公司;Pearl imager成像系统由美国LI-COR公司生产。
1.2方法
1.2.1构建荷4T1乳腺癌细胞的BALB/C小鼠晚期乳腺癌模型 将4TI乳腺癌细胞置于RPMI-1640培养基中培养并传代,取生长良好的细胞经胰酶消化后,用计数板计数,将浓度调整至1.0×107/ml而以供注射。取32只BALB/c小鼠,将1×106个(0.1 ml)4T1乳腺癌细胞接种于每只小鼠右胸部皮下,待2 w后肿瘤长至大于200 mm3时开始抑瘤实验。
1.2.2抑瘤实验 32只荷瘤鼠随机随机分成四组:联合组(舒尼替尼+多西他赛组)给予舒尼替尼40 mg·kg-1·d-1,溶于0.1 ml无菌生理盐水中灌胃+多西他赛15 mg·kg-1·w-1(溶于0.1 ml无菌生理盐水)腹腔注射;舒尼替尼组(S组)给予舒尼替尼40 mg·kg-1·d-1(溶于0.1 ml无菌生理盐水中)灌胃+无菌生理盐水0.1 ml腹腔注射/w;多西他赛组(D组)给予0.1 ml无菌生理盐水灌胃/d+多西他赛15 mg·kg-1·w-1(溶于0.1 ml无菌生理盐水)腹腔注射;对照组(C组)给予0.1 ml无菌生理盐水中灌胃/d+ 0.1 ml无菌生理盐水腹腔注射/w。各组连续给药3 w。对不同的实验组和对照组开始进行药物处理后,每周测量1次瘤体长径和与之垂直的短径,计算瘤体积,绘制各组肿瘤生长曲线,同时每周称量各组小鼠体重。
1.3观察指标 处死小鼠前2 d,用氯胺酮将各组小鼠麻醉,然后尾静脉注射EGF荧光探针,然后应用Pearl imager成像系统检测成像,选择channe为800 nm时,小鼠全身发出绿色荧光,全身荧光均匀分布;然后于24 h后再次相同方法、条件下成像,可见小鼠除种植瘤部位其他部位仍有荧光分布,荧光于种植瘤部位、肾脏、膀胱位置处较强,其他部位荧光较弱;48 h后,再次相同方法、条件下成像,可见小鼠荧光分布大部分集中于种植瘤部位、膀胱位置(EGF探针经泌尿系统代谢排出体外,并非转移灶),其他部位荧光微弱;此时认为EGF探针已代谢完全,只有种植瘤部位与其特异性结合,此时记录肿瘤荧光密度值。实验结束前48 h开始用EGF探针尾静脉注射标记种植瘤,48 h候开始记录荧光密度值;测量种植瘤大小;称量各组小鼠体重,实验结束后处死小鼠,将双肺取出,体式显微镜下计数双肺转移灶数目。

2 结 果
2.1荷瘤小鼠种植瘤大小的比较 所有小鼠接种4T1乳腺癌细胞株后7 d均可触及皮下瘤结节,成瘤率100%。开始时小鼠精神好,活动状态无明显变化,开始时肿瘤多为圆形或椭圆形,大小均一,后期药物干预后种植瘤开始逐渐不规则,且大小不一。开始抑瘤时4组小鼠体重及种植瘤体积之间比较无统计学意义。3 w后荷瘤小鼠开始出现颈背部皮毛毛糙,毛色发暗,稀疏,活动迟缓,消瘦,药物干预后期D组及联合组小鼠主动摄食较C组及S组少,考虑为化疗毒副反应所致。给药后3 w所有药物干预组小鼠种植瘤体积较C组为小,其中联合组小鼠种植瘤体积最小;联合组与D组均较S组种植瘤体积为小,有统计学显著差异(P均<0.05),联合组种植瘤体积虽小于D组,但差异无统计学意义(P>0.05)。见表1。从小鼠种植瘤生长曲线可以看出C组小鼠种植瘤生长迅速,生长曲线较陡直;联合组及D组小鼠肿瘤在治疗初期肿瘤生长较迅速,后期肿瘤生长延缓,且两线几乎重叠;S组小鼠肿瘤生长较C组慢,但曲线也较陡直。见图1。
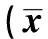
表1 各组各时间小鼠种植瘤的体积±s,n=8,mm3)

给药时间(w)
2.2荷瘤小鼠双肺转移灶数目的比较 小鼠双肺转移灶数目不服从正态分布,各组转移结节用中位数(M)表示:C组:48,D组:14,S组:31.5,联合组:7.5。S组转移灶较C组无统计学意义(P>0.05),D组及联合组均较S组及C组有统计学意义(P均<0.05)。将所有肿瘤标本及双肺常规石蜡包埋后,4~6 μm切片,HE染色,显微镜下证实肿瘤为乳腺浸润性癌,双肺结节证实为乳腺癌转移。见图2,图3。

图2 小鼠肺转移结节

图3 肺转移结节病理证实为乳腺浸润癌(HE,×200)
2.3荷瘤小鼠种植瘤荧光密度值的比较 各组小鼠种植瘤荧光密度值分别为:S组(6.30±0.29)×103、D组(3.14±0.60)×103、联合组(3.07±0.36)mm,所有药物干预组小鼠种植瘤荧光密度值较C组为低〔(8.58±0.61)×103,P均<0.05〕;联合组与D组均较S组为低(P均<0.05),联合组虽低于D组(P>0.05)。
3 讨 论
乳腺癌随着新的化疗药物的涌现及规范化的治疗,早期乳腺癌患者的预后已经有了显著改善,无病生存期和总生存期已有了显著提高,90%以上患者可以获得长期生存〔1〕,目前对晚期乳腺癌患者的治疗收效甚微,晚期复发和(或)转移的患者,原发病变部位以内脏或混合为主,一般情况较差,肿瘤负荷大,存在多脏器转移,多疗程化疗后骨髓抑制。舒尼替尼是美国辉瑞公司开发的口服小分子酪氨酸激酶抑制剂(TKI)代表性药物,用于治疗甲磺酸伊马替尼不耐受或者病情恶化的胃肠道间质肿瘤(GIST)和晚期肾细胞癌(mRCC)〔2~5〕,有报道〔6〕舒尼替尼能够抑制80多种酪氨酸激酶和多种生长因子受体。临床前研究显示不仅对HER2阳性的乳腺癌细胞株有明显抑制作用,对多种不同表型乳腺癌细胞系均有抑制作用。本实验发现舒尼替尼对HER2阳性小鼠乳腺癌有一定的抑制作用,这与Fuminori等〔7〕报道的舒尼替尼能够抑制FVB鼠HER2阳性乳腺癌模型的肿瘤生长的结果是一致的,他认为舒尼替尼治疗过程中可减少免疫抑制细胞的生成,可以减轻免疫抑制,提高机体免疫力,本实验限于时间及经费等问题,单从体重角度探讨舒尼替尼服用过程中机体化疗副反应较小,未联合检测免疫因子及血白细胞,因此舒尼替尼能否减轻免疫抑制,提高机体免疫力尚需进一步探讨。
本实验发现舒尼替尼单药有一定作用,并未看到与多西他赛联合后未能提高疗效, 2010年ASCO会议上,一项国际多中心的Ⅲ期研究〔8〕表明,对于593例新诊断的HER2阴性的晚期乳腺癌患者,在多西他赛中加入舒尼替尼治疗直至疾病进展,虽然总有效率(ORR)显著提高,但无进展生存(PFS)和总生存(OS)均未得到显著改善。Albana等〔9〕报道,舒尼替尼可抑制裸鼠前列腺癌模型肿瘤的生长,舒尼替尼和多西他赛作为单一制剂均具有强大的抗肿瘤活性,虽然多西他赛抗肿瘤活性优于舒尼替尼,但体重评估显示毒性明显高于舒尼替尼,然而舒尼替尼联合低剂量多西他赛抗肿瘤效果与大剂量多西他赛相似,且毒性作用明显降低。Guru等〔10〕报道,在膀胱癌的种植瘤模型中,舒尼替尼可增加顺铂的疗效,显示舒尼替尼及顺铂均能抑制肿瘤的增殖、促进肿瘤的凋亡、抑制肿瘤微血管的生成。多西他赛作用可能与舒尼替尼存在交叉,联合之后,舒尼替尼的作用被多西他赛掩盖。
本实验结果显其对转移灶无明显“杀灭”作用,一方面这可能与靶向药物本身为“抑制剂”而非“杀伤剂”有关,靶向药物作用温和,当机体有远处转移时(除外单纯骨和软组织转移,如ER阳性绝经后患者可用芳香化酶抑制剂治疗),NCCN(National Comprehensive Cancer Network)推荐以传统解救化疗为主。另一方面还可能与转移灶本身“生命力强”有关,转移灶一旦形成,将会较原发灶更加耐药,传统化疗药物对转移灶的作用也不是十分敏感,其具体机制有待于进一步研究和探讨。
本研究结果提示,在临床实践中,对于晚期乳腺癌的治疗,尤其是一线化疗失败后,应该严格把握单药和联合用药的区别,不能盲目地追求联合治疗。从目前临床治疗水平来看,对于晚期乳腺癌的治疗,还不能替代传统的化疗,靶向治疗只是辅助治疗的一种重要手段。
4 参考文献
1徐兵河.复发转移乳腺癌的化学治疗〔J〕.中国实用内科杂志,2007;27:24
2Rock EP,Goodman V,Jiang JX,etal.Food and drug administration drug approval summary:sunitinib malate for the treatment of gastrointestinal stromal tumor and advanced renal cell carcinoma〔J〕.Oncologist,2007;12(1):107-13.
3Goodman VL,Rock EP,Dagher R,etal.Approval summary:sunitinib for the treatment of imatinib refractory or into-lerant gastrointestinal stromal tumors and advanced renal cell carcinoma〔J〕.Clin Cancer Res,2007;13(5):1367-73.
4Motzer RJ,Michaelson MD,Redman BG,etal.Activity of SU 11248,a multitargeted inhibitor of vascular endothelial growth factor receptor and platetel derived growth factor receptor,in patients with metastatic renal cell carcinoma〔J〕.J Clin Oncol,2006;24(1):16-24.
5Faivre S,Delbaldo C,Vera K,etal.Safety,pharmacokinetic,and antitumor activity of SU11248,a novel oral multitarget tyrosine kinase inhibitor,inpatients with cancer〔J〕.J Clin Oncol,2006;24(1):25-35.
6Abrams TJ,Lee LB,Murrary LJ,etal.SU11248 inhibits KIT and platelet 2 derived growth factor recep tor beta in preclinical models of human small cell lung cancer〔J〕.Mol Cancer Ther,2003;2(5):471-8.
7Fuminori A,Ibrahim Y.Therapeutic activity of sunitinib for Her2/neu induced mammary cancer in FVB mice〔J〕.Int Immunopharmacol,2010;10(1):140-5.
8Bergh J,Greil R.Sunitinib(SU)in combination with docetaxel(D)versus D alone for the first-line treatment of advanced breast cancer(ABC)〔R〕.2010 ASCO Annual Meeting.Abstract No:LBA1010.
9Albana C,Nicola T.Sunitinib malate(SU-11248)alone or in combination with low-dose docetaxel inhibits the growth of DU-145 prostate cancer xenografts〔J〕.Cancer Lett,2008;270(2):229-33.
10Guru S,Weiguo J.Sunitinib malate is active against human urothelial carcinoma and enhances the activity of cisplatin in a preclinical model〔J〕.Urol Oncol,2009;27(4):391-9.

