CADM1与DAL-1/4.1B在结直肠癌中的表达
张 茹 徐正磊 谭庆红
(暨南大学第二临床医学院深圳市人民医院消化内科,广东 深圳 518000)
结直肠癌(CRC)治疗以手术为主,辅以放化疗、中医药等综合治疗,费用高,治疗后复发常见,患者生存时间和生存质量欠佳。该病致病机制研究认为,癌基因、抑癌基因及DNA修复基因的改变,尤其是癌基因的突变、缺失是CRC发病的重要原因〔1,2〕。细胞黏附分子1/肺癌抑制因子-1(CADM1/TSLC1)在对肺癌的研究中发现,CADM1广泛表达在人体正常组织中,而该基因在癌组织中的启动子高甲基化,导致其表达减少。其他研究表明CADM1在上皮来源肿瘤发病机制中发挥不容忽视的作用〔3〕。肺癌差异表达基因(DAL-1)是具有维持细胞膜稳定作用的一类细胞膜骨架蛋白,且与细胞内信号转导和细胞间相互作用密切相关〔2〕,研究推测DAL-1不仅能维持正常肠道组织结构和正常肠道上皮细胞的增殖及黏附作用且具有阻止肠上皮细胞恶性转变的功能〔4〕。CADM1和DAL-1基因共同参与稳定细胞骨架及维持细胞黏附性,在CRC的发生、发展中发挥着重要的抑癌作用,当失活或缺失时导致肿瘤发生、转移或侵袭。本研究探讨两种基因在CRC中的可能表达机制。
1 资料与方法
1.1资料 选取2010年11月至2013年3月在我院行结肠镜切除或开腹手术切除治疗的患者,35例标本均经病理学确诊,未接受化疗;低分化5例、中分化16例、高分化14例;淋巴结转移21例;远处转移18例。结直肠腺瘤标本15例。距CRC癌中心10 cm处的正常组织35例,其中男21例,女14例,年龄31~72〔平均(57.1±12.2)〕岁。根据Dukes分期,癌组织经病理检查后,A+B期14例,C+D期21例。
1.2方法
1.2.1材料 选取美国Santa Cruz Biotechnology 公司生产的兔抗人多克隆抗体CADM1和Abcam公司生产的DAL-1/4.1B兔抗人多克隆抗体,免疫组化所用的链霉亲和素-生物素复合物(SABC)试剂盒和二氨基联苯胺(DAB)显色试剂盒购自北京中杉公司。
1.2.2检测方法 所有标本中均置入组织保存液,用10%中性缓冲甲醛固定,石蜡包埋,连续切片厚度为5 μm,苏木素-伊红(HE)染色进行病理诊断和分型。采用SABC法和Western 印迹法检测CADM1和DAL-1/4.1B的表达。蛋白质印迹检测的标本组织去除周围脂肪组织,冲洗残留血液,放入冰盒中,存放于-80℃低温冰箱备用。
1.2.3免疫组织化学SABC法 组织标本经处理后,采用二甲苯进行脱蜡处理,对组织进行水化、修复抗原、滴加一抗CADM1及DAL-1/4.1B(1∶100)与靶蛋白结合、生物素化二抗(1∶200)及SABC试剂与一抗结合、DNA显色、HE复染、脱水、透明和封片处理。用已知的正常结直肠组织切片(CADM1及DAL-1/4.1B阳性)作为阳性对照,磷酸盐缓冲液(PBS)缓冲液代替一抗作阴性对照,进行镜下观察。
1.2.4Western 印迹 将冻存于-80℃冰箱中的组织标本取出,按照提取细胞和组织标本总蛋白、二喹啉甲酸(BCA)法测定蛋白浓度、配置10%蛋白分离胶和5%积层胶、变性蛋白和上样、蛋白电泳、转膜、封闭、一抗与靶蛋白结合、过氧化物酶标记二抗与相应一抗结合、增强化学发光法(ECL)检测和半定量分析进行操作。将X线片放置于UVI凝胶成像系统摄影,用图像分析软件Quantity one分析条带灰度值,用目的条带/β-actin代表分子相对表达量。
1.3染色结果评价〔5〕采用Olympus显微镜和显微摄像仪观察染色组织并照相记录,图像分析采用HMIAS-2000型全自动彩色图像分析系统。CADM1与DAL-1/4.1B蛋白均以细胞质或细胞膜内出现棕黄色颗粒作为阳性判断标准。采用染色强度和阳性细胞百分比乘积计量阳性情况:乘积≥2分为免疫组织化学阳性,<2分为阴性。染色强度:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比:高倍镜下(×400)按照随机选取每张切片5个视野观察细胞,每个视野500个细胞,根据计算阳性细胞所占百分比:阴性为0分,阳性细胞<10%为1分,阳性细胞10%~50%为2分,阳性细胞>50%为3分。
1.4统计学方法 应用SPSS14.0软件进行t检验和Pearson相关分析。
2 结 果
2.1CADM1与DAL-1/4.1B蛋白的表达 CADM1和DAL-1/4.1B蛋白的阳性以细胞膜或细胞质有棕黄色颗粒为标准。结果发现,阳性细胞散在分布,多数位于结直肠癌腺体和细胞膜上,组织间质较少。CADM1和DAL-1/4.1B蛋白在CRC组织的表达显著低于正常结直肠组织(P<0.05)。但CADM1和DAL-1/4.1B蛋白在腺瘤组织中的表达虽然低于正常对照组,但差异并无统计学意义(P>0.05)。见表1。
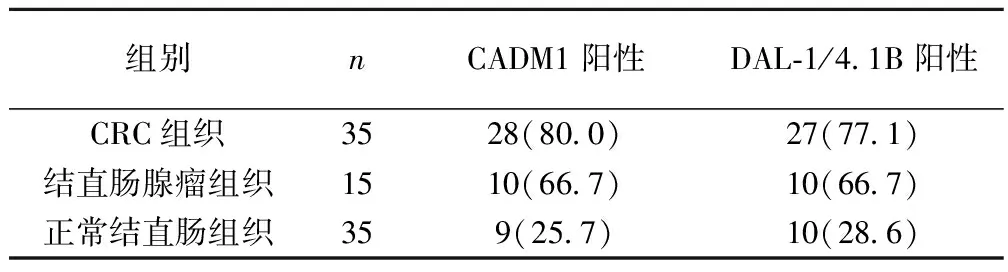
表1 CADM1和DAL-1/4.1B蛋白在三组中的表达〔n(%)〕
2.2CADM1与DAL-1/4.1B蛋白与β-actin 灰度值比值比较 采用图像分析软件Quantity one分析条带灰度值,用目的条带/β-actin代表分子相对表达量,结果显示,CRC组织中CADM1和DAL-1/4.1B蛋白的灰度值与β-actin灰度值的比较显著小于腺瘤组和正常对照组(P<0.05)。见表2。
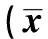
表2 CADM1和DAL-1/4.1B蛋白与β-actin灰度值比值比较±s)
2.3CADM1和DAL-1/4.1B相关性 二者与β-actin灰度值比值呈正相关(r=0.707,P<0.05)。且根据Dukes分期,发现在Dukes分期C+D中两者表达的阳性率显著低于A+B分期(P<0.05)。
2.4CRC临床病理学特征与CADM1与DAL-1/4.1B蛋白表达关系 CADM1和DAL-1/4.1B蛋白仅与Dukes分期C+D中的表达阳性率相关(P<0.05)。见表3。
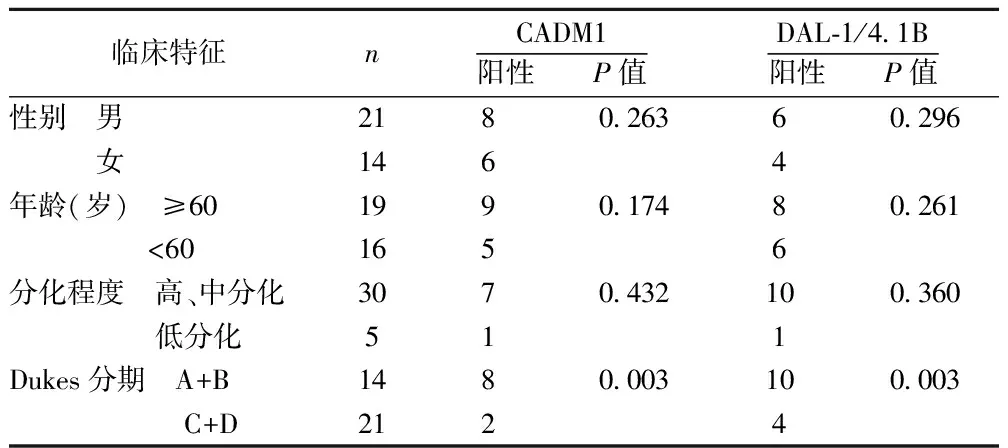
表3 CRC临床病理学特征与CDM1、DAL-1/4.1B蛋白表达的关系(n)
3 讨 论
肿瘤的侵袭转移是一个动态、复杂、多步骤的过程,肿瘤细胞与血管内皮细胞之间的黏附是肿瘤复发与转移的关键步骤之一〔6〕。细胞黏附是由细胞间以及细胞与细胞外基质连接的一类跨膜糖蛋白介导的,在肿瘤的浸润及转移过程中起着非常重要的作用〔7〕。而与肿瘤发生发展相关的CADMA1级联抑癌基因通路发挥着重要作用。CADM1级联抑癌基因通路包括:CADM1、DAL-1及MPP3三个基因。目前已发现CADM1级联抑癌基因在部分人CRC细胞系和病理组织标本中表达明显减少甚至消失,并且基因启动子高甲基化状态是调控该通路基因表达的一个主要机制。统计分析结果显示,该抑癌基因通路表达变化还具有随着CRC患者病情进展而愈加明显的趋势。DAL-1/4.1B/ EPB41L3基因是蛋白4.1超家族中的一员,位于染色体18p11.3,是一种抑癌基因,该基因首先在小鼠大脑神经髓鞘的副结区被发现,后续研究发现其存在于多种组织器官中〔8〕。并认为DAL-1在构成细胞膜和联通细胞质内通路蛋白信号发挥重要作用〔9〕。在CRC研究方面,国内外对于CADM1级联通路的研究较少,本研究希望研究CADM1和DAL-1/4.1B在结直肠癌中的作用机制,了解其在结直肠癌中所发挥的作用,为结直肠癌未来的诊断治疗工作提高有效的理论依据〔10〕。
实验结果显示,CADM1与DAL-1/4.1B蛋白与结直肠癌的发生发展具有密切关系。分析原因可能为CADM1、DAL-1及MPP3基因共同构成了在上皮细胞内发挥级联抑癌作用的通路,CADM1的 PDZ和FERM结合基序与DAL-1和MPP3相互连接形成的三聚体在维持正常组织结构、细胞间黏附、细胞极性及形态发挥举足轻重的作用,该通路失活可能导致肿瘤发生发展,且启动子高甲基化可能是调控该通路的一个重要分子机制。通过实验及研究,可以认为CADM1与DAL-1/4.1B蛋白是组织肌动蛋白骨架的重要构成因素,且CADM1的失活会直接引起级联通路中DAL-1和MPP3在组织中表达的减少,对膜稳定产生影响。且实验中的免疫组织化学结果显示,在结直肠组织中,CADM1和DAL-1/4.1B的表达部位相近,二者灰度值及染色强度等均呈明显相关性。因此,CADM1和DAL-1/4.1B的表达程度与CRC的发生进展具有密切的联系。但是,也有研究显示,基于4.1B敲除小鼠的研究显示4.1B蛋白可能抑制癌症的发生和转移,可是小鼠本身未见任何表型变化〔9〕。因此推断,CADM1在CRC的发生中可能起着更为重要的作用,尚需进一步研究。
综上,CRC的发生与CADM1和DAL-1/4.1B基因表达的异常有关,是一个渐进及多步骤的基因改变过程,且大量研究表明,抑癌基因的突变、缺失和沉默失活在CRC发病中发挥重要的作用,如腺瘤样结肠息肉病易感基因、CRC突变基因及CRC缺失基因等。因此,如何能够更为彻底地了解基因表达与CRC发生发展的关系并以各基因靶点作为出发点采用分子技术靶向治疗CRC值得进一步的探讨研究。
4 参考文献
1Uchino K,Ito A,Wakayama T,etal.Clinical implication and prognostic significance of the tumor suppressor TSLC1 gene detected in adenocarcinoma of the lung〔J〕.Cancer,2003;98(5):1002-7.
2Perez-Moreno M,Jamora C,Fuchs E.Sticky business: orchestrating cellular signals at adherens junctions〔J〕.Cell,2003;112(4):535-48.
3Ohno N,Terada N,Murata S,etal.Immunolocalization of protein 4.1B/DAL-1 during neoplastic transformation of mouse and human intestinal epithelium.Histochem Cell〔J〕.Biol J,2004;122(6):579-86.
4Goto A,Niki T,Chi-Pin L,Matsubara D,etal.Loss of TSLC1 expression in lung adenocarcinoma: relationships with histological subtypes,sex and prognostic significance〔J〕.Cancer Sci,2005;96(8):480-6.
5王媛媛,宋 光,李玉梅,等.与结肠癌转移倾向相关的细胞黏附基因的筛查〔J〕.癌变·畸变·突变,2012;24(6):418-21.
6Ramez M,Blot-Chabaud M,Cluzeaud F,etal.Distinct distribution of specific members of protein 4.1 gene family in the mouse nephron〔J〕.Kidney Int,2003;63(4):1321-37.
7陈科全,刘思德,白 杨,等.DAL-1表达下调与大肠腺癌发生发展的关系〔J〕.肿瘤防治研究,2011;38(10):1143-6.
8Murakami Y.Involvement of a cell adhesion molecule,TSLC1/IGSF4,in human oncogenesis〔J〕.Cancer Sci,2005;96(9): 543-52.
9盛誉乔,梅 珊,祁元明,等.4.1B蛋白的抑制肿瘤作用〔J〕.生命的化学,2008;28(6):711-4.
10韦德才,蒋邦好,胡雄峰,等.腹腔镜与传统开腹手术治疗急性胆囊炎的疗效比较〔J〕.中国当代医药,2012;19(3):33-4.
—— “T”级联

