柚皮素-铜络合物对Hep-G2细胞增殖与凋亡的影响
董健健,程 楠,韩咏竹
(1.安徽中医药大学研究生部,安徽 合肥 230038;2.安徽中医药大学神经病学研究所附属医院,安徽 合肥 230061)
·实验研究·
柚皮素-铜络合物对Hep-G2细胞增殖与凋亡的影响
董健健1,程 楠2,韩咏竹2
(1.安徽中医药大学研究生部,安徽 合肥 230038;2.安徽中医药大学神经病学研究所附属医院,安徽 合肥 230061)
目的观察柚皮素-铜络合物在体外对人肝癌Hep-G2细胞增殖与凋亡的影响,探究其作用机制。方法将不同浓度柚皮素-铜络合物作用于体外培养的Hep-G2细胞,采用甲基噻唑基四唑法检测细胞生长抑制率;荧光显微镜下观察柚皮素-铜络合物对DAPI染色的Hep-G2细胞凋亡的影响;应用流式细胞仪检测凋亡率; Western blot法检测细胞中Bcl-2、Bax和Caspase-3蛋白表达的变化。结果柚皮素-铜络合物可显著地抑制Hep-G2细胞增殖,且在一定的范围内呈浓度依赖性。荧光显微镜下观察显示,柚皮素-铜络合物作用的Hep-G2细胞出现显著的凋亡特征,呈剂量依赖性地增加细胞凋亡率。柚皮素-铜络合物可上调Hep-G2细胞中Bax、Caspase-3蛋白的表达,抑制Bcl-2蛋白的表达,且呈一定的剂量依赖性。结论柚皮素-铜络合物可抑制Hep-G2细胞的增殖并诱导其凋亡,其作用机制可能与上调Bax、Caspase-3蛋白的表达,抑制Bcl-2蛋白的表达有关。
柚皮素-铜络合物;Hep-G2细胞;细胞凋亡;Caspase-3;Bcl-2;Bax
肝细胞癌(hepatocellular carcinoma,HCC)是临床上最常见且病死率最高的肿瘤之一,全球发病率逐步增加。2012年,全世界新增78万HCC患者,死亡病例多达74万[1]。中国是全球肝癌发病率最高和病死数最多的国家,肝癌患者占全球的55%[2]。目前,临床上使用的化学治疗药物疗效均不理想,因此,寻找高效低毒的抗肝癌药物已迫在眉睫。Wang BD等[3]合成了柚皮素希夫碱镧(Ⅲ)配合物,并发现其具有抗肿瘤活性。Deng S等[4]发现柚皮素对人乳腺癌细胞MCF-7的活性具有抑制作用。但关于柚皮素-铜络合物的抗肿瘤活性仅有少量报道[5]。本实验采用人HCC细胞株Hep-G2细胞为研究对象,探讨柚皮素-铜络合物对Hep-G2细胞的抑制作用及其机制,旨在为HCC的临床治疗提供实验依据。
1 材料
1.1 细胞 人HCC Hep-G2细胞:购自中国科学院上海细胞库。
1.2 药品及主要试剂 柚皮素-铜络合物:由安徽中医药大学神经病学研究所附属医院基础实验室合成;RPMI-1640培养基干粉:Gibco公司,批号 1464326;胎牛血清(fatal bovine serum, FBS):杭州四季青生物工程公司,批号 140409;胰蛋白酶:Hyclone公司,批号 30042.01;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI):Sigma公司,批号 D9542;膜联蛋白Ⅴ(Annexin Ⅴ,AV)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒:贝博生物,批号 BB-4101-50T;甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT):Amresco公司,批号 0793;二甲基亚砜(dimethyl suiloxide,DMSO):Amresco公司,批号 20120210;Bcl-2、Bax和Caspase-3抗体:博奥森公司,批号分别为BA0412、BA0315、bs-0081R;β-actin抗体:Cell Signaling公司,批号 P60709;山羊抗兔免疫球蛋白G(immunoglobulin G, IgG):中杉金桥,批号 ZB-2301;其他试剂均为分析纯。
1.3 主要仪器和设备 Olympus CKX41倒置显微镜:日本Olympus公司;96孔和6孔平底培养板:美国Corning costar公司;SPECTRA max M2e酶标仪:美国Molecular Devices公司;MCO-175 CO2培养箱:日本三洋公司;JW2502电子分析天平:上海精密科学仪器有限公司;LD4-8型低速离心机:北京医用离心机厂;FACS Calibur流式细胞仪:美国Becton Dickinson公司。
2 方法
2.1 柚皮素-铜络合物合成 称取0.054 4 g柚皮素,溶于10 mL无水乙醇,电磁搅拌,待大部分配体溶解后,滴加NH3·H2O(NH3·H2O∶CH3CH2OH=1∶1)调节配体溶液的pH值至7~8,边搅拌边将溶有0.020 4 g CuCl2·2H2O的5 mL无水乙醇溶液滴加到配体溶液中,溶液中很快产生绿色沉淀。室温搅拌7 h,停止反应。离心分离,用无水乙醇和蒸馏水反复洗涤沉淀,真空干燥后,得墨绿色固体[4]。所有配合物易溶于二甲基甲酰胺(dimethyiformamide, DMF)和DMSO,微溶于甲醇,不溶于水、丙酮、乙醚、氯仿、二氯化碳和乙酸乙酯等,在空气中性质稳定。
2.2 细胞培养 将Hep-G2细胞接种于培养瓶中,培养基为RPMI 1640(含10% FBS、青霉素100 U/mL和链霉素100 U/mL、2.0 g的NaHCO3),置于37 ℃、5% CO2培养箱,相对饱和湿度的条件下培养,细胞呈单纯贴壁生长,隔日换液,待细胞长至80%~90%的密度,用胰酶/乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)消化传代,每2~3 d传代一次。
2.3 MTT法测柚皮素-铜络合物对Hep-G2细胞增殖的抑制作用 Hep-G2细胞以每孔3×103个接种于96孔板,用含10% FBS的RPMI 1640完全培养液培养,当细胞长至30%的融合度时,换成RPMI 1640无血清培养基培养12 h后,实验组分别加不同浓度的柚皮素-铜络合物,柚皮素-铜络合物终浓度分别为25、50、100、200、400 μmol/L,每组均设6个复孔,对照组加入完全培养基,每组均设6个复孔,在37 ℃、5% CO2中分别培养24 h后,每孔加5 mg/mL的MTT 20 μL,继续孵育4 h,弃去培养液,加150 μL DMSO,振荡至结晶充分溶解,用酶标仪检测490 nm处光密度值(optical density, OD),以空白对照组调零,细胞存活率=实验组OD490/空白对照组OD490×100%。实验重复3次,计算平均半数抑制浓度(concentration of inhibition 50,IC50)。
2.4 DAPI染色检测柚皮素-铜络合物对Hep-G2细胞凋亡的影响 取对数生长期的Hep-G2细胞以每孔105个接种于6孔板中,培养过夜,弃上清液,分别加入含不同剂量柚皮素-铜络合物药液的完全培养基2 mL,继续培养24 h,吸出培养液,每孔加入1 mL DAPI染液,室温下避光孵育10 min,弃染色液,用PBS洗3遍后于荧光显微镜下观察并拍照。
2.5 AV-FITC/PI双染色法检测细胞凋亡 培养24 h后收集细胞,按AV-FITC/PI凋亡试剂盒说明书操作,于1 h内上流式细胞仪用Cell Quest软件检测并分析细胞凋亡的情况。
2.6 Western blot法检测细胞中Bcl-2、Bax和Caspase-3蛋白表达的变化 取对数生长期的Hep-G2细胞接种于35 mm培养瓶中,待细胞长满瓶底80%,弃培养液,分别加入含不同剂量柚皮素-铜络合物药液的完全培养基2 mL,继续培养24 h,吸出培养液,分别加入含不同剂量柚皮素-铜络合物药液的完全培养基(50、100、200 μmol/L)5 mL,对照组加入等体积培养液,培养24 h后提取细胞总蛋白,Bradford法测定蛋白含量。取蛋白20 μg作电泳,将蛋白样本转移至硝酸纤维素滤膜(nitrocellulose filter membrane, NC)上。滤膜用5%脱脂奶粉封闭4 h,磷酸盐吐温缓冲液(phosphate buffer saline with tween, PBST)洗3次,每次10 min。分别加入抗Bcl-2多克隆抗体(1∶300),抗Bax多克隆抗体(1∶300),抗Caspase-3多克隆抗体(1∶300),4 ℃过夜。分别加入辣根过氧化物酶标记山羊抗兔IgG(1∶1 000),脱色摇床摇1.5 h,PBST洗3次,每次10 min。以β-actin作为内参。凝胶成像系统拍照,并扫描分析各条带的OD值,以β-actin的表达量为对照计算各组Bcl-2、Bax、Caspase-3的相对表达量。

3 结果
3.1 MTT检测柚皮素-铜络合物对Hep-G2细胞生长的抑制作用 柚皮素-铜络合物在25~400 μmol/L剂量下作用于Hep-G2细胞24 h,结果显示,柚皮素-铜络合物具有明显的细胞增殖抑制作用,且呈一定的量效依赖关系。柚皮素-铜络合物作用Hep-G2细胞24 h的IC50为170.23 μmol/L。见图1。

注:与0 μmol/L柚皮素-铜络合物组比较,**P<0.01。
图1 MTT法检测不同剂量柚皮素-铜络合物处理的Hep-G2细胞抑制率(n=3)
3.2 荧光显微镜观察柚皮素-铜络合物对Hep-G2细胞凋亡的影响 不同剂量柚皮素-铜络合物作用Hep-G2细胞24 h后,倒置荧光显微镜下可见正常细胞核荧光表达均匀,而凋亡细胞呈现核浓缩,染色加深,或核染色质呈新月形聚集于核膜一边,或核碎裂成大小不等的圆形小体,随着药物浓度的增大,这种现象更加明显。见图2。
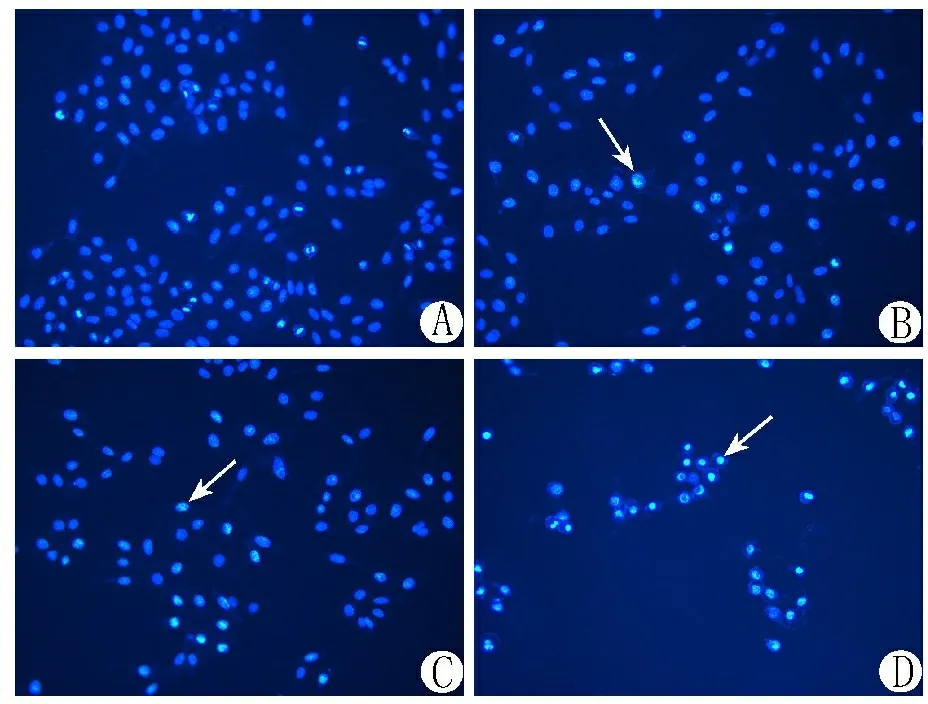
注:A.空白对照组;B. 50 μmol/L柚皮素-铜络合物组;C. 100 μmol/L柚皮素-铜络合物组;D. 200 μmol/L柚皮素-铜络合物组;白色箭头示凋亡细胞。
图2不同剂量柚皮素-铜络合物对Hep-G2细胞凋亡的影响(DAPI染色,10×20倍)
3.3 柚皮素-铜络合物对Hep-G2细胞凋亡的影响 AV-FITC/PI双染色法检测结果显示,经柚皮素-铜络合物处理24 h后,细胞凋亡率明显增加,且呈明显量效关系。见图3。
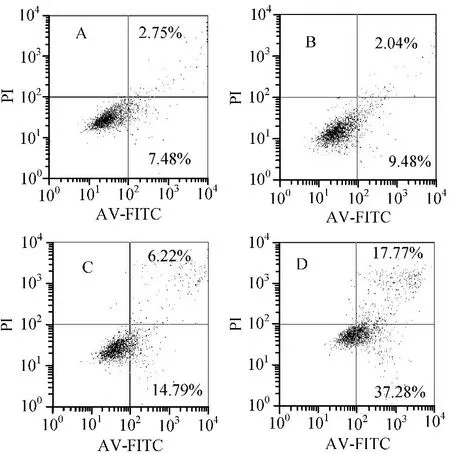
注:A. 空白对照组;B. 50 μmol/L柚皮素-铜络合物组;C. 100 μmol/L柚皮素-铜络合物组;D. 200 μmol/L柚皮素-铜络合物组。
图3不同剂量柚皮素-铜络合物对Hep-G2细胞凋亡率的影响
3.4 柚皮素-铜络合物对Hep-G2细胞中Bcl-2、Bax和Caspase-3蛋白表达的影响 柚皮素-铜络合物处理组与对照组比较,Bax、Caspase-3蛋白表达增加,而Bcl-2蛋白表达减少。采用Image J软件对各目的条带与内参条带进行灰度比较,并作柱状图,各组间差异具有统计学意义,Bax、Caspase-3蛋白表达水平随柚皮素-铜络合物浓度增加而升高,而Bcl-2蛋白表达水平随药物增加而降低。见图4。
4 讨论
有关金属络合物抗肿瘤活性的报道可以追溯到16世纪,但直到1960年代无机金属络合物顺铂的抗肿瘤活性被发现后,有关金属络合物抗肿瘤作用的研究逐步展开。近年来,大量研究[6-8]证实了铜络合物的抗肿瘤活性。本试验所用的柚皮素-铜络合物为新合成的物质,有研究[5]已初步证实其具有抗肿瘤活性。
细胞凋亡在肿瘤的发生发展中起重要作用[9]。本实验首先通过MTT法研究发现,25~400 μmol/L柚皮素-铜络合物对Hep-G2细胞具有明显的增殖抑制作用,并呈显著的量效关系。进一步采用DAPI染色发现,在一定的剂量范围内,随着柚皮素-铜络合物浓度增加,Hep-G2细胞呈现出明显的凋亡特征。随着药物浓度的增加,细胞凋亡的比率逐渐上升且呈明显的量效关系,提示诱导凋亡可能是柚皮素-铜络合物抗肿瘤作用的机制之一。
细胞凋亡的发生途径分为3种,即死亡受体依赖途径、内质网信号途径和线粒体依赖途径。Bcl-2家族是细胞凋亡过程中起重要作用的一类蛋白。在线粒体上,Bcl-2家族蛋白通过与其他凋亡蛋白的协同作用,调控线粒体结构与功能的稳定性,发挥着调控细胞凋亡的作用[10-11]。Bcl-2家族包括两类蛋白:一类是抑凋亡蛋白如Bcl-2,一类是促凋亡蛋白如Bax。Bcl-2和Bax均通过调控内质网Ca2+参与的核内外物质转运及膜通透性来控制细胞色素C的释放,进而阻滞或诱导凋亡,Bcl-2/Bax比值可以决定细胞是否发生凋亡[12]。Caspase家族是一类半胱氨酸蛋白酶,在细胞凋亡过程中起着重要的作用。在细胞凋亡信号的刺激下,Bcl-2/Bax比值缩小,使线粒体外膜通透性增高,引起细胞色素C释放到胞质中,进而活化Caspase-3启动凋亡[13]。本实验结果表明,柚皮素-铜络合物诱导细胞凋亡的作用可能与降低Bcl-2/Bax比值,启动Caspase级联反应相关。
本实验证实,柚皮素-铜络合物在一定剂量范围内有抑制Hep-G2细胞增殖的作用,其诱导细胞凋亡的机制可能与通过上调Bax、Caspase-3蛋白表达,下调Bcl-2蛋白表达有关,但确切机制尚需进一步研究。

注:A. 空白对照组;B. 50 μmol/L柚皮素-铜络合物组;C. 100 μmol/L柚皮素-铜络合物组;D. 200 μmol/L柚皮素-铜络合物组;与0 μmol/L柚皮素-铜络合物比较,*P<0.05,**P<0.01。
图4不同剂量柚皮素-铜络合物对Hep-G2细胞Bcl-2、Bax和Caspase-3蛋白表达的影响(n=3)
[1]Flores A,Marrero JA. Emerging trends in hepatocellular carcinoma: focus on diagnosis and therapeutics[J]. Clin Med Insights Oncol,2014,8:71-76.
[2] Parkin DM, Bray F, Ferlay J, et al. Estimating the world cancer burden: globocan 2000 [J]. Int J Cancer, 2001, 94 (2): 153-156.
[3] Wang BD, Yang ZY, Wang Q,et al. Synthesis,characterization, cytotoxic activities,and DNA-binding properties of the La(Ⅲ) complex with Naringenin Schiff-base[J]. Bioorg Med Chem,2006,14(6):1880-1888.
[4]Deny S, Hasnah MS,Farediah A,et al. Antioxidant and cytotoxic flavonoids from the flowers ofMelastomamalabathricumL[J]. Food Chemistry,2007,103(3):710-716.
[5]朱金蝉.三种黄酮铜配合物的合成及其生物活性研究[D].桂林:广西师范大学,2008:20-25.
[6]Huang Q,Pan Z,Wang P,et al. Zinc(Ⅱ) and copper (Ⅱ) complexes of beta-substituted hydroxylporphyrins as tumor photosensitizers[J]. Bioorg Med Chem Lett,2006,16(11):3030-3033.
[7]Tan SJ,Yan YK,Lee PP,et al. Copper,gold and silver compounds as potential new anti-tumor metallodrugs[J]. Future Med Chem,2010,2(10):1591-1608.
[8]Pradeepa SM, Bhojya Naik HS, Vinay Kumar B,et al. Cobalt(Ⅱ),Nickel(Ⅱ) and Copper(Ⅱ) complexes of a tetradentate Schiff base as photosensitizers:quantum yield of 1O2generation and its promising role in anti-tumor activity[J]. Spectrochim Acta A Mol Biomol Spectrosc,2013,101:132-139.
[9]Rodriguez-Nieto S,Zhivotovsky B. Role of alterations in the apoptotic machinery in sensitivity of cancer cells to treatment[J]. Curr Pharm Des,2006,12(34):4411-4425.
[10]Xie CY,Zhu H,Lin LP, et al. MFTZ-1, an actinomycetes subspecies derived antitumor macrolide, functions as a novel topoisomerase Ⅱpoison[J]. Mol Cancer Ther,2007,6(11):3059-3070.
[11]谢松强,李骞,张亚宏,等.萘酰亚胺-多胺缀合物NNINspm通过PI3K/Akt信号通路诱导肝癌细胞凋亡[J].中国药理学通报,2010,26(2):169-177.
[12]Rohrbach S,Muller-Werdan U,Werdan K,et al. Apoptosis-modulating interaction of the neuregulin/erbB pathway with anthracyclines in regulating Bcl-xS and Bcl-xL in cardiomyocytes[J]. J Mol Cell Cardiol,2005,38(3):485-493.
[13]Yang H,Tian ST,Wu RY,et al. Glycoborinine induces apoptosis through mitochondrial pathway in HepG2 cells[J]. J Asian Nat Prod Res,2014,16(10):991-999.
EffectsofNaringenin-CuComplexonProliferationandApoptosisofHep-G2Cells
DONGJian-jian1,CHENGNan2,HANYong-zhu2
(1.GraduateDivisionofAnhuiUniversityofChineseMedicine,AnhuiHefei230038,China; 2.AffiliatedHospitalofNeurologyInstitute,AnhuiUniversityofChineseMedicine,AnhuiHefei230061,China)
ObjectiveTo observe the effects of naringenin-Cu complex on the proliferation and apoptosis of human hepatocellular carcinoma HepG2 cellsinvitroand to investigate its action mechanism.MethodsHepG2 cells culturedinvitrowere treated with different concentrations of naringenin-Cu complex. MTT assay was used to determine the growth inhibition rate of HepG2 cells; the effect of naringenin-Cu complex on the apoptosis of HepG2 cells stained with 4′,6-diamidino-2-phenylindole was evaluated under a fluorescence microscope; the apoptosis rate of HepG2 cells was determined by flow cytometry; the expression of Bcl-2, Bax, and Caspase-3 in HepG2 cells was measured by Western blot.ResultsNaringenin-Cu complex significantly inhibited the proliferation of HepG2 cells in a dose-dependent manner (within a certain range of concentrations). The fluorescence microscopy showed that HepG2 cells treated with naringenin-Cu complex had marked apoptotic features, with the apoptosis rate increasing in a dose-dependent manner. Naringenin-Cu complex upregulated the expression of Bax and Caspase-3 in HepG2 cells but suppressed the expression of Bcl-2, with a certain dose dependence.ConclusionNaringenin-Cu complex can inhibit the proliferation of HepG2 cells and induce their apoptosis, possibly by upregulating the expression of Bax and Caspase-3 and suppressing the expression of Bcl-2.
naringenin-Cu complex; HepG2 cell; apoptosis; Caspase-3; Bcl-2; Bax
国家自然科学基金项目(81072738,81173212)
董健健(1989-),女,硕士研究生
韩咏竹,hanyongzhutcm@aliyun.com
R285.5
A
10.3969/j.issn.2095-7246.2014.06.016
2014-07-10)

