液相色谱-质谱联用法测定复方氨酚烷胺胶囊人体生物等效性
邵 凤,许 杨,陶保平,陶春蕾,
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽万邦医药有限责任公司,安徽 合肥 230031)
液相色谱-质谱联用法测定复方氨酚烷胺胶囊人体生物等效性
邵 凤1,许 杨2,陶保平2,陶春蕾1,2
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽万邦医药有限责任公司,安徽 合肥 230031)
目的研究复方氨酚烷胺胶囊的人体生物等效性。方法采用双周期交叉实验设计,22名健康男性受试者随机交叉单剂量口服复方氨酚烷胺胶囊试验制剂和参比制剂各1粒。采用液相色谱-质谱联用法测定血浆中对乙酰氨基酚(paracetamol, PAR)、金刚烷胺(amantadine, AMA)、马来酸氯苯那敏(chlorphenamine, CHL)和咖啡因(caffenine, CAF)的浓度,采用DAS3.2.5软件计算药物代谢动力学参数,并采用双侧t检验法和90%置信区间比较主要药物代谢动力学参数(cmax,tmax,t1/2和AUC0-t)。结果受试制剂和参比制剂中PAR、AMA、CAF和CHL的AUC0→t、AUC0→∞、cmax和tmax比较,差异均无统计学意义(P>0.05)。结论本实验方法准确、灵敏、简便,两种制剂具有生物等效性。
液相色谱-质谱联用法;对乙酰氨基酚;盐酸金刚烷胺;马来酸氯苯那敏;咖啡因
复方氨酚烷胺是一种新型抗病毒感冒药,所含主要成分为对乙酰氨基酚(paracetamol,PAR),盐酸金刚烷胺(amantadine hydrochloride,AMA),马来酸氯苯那敏(chlorpheniramine maleate,CHL)和咖啡因(caffeine,CAF)等,可缓解普通感冒或流行感冒引起的发热、头痛、咽痛和打喷嚏等。肖雪等[1]对AMA和PAR的浓度进行了测定,同时杨小萍等[2]对CAF的检测进行了有关报道。与之前的检测方法不同的是,液相色谱(liquid chromatography, LC)-质谱(mass spectrometry, MS)/MS法灵活、高效、快速,并且灵敏度高。所以本实验在优化的实验条件下,同时测定复方中4种成分,以国产已上市的复方氨酚烷胺胶囊为参比制剂,研究另一种国产复方氨酚烷胺胶囊的相对生物利用度和生物等效性,为临床合理用药提供参考。
1 材料与对象
1.1 药品与试剂 ①受试制剂:复方氨酚烷胺胶囊,每粒含PAR 250 mg、AMA 100 mg、CHL 2 mg、人工牛黄10 mg、CAF 15 mg,陕西东泰制药有限公司生产,批号 130501。②参比制剂:复方氨酚烷胺胶囊(商品名:快克),每粒含PAR 250 mg、AMA 100 mg、CHL 2 mg、人工牛黄10 mg、CAF 15 mg,浙江亚峰药厂有限公司生产,批号 1205041。③对照品:PAR(批号 100018-200408)、AMA(批号 100426-201002)、CAF(含量为99.9%,批号171215-201211)、盐酸克伦特罗(clenbuterol hydrochloride,CLE)(批号 100072-200402)、CHL(含量为99.7%,批号 100047-200606)、地西泮(含量为99.9%,批号 171225-200903)均购自中国药品生物制品检定所。
1.2 仪器 AB API 3000型质谱仪:美国AB公司生产;液相色谱仪:Agilent 1100,美国安捷伦公司生产;自动进样器:瑞士CTC ANALYTICS公司生产;GL-16G-Ⅱ型高速冷冻离心机:湖南省长沙湘仪离心机仪器有限公司;SZ-1型快速混匀器:上海沪西仪器分析厂;AB135-S型电子分析天平;GZX-9140MBE型数显鼓风干燥箱。
1.3 受试者的选择 健康男性志愿者22例,体质量52~75 kg,平均体质量(64.27±7.08)kg;年龄19~29岁,平均年龄(22.61±2.39)岁,均无药物过敏史,无肝、肾疾病史,精神状态良好,试验前后经全面体格检查均未发现异常。根据赫尔辛基宣言、国际协调会议的GCP原则,中华人民共和国国家食品药品监督管理局颁布的GCP原则和中华人民共和国药品管理法,在试验开始之前,研究人员向志愿受试者详细说明试验药物的性质,试验的目的、方法,试验的风险和自愿参加的原则,并获得所有志愿受试者的知情同意书。
1.4 给药方案及血样采集 采用开放随机的交叉实验设计,洗脱期为2周。志愿受试者应按照随机表在每个周期的第一天接受两种研究药物(试验制剂和参比制剂)之一,即在禁食过夜至少10 h后,次日早晨空腹以250 mL温水送服1粒复方氨酚烷胺胶囊或参比制剂,注意确保全部药物被服用。2周后交叉服药。于给药前及给药后0.25、0.5、0.75、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0、12.0、24.0、36.0、48.0、72.0、96.0 h采集静脉血,每一阶段总计采集18个点,每点采血8 mL,严格避光。
1.5 数据处理 采用DAS3.2.5数据统计软件对不同时点的血药浓度进行处理,计算有关的药物代谢动力学参数。其中,达峰时间(tmax)及峰浓度(cmax)为实测值,药-时曲线下面积(area under curve, AUC)采用梯形法计算。半衰期(tl/2)按末端相血药浓度对数值和时间进行线性回归,以求得斜率。以复方氨酚烷胺胶囊为参比制剂,计算相对生物利用度。对两种制剂的药物代谢动力学参数进行配对t检验,等效性采用双侧t检验。
2 样本测定及方法学考察
2.1 色谱、质谱条件
2.1.1 PAR、AMA、CAF
1)色谱条件 色谱柱:Welchrom C18(4.6 mm×150 mm×5 μm,月旭);流动相:甲醇∶0.05%甲酸=90∶10;流速:0.7 mL/min;柱温:40 ℃;进样量:10 μL。
2)质谱条件 离子源:电喷雾电离(electrospray ionization,ESI);离子检测方式:质谱多反应监测(multiple reaction monitoring,MRM);离子极性:正离子;离子电压(ionspray voltage,IS):5 000 V;温度:450 ℃;喷雾气(nebulizer, NEB):8;气帘气(curtain,CUR):8;碰撞气(collision,CAD):10。
3)用于定量的离子 ①PAR:[M+H]+m/z:152.000/110.000;锥孔电压(declustering,potential, DP):37 V;碰撞能(collision energy, CE):25 V。②AMA:[M+H]+m/z:152.100/135.000;DP:40;CE:30;扫描时间为0.15 s。③CAF:[M+H]+m/z:195.200/138.000;DP:35;CE:30。④内标CLE:[M+H]+m/z:277.000/203.100;DP:30;CE:30;扫描时间为0.15 s。
2.1.2 CHL
1)色谱条件 色谱柱: Luna NH2(2.0 mm×100 mm×5 μm,菲罗门);流动相:乙腈∶甲醇∶0.1%甲酸=20∶70∶10;流速:0.2 mL/min;柱温:40 ℃;进样量:20 μL。
2)质谱条件 离子源:ESI;离子检测方式:MRM;离子极性:正离子;IS:5 500 V;温度:500 ℃;NEB:12;CUR:12;CAD:8。
3)用于定量的离子 ①CHL:[M+H]+m/z:275.000/229.700;DP:23;CE:30。②内标地西泮:[M+H]+m/z:285.100/154.100;DP:45;CE:40;扫描时间为0.10 s。
2.2 血浆样品处理方法
2.2.1 PAR与AMA:精密量取200 μL血浆,精密加入20 μL内标CLE对照溶液(500 ng/mL),涡旋30 s,加入4 mL乙酸乙酯,震荡涡旋2 min,3 000 r/min离心10 min,取上清液3 mL于试管中,40 ℃氮气吹干,用800 μL甲醇复溶,震荡涡旋1 min,取100 μL于试管中,加400 μL甲醇-水(甲醇∶水=3∶1)震荡涡旋30 s,12 000 r/min离心5 min后,取上清液200 μL于进样管中,10 μL进样分析。
2.2.2 CAF:精密量取200 μL血浆,精密加入20 μL内标CLE对照溶液(1 500 ng/mL),涡旋30 s,加入4 mL乙酸乙酯,震荡涡旋2 min,3 000 r/min离心10 min,取上清液3 mL于试管中,40 ℃氮气吹干,用1 000 μL甲醇复溶,震荡涡旋1 min,取500 μL于试管中,加500 μL甲醇震荡涡旋30 s,12 000 r/min离心5 min后,取上清液200 μL于进样管中,20 μL进样分析。
2.2.3 CHL:精密量取200 μL血浆,精密加入20 μL内标地西泮对照溶液(50 ng/mL),涡旋30 s,加入4 mL提取剂(正己烷∶二氯甲烷=3∶1),震荡涡旋2 min,3 000 r/min离心10 min,取上清液3 mL于试管中,40 ℃氮气吹干,用200 μL流动相复溶,震荡涡旋1 min,12 000 r/min离心5 min后,取上清液150 μL于进样管中,20 μL进样分析。
2.3 方法学建立
2.3.1 标准曲线计算
1)PAR与AMA 取PAR、AMA储备液,依次配制成相当于PAR血浆浓度为100、200、500、1 000、2 000、3 000、5 000、7 000 ng/mL和相当于AMA血浆浓度为2、5、10、20、50、100、200、400 ng/mL的样品,按“2.2”项下方法操作,并以上述色谱、质谱条件进行测定,建立PAR、AMA的标准曲线。PAR标准曲线为y=0.001 07x+0.039 1 (r=0.996 4,权重:1/x2);AMA标准曲线为y=0.028 1x+0.012(r=0.998 9,权重:1/x2)。结果表明PAR在100~7 000 ng/mL范围内线性关系良好,定量下限为100 ng/mL(S/N>10);AMA在2~400 ng/mL范围内线性关系良好,定量下限为2 ng/mL(S/N>10)。
2)CAF 取CAF储备液,依次配制成相当于CAF血浆浓度为10、20、50、100、200、500、1 000、1 500 ng/mL的样品,按“2.2”项下方法操作,得标准曲线为y=0.001 81x+0.004 12(r=0.995 6,权重:1/x2),结果表明CAF在10~1 500 ng/mL范围内线性关系良好,定量下限为10 ng/mL(S/N>10)。
3)CHL 取CHL储备液,依次配制成相当于CHL血浆浓度为0.05、0.1、0.2、0.5、1、2、5、10 ng/mL的样品,按“2.2”项下方法操作,得标准曲线为y=1.04x+0.035(r=0.998 0,权重:1/x2),结果表明CHL在0.05~10 ng/mL范围内线性关系良好,定量下限为0.05 ng/mL(S/N>10)。
2.3.2 专属性测定
1)PAR与AMA专属性 空白血浆、空白血浆加入对照品和内标CLE以及受试者服药后血浆样品,测定结果见图1。PAR、AMA和内标的保留时间分别为2.45、1.75、1.71 min左右。结果显示峰形良好,基线平稳,表明内源性杂质不干扰PAR、AMA和内标的测定。
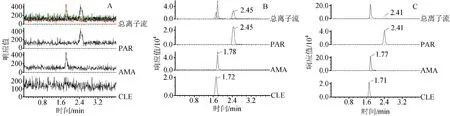
图1空白血浆(A)、空白血浆加入对照品和内标(B)以及服药1.5 h后血浆样品(C)的LC-MS/MS图谱
2)CAF专属性 空白血浆、受试者血浆样品测定结果见图2。CAF和内标CLE的保留时间分别为2.64、1.70 min左右,表明内源性杂质不干扰CAF和内标的测定。

图2空白血浆(A)、空白血浆加入对照品和内标(B)及服药1.5 h后血浆样品(C)的LC-MS/MS图谱
3)CHL专属性 空白血浆、受试者血浆样品测定结果见图3。CHL和内标地西泮的保留时间分别为0.99、1.42 min左右,表明内源性杂质不干扰CHL和内标的测定。
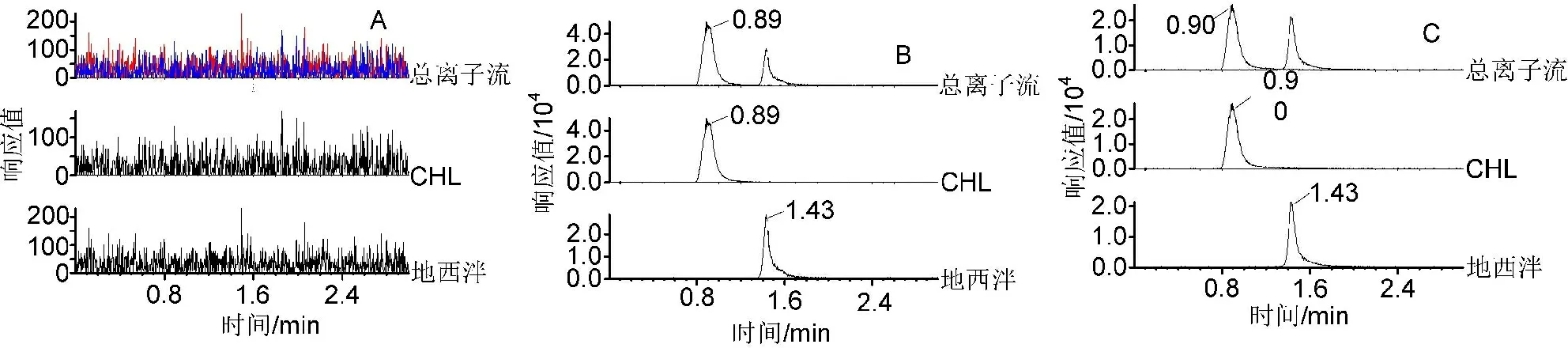
图3空白血浆(A)、空白血浆加入对照品和内标(B)及服药1.5 h后血浆样品(C)的LC-MS/MS图谱
2.3.3 精密度与准确度测定:取各组分的低、中、高质控(quality control, QC)浓度,按“2.2”项下方法操作,每一浓度进行6个样本分析,连续测定3 d,根据当日的标准曲线,计算QC样品的测得浓度。根据QC样品结果计算本法的精密度和准确度,结果见表1。
2.3.4 回收率和基质效应
1)PAR与AMA 分别量取2.5、15、60 μg/mL PAR,40、800、3 200 ng/mL AMA,500 ng/mL内标CLE对照溶液各20 μL于试管中,加入800 μL甲醇,混匀后100 μL加入400 μL甲醇-水(甲醇∶水=3∶1)混匀,取10 μL进样分析,得到PAR、AMA和CLE的峰面积值APAR、AAMA和ACLE。按“2.2.1”方法操作,得到PAR、AMA和CLE的峰面积值BPAR、BAMA和BCLE。量取空白血浆,按“2.2.1”方法操作,得到PAR、AMA和CLE的峰面积值CPAR、CAMA和CCLE。按下式计算:提取回收率=B/C×100%;基质效应=C/A×100%。得出PAR的提取回收率为97.2%~100.0%,AMA的提取回收率为95.6%~98.9%,CLE的平均提取回收率为97.5%。PAR的基质效应范围为95.2%~100.2%,AMA的基质效应范围为99.3~100.6%,CLE的平均基质效应为98.7%。
2)CAF和CHL 分别按照上述PAR和AMA回收率和基质效应测定的步骤,依法操作。结果CAF的提取回收率为96.98%~99.34%,CLE的平均提取回收率为99.54%;CAF的基质效应范围为91.09%~95.57%,CLE的平均基质效应为96.63%;CHL的提取回收率为84.18%~102.67%,内标地西泮为105.66%,CHL的基质效应范围为86.02%~93.17%,内标地西泮的基质效应为88.75%。
2.3.5 样品稳定性测定:为考察血样在采集后和贮存中的稳定性,分别测定了其在常温和冷冻条件下的稳定性。结果见表2、表3、表4和表5。
3 结果
3.1 血药浓度-时间曲线 22例受试者口服受试制剂复方氨酚烷胺胶囊和参比制剂复方氨酚烷胺胶囊后PAR、AMA、CAF、CHL的血药浓度-时间曲线见图4。
3.2 药物代谢动力学参数 采用DAS3.2.5数据分析软件计算4种组分的药物代谢动力学参数,结果见表6。将表6中参数经过自然对数转换,tmax采用非参数检验法,生物等效性评价是通过计算受试制剂和参比制剂cmax、AUC0-t和AUC0-∞的对数比值的90%置信区间进行的。AUC的对数比值的90%置信区间为80%~125%,cmax的对数比值的90%置信区间为80%~125%,则可判定两种制剂具有生物等效性。

表1 复方氨酚烷胺胶囊各组分的精密度和准确度

表2 PAR在血浆中稳定性考察
注:稳定性=(考察项各浓度样品实测浓度的平均值/室温放置0 h各浓度样品实测浓度的平均值)×100%。

表3 AMA在血浆中稳定性考察
注:稳定性=(考察项各浓度样品实测浓度的平均值/室温放置0 h各浓度样品实测浓度的平均值)×100%。
3.3 相对生物利用度 以参比制剂作对照,PAR的相对生物利用度的F(AUC0-t相对生物利用度)和F1(AUC0-∞相对生物利用度)分别为(99.7±1.9)%和(100±3.3)%,AMA的相对生物利用度的F和F1分别为(99.9±3.1)%和(99.8±3)%,CAF的相对生物利用度的F和F1分别为(100.4±2)%和(100.5±2)%,CHL的相对生物利用度的F和F1分别为(100.3±3.9)%和(100±4.1)%,F和F1的均值均在80%~125%内,符合相对生物利用度的要求。
3.4 生物等效性评价 复方氨酚烷胺胶囊受试制剂和参比制剂中PAR、AMA、CAF和CHL的AUC0→t、AUC0→∞和cmax经对数转换后进行方差分析,并进一步采用双侧t检验和90%置信区间法进行生物等效性评价,tmax采用非参数检验法。统计结果表明,受试制剂和参比制剂中PAR、AMA、CAF和CHL的AUC0→t、AUC0→∞和cmax比较,差异均无统计学意义(P>0.05)。非参数检验结果显示,两制剂中PAR、AMA、CAF和CHL的tmax比较,差异无统计学意义(P>0.05)。根据以上结果,判定两制剂生物等效。90%置信区间见表7。

表4 CAF在血浆中稳定性考察
注:稳定性=(考察项各浓度样品实测浓度的平均值/室温放置0 h各浓度样品实测浓度的平均值)×100%。

表5 CHL在血浆中稳定性考察
注:稳定性=(考察项各浓度样品实测浓度的平均值/室温放置0 h各浓度样品实测浓度的平均值)×100%。

图4 PAR、AMA、CAF和CHL的平均血药浓度-时间曲线
4 讨论
在检测条件的确立上,首先采用将4种成分放在一起检测,但是在摸索过程中发现PAR和AMA放在一起从仪器响应和浓度上都比较合适,而CHL由于检测限要求非常低,与其余3种成分放在一起检测均不合适,所以将其单独用一种方法检测。CAF在仪器响应上与其他3种也不相同,所以也采用单独的方法检测。
在提取剂的选择方面,比较了乙醚、二氯甲烷、叔丁基甲醚、乙醚-二氯甲烷(2∶1)、乙酸乙酯、正己烷-二氯甲烷(3∶1),发现PAR、AMA、CAF用乙酸乙酯的提取效率最好,而CHL用正己烷-二氯甲烷(3∶1)的提取效率最好。
试验中22例受试者在服用试验制剂和参比制剂复方后,测定其血浆中4种成分的浓度,并计算了其主要的药物代谢动力学参数,所得结果均与文献[1,6]的报道相近。经过方差分析和双侧t检验,证明两制剂的体内过程基本相似,继而判断复方氨酚烷胺胶囊受试制剂和参比制剂具有生物等效性。

表6 口服复方氨酚烷胺胶囊受试制剂和参比制剂后的药物代谢动力学参数(n=22)
注:cmax指血药浓度峰值;tmax指达到血药浓度峰值的时间;t1/2指半衰期;AUC0→t指在t时间下的药-时曲线下的面积;AUC0→∞指时间为无穷大时的药-时曲线下面积。

表7 PAR、AMA、CAF和CHL的90%置信区间
整个研究期间,22例健康志愿者中无一例因不良反应而终止试验,其血常规、血液生化、尿常规以及心电图检查在试验前后均未见异常,说明本品在试验剂量下具有良好的安全性。
[1]肖雪,张丹,赵婷,等. LC-MS法同时测定人血浆中对乙酰氨基酚和金刚烷胺的浓度及其制剂的人体生物等效性研究[J].中国药房,2012,23(18):1671-1673.
[2]杨小萍,谢跃勤,丁茹. HPLC-DAD法测定复方氨酚烷胺片中的咖啡因[J].合肥师范学院学报,2011,29(3):77-79.
[3]狄斌,杭太俊,陈珺,等. LC-MS/MS法研究氨酚烷胺胶囊的人体药动学及相对生物利用度[J].药物分析杂志,2008,28(6):877-883.
[4]薛洪源.复方氨酚烷胺片在健康人体的相对生物利用度[J].现代医药卫生,2005,21(4):282-286.
[5]杨昭毅,魏伟,肖峰,等.复方氨酚烷胺胶囊人体相对生物利用度研究[J].中国新药杂志,2006,15(11):912-915.
[6]郑永,邹品文,魏来,等.单剂量口服复方氨酚烷胺胶囊在人体内的生物等效性[J].华西药学杂志,2007,22(2):183-187.
[7]王晓波,袭荣刚,姜爽,等.氨酚咖黄烷胺片在人体的生物等效性研究[J].中国药师,2011,14(1):29-33.
EvaluationofBioequivalenceofCompoundParacetamolandAmantadineHydrochlorideCapsulesandReferenceCapsulesbyLiquidChromatography-MassSpectrometry
SHAOFeng1,XUYang2,TAOBao-ping2,TAOChun-lei1,2
(1.CollegeofPharmacy,AnhuiUniversityofChineseMedicine,AnhuiHefei230012,China; 2.AnhuiWanbangMedicalTechnologyCo.,Ltd.,AnhuiHefei230031,China)
ObjectiveTo study the bioequivalence of compound paracetamol and amantadine hydrochloride capsules and reference capsules in healthy volunteers.MethodsThis study was conducted in 22 healthy male volunteers using an open, randomized, two-period crossover design. Each subject was orally administered a compound paracetamol and amantadine hydrochloride capsule and a reference capsule. Liquid chromatography-mass spectrometry was used to determine the concentrations of paracetamol (PAR), amantadine (AMA), chlorphenamine (CHL), and caffeine (CAF) in plasma. The pharmacokinetic parameters (cmax,tmax,t1/2, and AUC0-t) of the four components were calculated by DAS3.2.5 program, and two-sidedttest and 90% confidence interval were used to compare the four parameters between test capsules and reference capsules.ResultsThere were no significant differences in AUC0-t, AUC0→∞,cmax,andtmaxof PAR, AMA, CAF, and CHL between test capsules and reference capsules (P>0.05).ConclusionThis method is accurate, sensitive, and simple, and the test capsules and reference capsules have bioequivalence.
liquid chromatography-mass spectrometry; paracetamol; amantadine hydrochloride; chlorpheniramine; caffeine
邵凤 (1989-),女,硕士研究生
陶春蕾,1225433686@qq.com
R969.1
A
10.3969/j.issn.2095-7246.2014.06.024
2014-02-27)

