肠道清洁对T-RFLP分析溃疡性结肠炎肠黏膜菌群多样性的影响*
冉文斌 欧阳钦 史 维 孙晓滨 王 琼
四川大学华西医院消化内科1(610041) 成都市第三人民医院消化内科2
溃疡性结肠炎(UC)是一种以反复发作的腹痛、黏液脓血便等为主要临床表现的慢性非特异性肠道炎性疾病,发病率呈逐年上升的趋势。近年来,肠道微生物在UC发病机制中的作用备受关注。有研究[1]发现,UC患者存在肠道菌群失调,其肠道细菌的构成和分布与正常人群具有显著差异。目前,微生物指纹图谱技术、高通量测序技术等多种检测微生物系统多样性的技术已广泛应用于UC的相关研究中[2]。末端限制性片段长度多态性(terminal restriction fragment length polymorphism, T-RFLP)分析是一种分析生物群落的指纹技术,可对生物群体的特定基因进行定性和定量测定,具有重复性、稳定性以及敏感性高等优点,广泛应用于菌种的鉴定、分类、卫生监测、法医物证等领域[3-5]。既往应用T-RFLP检测肠道黏膜菌群多样性的研究中,采集肠黏膜前通常需行肠道清洁准备,而清洁剂多为渗透性电解质,可改变黏膜表面细菌构成,从而使结果产生偏倚。本研究以UC患者为研究对象,采用T-RFLP技术对接受和未接受肠道清洁的肠黏膜标本的细菌群落进行研究,旨在了解肠道清洁对T-RFLP分析UC患者肠黏膜菌群多样性的影响。
对象与方法
一、研究对象
纳入2010年9月~2012年11月四川大学华西医院收治的UC患者,诊断标准参考“对我国炎症性肠病诊断治疗规范的共识意见”[6]。纳入标准:① 过去2个月内未曾使用抗菌药物、益生菌或相关抗菌中药;②年龄18~65岁,且UC于18岁后发病;③排除UC活动期伴明显感染征象者;④排除合并严重肝、肾、肺等重要脏器功能衰竭或糖尿病、肥胖等代谢性疾病以及其他原因不能完成结肠镜检查者。根据结肠镜检查前是否行肠道清洁,将患者分为洗肠组和未洗肠组。根据Baron内镜评分标准,自定义评分≥2分为内镜下活动,≤1分为内镜下缓解。所有入选患者均签署知情同意书。
二、研究方法
1. 标本采集和保存:结肠镜下取直肠、乙状结肠交界处肠黏膜组织,置于液氮暂存,24 h内转存于-80 ℃冰箱待测。
2. T-RFLP检测:以20 mg/mL 90 μL溶菌酶[研域(上海)化学试剂有限公司]作用于肠黏膜标本30 min,1 000×g离心3 s,采用DNA提取试剂盒[天根生化科技(北京)有限公司],按照试剂盒说明书提取DNA,采用细菌通用引物27F-1492R对提取的DNA行特异性扩增,荧光标记上游引物27F。引物碱基序列27F:5’-FAM-AGA GTT TGA TCC TGG CTC AG-3’; 1492R:5’-GGT TAC CTT GTT ACG ACT T-3’。PCR反应条件:95 ℃ 预变性3 min;95 ℃ 变性 30 s,52 ℃退火 30 s,72 ℃延伸 90 s,共30个循环;最后72 ℃延伸 10 min。采用PCR产物纯化试剂盒(美国Omega公司)提纯扩增产物,分别使用限制性内切酶MspⅠ、HaeⅢ(Fermentas公司)于37 ℃恒温水箱中对纯化产物避光酶切 4 h,然后将产物置于80 ℃恒温水箱中失活内切酶 20 min,1 000×g离心3 s,低温保存送北京擎科生物有限公司,以3730XL型基因测序仪(Applied Biosystems公司)检测目标片段长度和荧光强度。
3. 数据采集和分析:采用Genemarker V1.4软件进行图像数字信息转换,以50荧光单位为荧光强度记录底线值,记录30~600 bp末端限制片段(T-RF)的信息。定义物种丰度(S)为操作分类单元(OTU)的个数,即T-RFLP图谱中波峰个数[7];定义同一组样本中,在50%以上的样本中出现的波峰为优势峰,对应片段长度为优势T-RF。用曲线下面积比值(AUC)表示每个OTU的峰下面积比值,进行相对定量分析,AUC(%)=单个T-RF峰面积/总峰面积×100%。采用Bio-DAP软件计算物种多样性指数,包括Shannon-Wiener指数(H’)、Simpson指数(D)、均匀度指数(E),其中H’=ΣPilnPi(Pi为某个峰的峰高占总峰高的比例,Pi=Ni,Ni为某个峰的峰面积),D=1-ΣPi2,E=H/lnS。
三、统计学分析
结 果
一、一般情况
共38例患者入选。洗肠组18例,其中男10例,女8例,年龄22~47岁,平均(35.2±9.7)岁;未洗肠组20例,其中男10例,女10例,年龄23~51岁,平均(33.4±12.2)岁。洗肠组中内镜下活动12例,内镜下缓解6例;未洗肠组中内镜下活动15例,内镜下缓解5例。两组患者性别、年龄、疾病活动度构成比差异无统计学意义(P>0.05)。
二、聚类分析
根据不同T-RF的相对含量构成比对两组样本进行聚类分析,结果表明洗肠组与未洗肠组间聚类交叉明显,未能将两组分入不同子聚类(见图1),提示两组菌落构成成分相似。
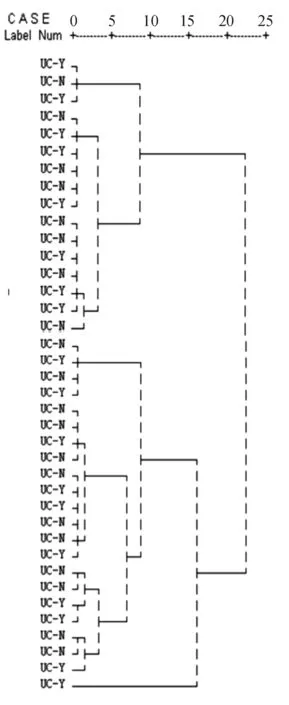
UC-Y:洗肠者;UC-N:未洗肠者
三、肠道菌群多样性比较
1. 丰度:洗肠组、未洗肠组经MspⅠ、HaeⅢ、MspⅠ+HaeⅢ酶切所得的OTU数量相比差异均无统计学意义(21.2±11.7对18.7±9.0;15.0±11.3对15.6±9.7;36.2±17.4对34.3±12.6)(P>0.05)。
2. 物种多样性指数:未洗肠组Shannon-Wiener指数较洗肠组显著增高(2.40±0.45对2.01±0.39,P=0.042);洗肠组、未洗肠组Simpson指数、均匀度指数差异无统计学意义(0.21±0.06对0.23±0.14;0.82±0.05对0.74±0.21)(P>0.05)。
3. 优势T-RF及其相对含量:在MspⅠ酶切结果中,未洗肠组优势T-RF为35、66、74、94、141、221、227、281、311、486、490 bp;洗肠组优势T-RF为35、37、66、74、94、141、221、227、311、486、490 bp;281 bp为未洗肠组特有优势T-RF,37 bp为洗肠组特有优势T-RF;HaeⅢ酶切结果与之相似。对两组共有优势T-RF的AUC比较显示,洗肠组490 bp T-RF的AUC显著高于未洗肠组,其余优势T-RF的AUC在两组间比较差异无统计学意义(P>0.05)(见表1)。
讨 论
人类消化系统中的细菌数量达1013~1014cfu,从胃至远端结肠逐渐增多,以结肠的密度最大,约400~500种,主要为专性厌氧菌。细菌在肠腔中除自上而下垂直分布的差异外,肠腔内、肠上皮外黏液层表面、黏液层内部、肠上皮表面的细菌分布亦存在差异[8-9]。McGuckin等[10]的研究指出,结肠肠腔中含有大量厌氧菌,黏液层内部偏外侧700 μm处主要由变性黏液、低浓度抗菌肽以及少量细菌构成,内侧100 μm处主要由黏附牢靠的黏液、高浓度抗菌肽以及极少量细菌或无菌状态构成,更内层的结肠隐窝则完全无菌,由大量黏液、产生抗菌肽的上皮细胞以及潜在活性的白细胞等构成。因此,研究结肠黏膜菌群的理想标本应于内镜下直接采集结肠组织,而不进行肠道清洁,以免对黏膜菌群的构成产生影响,造成研究结果偏倚。
聚类分析常用于样本数量和种类众多的生物多样性研究,根据样本间的相似度,将其分为相对同质的组群,分析结果较传统分类方法更细致、全面、合理。本研究对UC洗肠组和未洗肠组进行聚类分析,结果显示两组样本间聚类交叉明显,未能将两组分入不同子聚类,提示洗肠组与未洗肠组间肠道细菌种类总体构成相似,无明显差异。
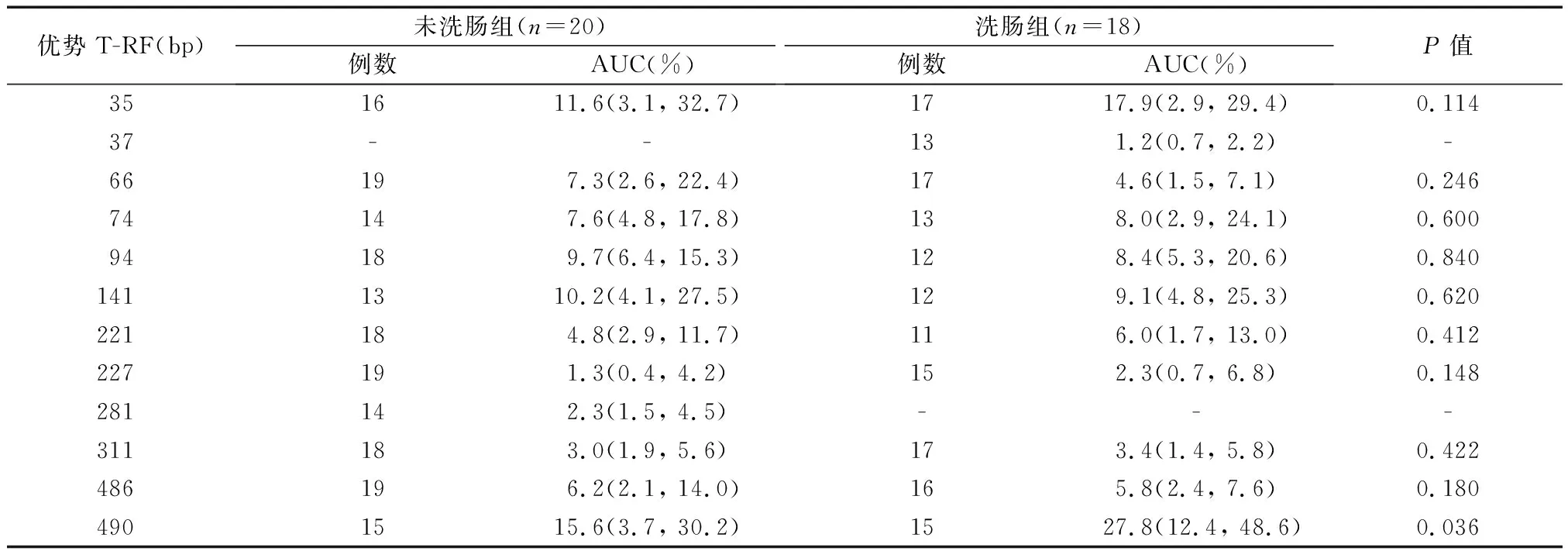
表1 洗肠组、未洗肠组优势T-RF相对含量比较M(Q1, Q3)
除聚类分析外,Shannon-Wiener指数、Simpson指数、均匀度指数亦可反映不同群落中的微生物多样性,其中均匀度指数反映一个群落中全部物种个体数目分配的均匀程度, Shannon-Wiener指数和Simpson指数能够同时反映丰度和均匀度,但前者易受罕见种类影响,后者对优势种类改变较为敏感[11]。本研究发现,洗肠组与未洗肠组的菌群多样性在丰度方面无明显差异;未洗肠组Shannon-Wiener指数明显高于洗肠组,两组间Simpson指数和均匀度指数均无明显差异,提示洗肠组和未洗肠组菌群种类的总数量和优势种类数量无明显差异,但未洗肠组罕见细菌的种类增加。进一步对优势T-RF及其相对含量的比较证实,洗肠组和未洗肠组间总体细菌种类无明显差异,个别种类存在显著差异,但具体细菌种类尚不能明确。
综上所述,肠道清洁对T-RFLP技术研究肠黏膜菌群结果无明显影响,但可造成肠黏膜部分罕见菌群减少,然而由于T-RFLP方法的局限,尚不能明确该细菌的种类,有待后续应用更多的限制性内切酶,并增加样本量进行研究。
1 Sartor RB. Microbial influences in inflammatory bowel diseases[J]. Gastroenterology, 2008, 134 (2): 577-594.
2 Sepehri S, Kotlowski R, Bernstein CN, et al. Microbial diversity of inflamed and noninflamed gut biopsy tissues in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2007, 13 (6): 675-683.
3 Waldron LS, Ferrari BC, Gillings MR, et al. Terminal restriction fragment length polymorphism for identification ofCryptosporidiumspecies in human feces[J]. Appl Environ Microbiol, 2009, 75 (1): 108-112.
4 Spasenovski T, Carroll MP, Payne MS, et al. Molecular analysis of diversity within the genusPseudomonasin the lungs of cystic fibrosis patients[J]. Diagn Microbiol Infect Dis, 2009, 63 (3): 261-267.
5 Lenz EJ, Foran DR. Bacterial profiling of soil using genus-specific markers and multidimensional scaling[J]. J Forensic Sci, 2010, 55 (6): 1437-1442.
6 中华医学会消化病学分会炎症性肠病协作组. 对我国炎症性肠病诊断治疗规范的共识意见[J]. 胃肠病学, 2007, 12 (8): 488-495.
7 Engebretson JJ, Moyer CL. Fidelity of select restriction endonucleases in determining microbial diversity by terminal-restriction fragment length polymorphism[J]. Appl Environ Microbiol, 2003, 69 (8): 4823-4829.
8 Berg RD. The indigenous gastrointestinal microflora[J]. Trends Microbiol, 1996, 4 (11): 430-435.
9 Kohyama A, Ogawa H, Funayama Y, et al. Bacterial population moves toward a colon-like community in the pouch after total proctocolectomy[J]. Surgery, 2009, 145 (4): 435-447.
10 McGuckin MA, Eri R, Simms LA, et al. Intestinal barrier dysfunction in inflammatory bowel diseases[J]. Inflamm Bowel Dis, 2009, 15 (1): 100-113.
11 Keylock CJ. Simpson diversity and the Shannon-Wiener index as special cases of a generalized entropy[J]. Oikos, 2005, 109 (1): 203-207.

