P-选择素在基因敲除小鼠肺转移中的作用研究
亓翠玲 李斌 杨扬 叶杰 王丽京 黄韧
P-选择素是选择素家族的重要成员,主要在活化的血小板和血管内皮细胞上表达,可以通过与单核细胞、中性粒细胞表面的P-选择素配体结合,从而介导活化血小板或内皮细胞与中性粒细胞、单核细胞黏附,因而P-选择素在血栓形成和炎症中发挥重要作用[1-3]。P-选择素还可与肿瘤细胞表面的配体结合介导肿瘤细胞与血小板及内皮细胞的黏附,从而促进肿瘤转移,但P-选择素对于黑色素瘤肺转移的作用尚未见报道,本研究利用P-选择素敲除小鼠观察P-选择素对黑色素瘤细胞肺转移的作用。
材料与方法
一、肿瘤细胞和实验动物
B16黑色素瘤细胞株购于上海细胞生物研究所,常规培养于含10%小牛血清的RPMI-1640培养液中。P-选择素敲除的小鼠 (P-sel-/-)购自Jackson lab(小鼠背景为C57),6~8周龄。C57小鼠,购自广东省医学实验动物中心,6~8周龄,在无特定病原体(SPF)条件下饲养。
二、肺转移模型建立
1.实验动物分组和建模
P-选择素敲除雌性小鼠(16只)为实验组,以C57雌性小鼠(15只)作为对照组。取对数生长期B16F10细胞,经胰酶消化后用无血清培养液重悬收集细胞,用无菌PBS调整细胞密度。用台盼蓝染细胞确定活细胞数在95%以上,于每只小鼠尾静脉注射1×105个(0.2 ml)细胞。
2.肿瘤转移观察
在接种肿瘤细胞的第21天,用断颈法处死小鼠,分离小鼠的肺组织,在10倍倒置显微镜下计数肺表面的转移结节的数目,只要有黑色转移灶就算一个转移结节。
三、HE染色步骤
石蜡组织脱蜡至水,自来水冲洗,苏木精液染色,流水稍洗去苏木精液后,1%盐酸乙醇酸化,稍水洗,促蓝液返蓝水洗后,用曙红液染色,脱水后,中性树胶封片。显微镜下观察结果。
四、统计学处理
采用SPSS11.0统计软件和Sigmaplot软件处理(Mann-Whitney test),比较各组间是否具有显著性差别。P<0.05为差异有统计学意义。
结 果
一、小鼠肺转移情况
P-选择素敲除小鼠和C57小鼠尾静脉注射B16黑色素瘤细胞,在小鼠第21天时处死小鼠,分离肺组织,C57小鼠和P-选择素敲除小鼠肺表面都有黑色的转移瘤(见图1)。P-选择素敲除小鼠肺表面转移的肿瘤结节的数目明显比C57小鼠少,两者比较差异有统计学意义 (t=4.01,P=0.00015),见图2。

图1 小鼠尾静脉注射B16黑色素瘤细胞第21天小鼠肺转移肿瘤
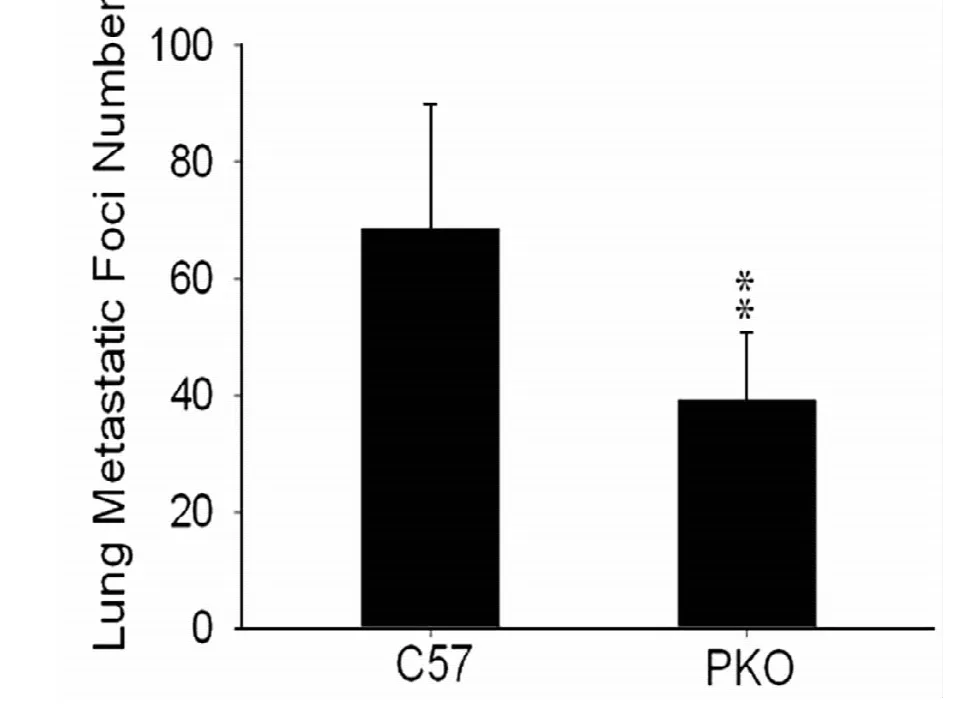
图2 C57小鼠和P-选择素敲除小鼠肺表面转移的肿瘤结节数比较
二、HE染色证实小鼠肺组织中有B16细胞的肺转移灶
P-选择素敲除小鼠和C57小鼠肺组织固定包埋后,HE染色发现肺组织中确实有肿瘤转移灶,见图3。
讨 论
黏附分子是一类能介导细胞间黏附以及细胞与细胞外基质黏附的糖蛋白。选择素是细胞黏附分子家族成员之一,选择素家族参与了炎症发生、淋巴细胞归巢、凝血以及肿瘤转移等生理和病理过程。P-选择素是黏附分子选择素家族的重要成员。P-选择素可以表达在活化的血小板和内皮细胞表面,而许多肿瘤细胞表面存在P-选择素配基[包括P选择素糖蛋白配体-1(PSGL-1)、sia1vl Lewis X(sLex)等糖基结构的糖蛋白、糖脂等],如乳腺癌、结直肠癌、肺癌、肝癌、肾脏细胞癌、鳞状上皮癌等,这些受体可与P-选择素结合介导肿瘤细胞与血小板及内皮细胞的黏附,从而促进肿瘤细胞转移[4]。Reyes-Reyes等[5]表明P-选择素可以通过PI3-K和p38 MAPK通路促进结肠癌的转移。

图3 C57小鼠和P-选择素敲除小鼠肺转移瘤组织HE染色后的显微镜下观察
利用P-选择素基因敲除小鼠研究发现,P-选择素缺失会抑制肿瘤的生长和转移[6-8]。Iwamura等[9]观察到P-选择素在肿瘤中表达增加促进了新生血管形成,而且已经提出细胞表面黏附分子和内皮间的相互作用对于肿瘤的转移和新生血管形成起了重要作用。利用基因敲除小鼠建立肿瘤研究模型是当今肿瘤学研究的最新趋势。基因敲除小鼠模型在肿瘤研究上具有其它模型无法比拟的优势:在不伴有药物副作用的情况下,基因产物的作用被完全消除,因此可以研究单个基因在动物体内的功能。在P-选择素敲除小鼠体内P-选择素的功能完全缺失,因此可以利用此小鼠在体内研究P-选择素对肿瘤生长和转移的影响。
本研究将B16F10黑色素瘤细胞通过尾静脉注射到P-选择素敲除小鼠和C57小鼠体内,建立肺转移瘤模型,此模型具有肿瘤发生率高、易建立、均一性好、个体差异小等优点。结果表明P-选择素敲除小鼠B16F10黑色素瘤细胞的肺转移结节明显比C57小鼠少,提示P-选择素缺失可能抑制了黑色素瘤的肺转移,但P-选择素对B16F10细胞肺转移的作用机制还不明确,需要进一步的探讨。若对P-选择素在肿瘤生长和转移中的作用进一步探讨,可能对于寻找理想的抗肿瘤治疗靶点及判断患者预后具有重要意义。
[1]Wagner DD.P-selectin chases a butterfly.J Clin invest,1995,95:1955-1956.
[2]Gong L,Cai Y,Zhou X,et al.Activated platelets interact with lung cancer cells through P-selectin glycoprotein ligand-1.Pathol Oncol Res,2012,18:989-996.
[3]Schabath H,Runz S,Joumaa S,et al.CD24 affects CXCR4 function in pre-B lymphocytes and breast carcinoma cells.JCell Sci,2006,119:314-325.
[4]Monzavi-Karbassi B,Stanley JS,Hennings L,et al.Chondroitin sulfate glycosaminoglycans as major P-selectin ligands on metastatic breast cancer cell lines.Int J Cancer,2007,120:1179-1191.
[5]Reyes-Reyes ME,George MD,Roberts JD,et al.P-selectin activates integrin-mediated colon carcinoma cell adhesion to fibronectin.Exp Cell Res,2006,312:4056-4069.
[6]Heidemann F,Schildt A,Schmid K,et al.Selectins mediate small cell lung cancer systemic metastasis.PLoS One,2014,9:e92327.
[7]Ding L,Sunamura M,Kodama T,et al.In vivo evaluation of the early events associated with liver metastasis of circulating cancer cells.Br JCancer,2001,85:431-438.
[8]Borsig L,Wong R,Feramisco J,et al.Heparin and cancer revisited:mechanistic connections involving platelets,P-selectin,carcinoma mucins,and tumor metastasis.Proc Natl Acad Sci USA,2001,98:3352-3357.
[9]Iwamura T,Caffrey TC,Kitamura N,et al.P-selectin expression in a metastatic pancreatic tumor cell line(SUIT-2).Cancer Res,1997,57:1206-1212.

