羟氯喹对Toll样受体-9介导的干扰素-α表达水平的影响
张曦 金欧 黄红月 侯成成 古洁若
SLE是一种全身多脏器受累的慢性自身免疫性疾病,其主要特征为内源性核酸类物质对免疫系统的慢性激活[1]。也就是说,SLE患者循环免疫复合物中的DNA/RNA分别被Toll样受体9/7(TLR-9/7)识别后,激活相应的免疫细胞,诱导IFN-α等多种细胞因子的产生[1]。越来越多的研究发现,IFN-α的高表达在SLE的发病中起关键性作用,IFN-α与自身抗体的产生及疾病活动性相关[2]。虽然具体机制尚不清楚,但目前大多数专家认为羟氯喹可阻断TLR识别核酸类物质,从而在SLE的治疗中发挥重要作用。本研究旨在评估羟氯喹是否能够有效抑制因TLR-9激活所致的IFN-α的高表达,现报告如下。
材料与方法
一、实验材料
本研究所使用的健康志愿者的PBMC均是通过蔗糖密度梯度离心法从人外周血白膜中分离所得,分离好的外周血单个核细胞(PBMC)洗涤2次后,使用含10%胎牛血清的RPMI 1640培养基悬浮培养待用。本研究中所用到的白膜由广州血液中心免费提供。
二、主要试剂及仪器
1.主要试剂
包括:人外周血淋巴细胞分离液(天津灏洋生物制剂公司),RPMI 1640细胞培养基、胎牛血清(Hyclone,美国),Trizol总RNA 抽提试剂、ODN 2216(Invitrogen,美国),随机引物逆转录制备模板DNA试剂盒及荧光实时定量PCR系列试剂盒(TakaRa,日本),氯仿、异丙醇、无水乙醇(广州东征公司),焦碳酸二乙酯、羟氯喹(Sigma,美国)。
2.主要仪器
包括:SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司),HF151恒温培养箱(力新仪器有限公司),奥林巴斯IX51显微镜(日本),Thermo Nandrop 2000核酸蛋白分析仪(美国),ABI 2700 PCR仪、ABI 7500荧光定量PCR扩增仪(美国)。
三、方 法
1.细胞水平模拟SLE高表达IFN-α
将TLR-9配体ODN 2216(0、0.375、0.75、1.5、3.0、6.0μg/ml)与健康志愿者来源的PBMC(2×106/ml)在5%CO、37℃的恒温箱内共同培养12 h后,检测不同浓度PBMC中IFN-αmRNA表达水平。另外,使用ODN 2216 1.5μg/ml与健康志愿者来源的PBMC(2×106/ml)在5%CO、37℃的恒温箱内共同培养0、6、12、24、48 h后,检测不同时间PBMC中IFN-αmRNA表达水平。
2.不同处理组PBMC IFN-αmRNA表达水平的检测
使用ODN 2216 1.5μg/ml与健康志愿者来源的PBMC(2×106/ml)在5%CO、37℃的恒温箱内共同培养6 h后,按参考文献[3]分别加入羟氯喹1.25μg/ml(实验组)及等量的培养基(阳性对照组),在未加入ODN 2216的PBMC内加入等量的培养基(空白对照组),继续培养12 h后检测各组PBMC中IFN-αmRNA表达水平。
3.荧光实时定量PCR检测
收集各组细胞,提取各组细胞的总RNA,然后使用实时荧光定量PCR检测不同处理组PBMC中IFN-αmRNA表达水平,引物序列见表1,严格按照试剂盒说明书操作,实验所得数据按ΔΔCt法计算分析。
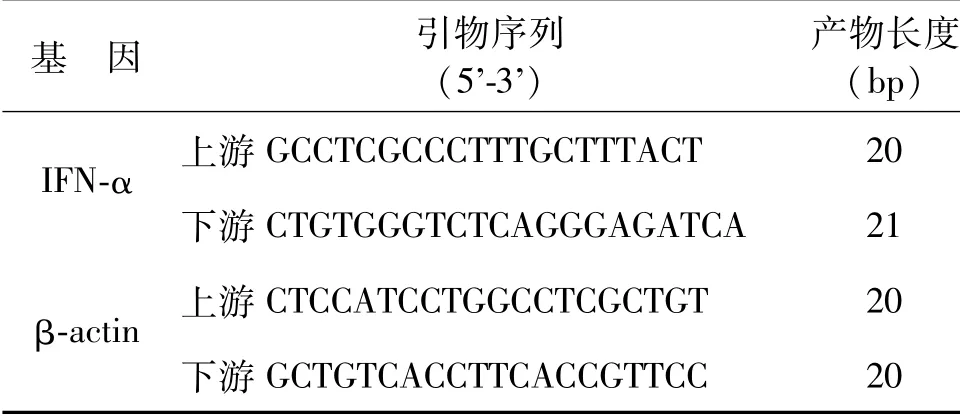
表1 IFN-α及β-actin的引物序列
四、统计学处理
采用SPSS13.0统计分析软件处理数据。实验数据以示,多个处理组间比较采用方差分析,进一步两两比较采用LSD-t检验,两独立样本间的比较使用t检验。以P<0.05为差异有统计学意义。
结 果
一、细胞水平模拟SLE高表达IFN-α的致病状态
1.不同浓度TLR-9对PBMC中IFN-αmRNA表达水平的影响
使用不同浓度的ODN 2216与健康志愿者来源的PBMC共同培养12 h后,不同浓度组PBMC中IFN-αmRNA表达水平比较差异有统计学意义(F=12.728,P<0.001)。其中ODN 2216浓度为1.5 μg/ml的处理组中IFN-αmRNA表达水平最高,且明显高于未予ODN 2216干预组(P<0.001),见图1。
2.不同时间对PBMC中IFN-αmRNA表达水平的影响
使用浓度为1.5μg/ml的ODN 2216分别与健康志愿者来源的PBMC共同培养0~48 h后,不同干预时间组PBMC中IFN-αmRNA表达水平比较差异有统计学意义 (F=17.414,P<0.001)。与1.5μg/ml的ODN 2216共同培养6 h组PBMC中IFN-αmRNA表达水平明显高于未予ODN 2216干预组(P<0.001),见图2。
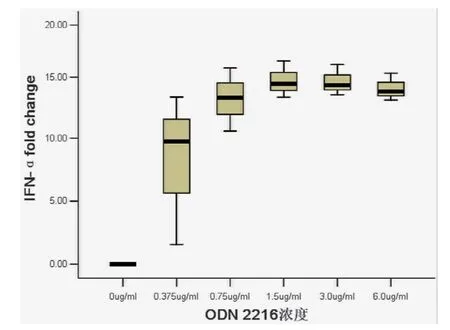
图1 不同浓度ODN 2216与PBMC共同培养12 h后IFN-αmRNA表达水平比较
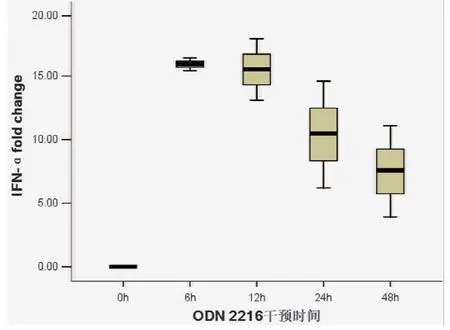
图2 经1.5μg/ml ODN 2216干预不同时间后PBMC中IFN-αmRNA表达水平比较
二、不同处理组PBMC中IFN-αmRNA表达水平比较
阳性对照组PBMC中IFN-αmRNA表达水平明显高于空白对照组(t'=-5.151,P=0.002)。与阳性对照组相比,实验组PBMC中IFN-αmRNA表达水平明显降低(t'=3.34,P=0.042),见图3。
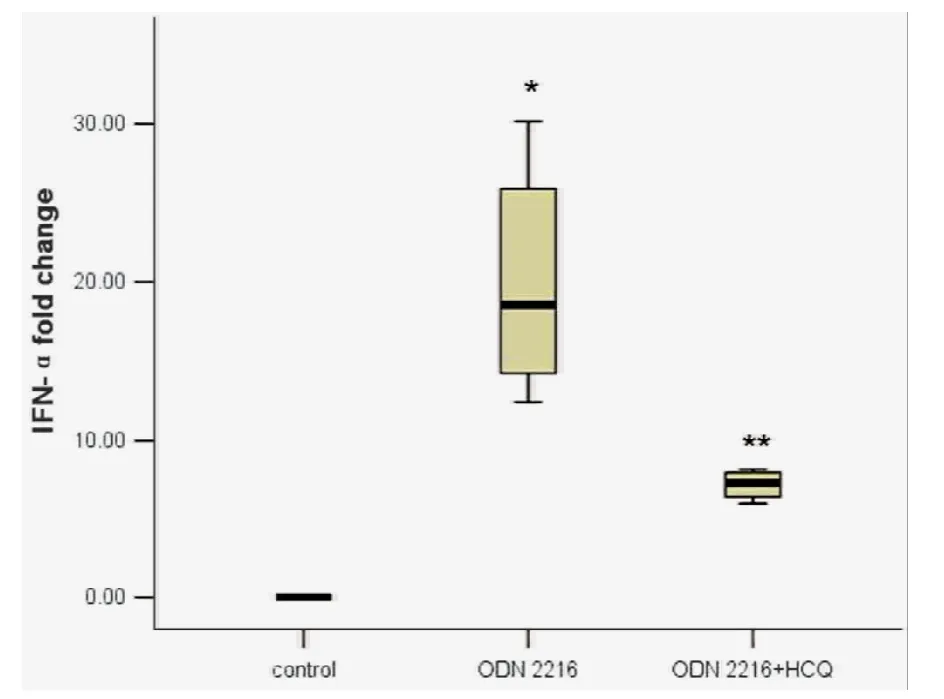
图3 不同处理组PBMC中IFN-αmRNA表达水平比较
讨 论
浆细胞样树突状细胞(pDC)在SLE发病中的起重要作用。无论是在外周血还是淋巴结中,经TLR-7/TLR-9激动剂激活的pDC均被认为是IFN-α的主要来源[4-5]。然而,多项研究发现SLE患者外周循环中pDC数量减少和(或)功能存在障碍[6]。此外,也有学者发现其他类型的细胞(如单核细胞、髓样树突状细胞、B细胞)也可以产生IFNα[5]。因此,除了pDCs外,其他类型的细胞也可能是SLE患者中IFN-α的重要来源。本研究选用包含多种类型细胞的PBMC作为研究对象,使用TLR-9激动剂 (ODN 2216)与PBMC共同培养,在体外成功模拟了SLE患者中IFN-α高表达的致病模型。
抗疟药自1894年起就已用于治疗SLE的皮肤型狼疮[7-8]。一项随机、双盲、安慰剂对照研究发现,使用羟氯喹(抗疟药)治疗的SLE患者较使用安慰剂患者,疾病复发率及严重程度明显降低[5]。早在1998年,羟氯喹已被发现能抑制CpGDNA所诱导的细胞活化[5]。基于羟氯喹的弱碱性特质,大量的研究均认为羟氯喹是通过抑制内体酸化,从而抑制内体中TLR识别核酸类物质[5]。但是,新近研究证实羟氯喹等抗疟药可直接结合TLR上的核酸结合位点,从而抑制TLR[9]。本研究发现羟氯喹可明显著抑制ODN 2216刺激后PBMC中IFN-α的高表达,结合前人的研究,推测羟氯喹可通过抑制TLR-9识别核酸类物质,从而抑制IFN-α的高表达。
综上所述,羟氯喹可明显抑制PBMC中TLR-9介导的IFN-α高表达,考虑到IFN-α在SLE的发病中起关键作用,推测羟氯喹可通过抑制TLR-9介导的IFN-α的高表达,从而有效的控制SLE的病情进展。
[1]Barrat FJ,Coffman RL.Development of TLR inhibitors for the treatment of autoimmune diseases.Immunol Rev,2008,223:271-283.
[2]Banchereau J,Pascual V.Type I interferon in systemic lupus erythematosus and other autoimmune diseases.Immunity,2006,25:383-392.
[3]Costedoat-Chalumeau N,Amoura Z,et al.Lowbloodconcentration of hydroxychloroquine is a marker for and predictor of diseaseexacerbations in patients with systemiclupuserythematosus.Arthritis Rheum.2006,54:3284-90.
[4]Hoshino K,Sugiyama T,Matsumoto M,et al.IkappaB kinase-alpha is critical for interferonalpha production induced by Toll-like receptors 7 and 9.Nature,2006,440:949-953.
[5]Sacre K,Criswell LA,McCune JM.Hydroxychloroquine is associated with impaired interferon-alpha and tumor necrosis factor-alpha production by plasmacytoid dendritic cells in systemic lupus erythematosus.Arthritis Res Ther,2012,14:R155.
[6]Kwok SK,Lee JY,Park SH,et al.Dysfunctional interferon-alpha production by peripheral p lasmacytoid dendritic cells upon Toll-like receptor-9 stimulation in patients with systemic lupus erythematosus.Arthritis Res Ther,2008,10:R29.
[7]James JA,Kim-Howard XR,Bruner BF,et al.Hydroxychloroquine sulfate treatment is associated with later onset of systemic lupus erythematosus.Lupus,2007,16:401-409.
[8]Costedoat-Chalumeau N,Amoura Z,Hulot JS,et al.Hydroxychloroquine in systemic lupus erythematosus.Lancet,2007,369:1257-1258.
[9]Kuznik A1,Bencina M,Svajger U,et al.Mechanism of endosomal TLR inhibition by antimalarial drugs and imidazoquinolines.JImmunol,2011,186:4794-804.

