西妥昔单抗联合含奥沙利铂化疗方案对转移性结直肠癌作用的系统评价和Meta分析
马怀幸 鲁超 余一祎 王妍 锁涛 刘天舒
(复旦大学附属中山医院肿瘤内科,*普外科,上海 200032)
近年来,结直肠癌(colorectal cancer,CRC)在分子靶向治疗方面取得了重要的进展,表皮生长因子受体(epidermal growth factor receptor,EGFR)单抗是最受关注的靶点之一。EGFR(Her-1)为原癌基因c-erbB1的表达产物,是人类表皮生长因子受体家族Her成员之一。目前发现EGFR有7种配体,当EGFR与配体结合后可激活其下游的Ras-Raf-MAPK、PTEN-PI3K-AKT和Jak2/Stat3等信号通路,从而参与细胞的分裂、增殖、生存、侵袭、转移及新生血管的形成。
西妥昔单抗是最早应用于临床的EGFR抗体,早期的研究显示西妥昔单抗单药或联合伊立替康化疗对转移性CRC(metastatic CRC,mCRC)均有获益[1-2]。目前已有的关于西妥昔单抗联合奥沙利铂为主化疗方案对mCRC疗效的研究[3-13]结果并不一致,本研究旨在对相关的随机对照试验(randomized controlled trial,RCT)进行系统评价及meta分析,以客观评估该联合治疗方案对mCRC的疗效及不良反应。
1 资料与方法
1.1 入选研究标准
1.1.1 试验类型 临床随机对照试验,无盲法及语言的限制。对有多个干预组的研究,选择相关的数据纳入。排除交叉试验及按照日期或入院顺序的半随机对照试验。
1.1.2 纳入条件 病理学确诊的进展期或转移性CRC,无转移灶、转移数目限制;无地域、性别的限制;年龄≥18岁;肾功能及骨髓造血功能可;东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态(Performance Status)评分0~2分;预期寿命≥12周;签署知情同意书。
1.1.3 干预类型 西妥昔单抗联合含奥沙利铂方案化疗与含奥沙利铂为主化疗方案比较,无给药方式及剂量限制。如两组同时联合某一药物且无差别,将纳入,必要时行敏感性分析。
1.1.4 结局指标 主要指标:无进展生存期(progression-free survival,PFS);总生存期(overall survival,OS);不良反应。 次要指标:治疗总有效率(overall response rate,ORR),即完全缓解率+部分缓解率;生活质量;治疗费用。
1.2 检索策略 计算机检索以下数据库:Pubmed、SCI-EX-PANDED、EMBASE、 Cochrane library、CBM及CNKI。 英文检索词:(cetuximab or erbitux), oxaliplatin,(randomized controlled trial)or(controlled clinical trial),colorectal and (tumour* or tumor* or carcinom* or adenoma* or neoplasm* or cancer*)。中文检索词:西妥昔单抗或爱必妥、奥沙利铂、结直肠癌、随机对照试验。同时,检索相关会议及正在进行的临床试验(http://www.clinical trials.gov,http://www.controlled-trials.com),并追踪所获得文献的参考文献,以获得更多数据。所有检索更新至2013年9月10日。
1.3 数据提取及分析
1.3.1 纳入研究筛选及数据提取 根据纳入标准,2位研究者在互不知情的情况下独立对检索的原始文献进行评估;如存在不同意见,将与第3位研究者讨论;如仍有异议,则获取全文以进一步决定。同样,由2位研究者独立提取纳入文献的数据,包括研究背景、试验特点(试验设计、随访、质量评估)、纳入人群(纳入及排除标准、样本大小、人群基线、干预措施、失访)及结局指标等。
1.3.2 文献质量评估 根据Cochrane 指南标准对随机分配、分配隐藏、参与者及实施者盲法、测量盲法、失访、选择性报道及其他偏倚7个指标进行偏倚风险评估。偏倚风险分为低、不明确及高3种类型。
1.3.3 数据处理 二分变量、连续变量及与时间相关的指标(PFS、OS)分别采用风险比(risk ratio,RR)、均数差/加权均数差(mean difference/weight mean difference,MD/WMD)和危险比(hazard ratio,HR)及其95% 的可信区间(confidence interval,CI)统计。采用Cochrane 协作网提供的RevMan 5.2软件综合分析数据,采用固定效应模型分析异质性较小的数据,采用随机效应模型分析异质性较大的数据。对于遗失数据,争取联系作者以获得相关数据;如仍不能获得相关数据,则进行意向性分析,即认为末次随访时间为终点事件,分析所有数据,不论其失访或依从性。
1.3.4 异质性分析 采用χ2检验分析各研究间的异质性,如异质性P值<0.1和/或I2>50%,认为其异质性较大。如结果有明显的异质性,首先检测数据是否被正确提取及输入;然后对临床异质性、方法学异质性、统计学异质性进行分析以找出其异质性的来源;必要时行敏感性分析。如仍有异质性,采用随机效应模型统计数据。
1.3.5 发表偏倚 如纳入10篇或以上文献,则采用漏斗图评估发表偏倚。
2 结 果
2.1 文献筛选及纳入文献基线 初步检索到原始文献544篇(英文494篇,中文47篇),最终7个RCTs[4-5,9-13]共3291例(研究组1653例,对照组1638例)纳入系统评价,其中6篇英文文献,1篇中文文献。入选文献的样本量大小在67~1630例,平均为470例;可获得KRAS基因野生型的数据有5篇(研究组769例,对照组785例),其中1篇[11]中的病例均为KRAS基因野生型(该试验研究西妥昔单抗联合FOLFOX或FOLFIRI对KRAS野生型的mCRC的作用,提取其中西妥昔单抗联合FOLFOX的数据);纳入研究的4个化疗方案为奥沙利铂联合5-FU,2个化疗方案为奥沙利铂联合卡培他滨,1个化疗方案为奥沙利铂联合5-FU及奥沙利铂联合卡培他滨。基线资料详见表1。
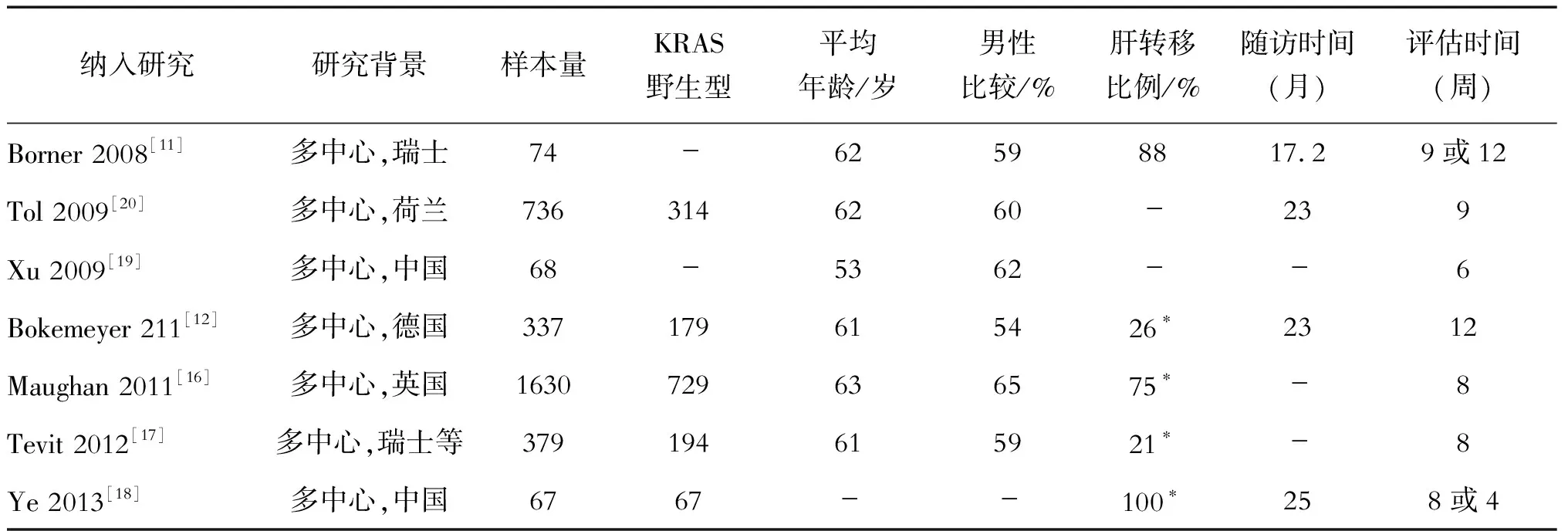
表1 纳入研究的基本特征
2.2 偏倚风险评估 根据Cochrane 指南的标准对纳入文献进行偏倚评估,其中5篇国外研究均给出了随机化的具体方法,2篇国内研究均未给出具体的随机化方案。
2.3 结局指标
2.3.1 主要结局指标:PFS。6项研究报告了该指标,其中5项给出KRAS基因分型。KRAS基因野生型、突变型及总人群综合PFS的HR值分别为0.89(95%CI:0.71~1.12,P=0.31;异质性:P=0.02,I2=67%)、1.17(95%CI:0.84~1.63,P=0.34;异质性:P=0.002,I2=80%)、0.98(95%CI:0.86~1.12,P=0.81;异质性:P=0.04,I2=61%),见图1。由于上述异质性较大,采用随机效应模型分析,结果显示,实验组和对照组在各人群中PFS差异均无统计学意义。Tol等[13]的研究中两组均应用贝伐单抗,因其异质性而将该研究从纳入研究中剔除后行敏感性分析,结果无明显改变。综合的HR值在KRAS基因野生型、突变型及总人群中分别为0.82(P=0.15;异质性P=0.03,I2=67%)、1.07(P=0.75;异质性P=0.008,I2=79%)和0.95(P=0.2;异质性P=0.59,I2=0%)。
2.3.2 主要结局指标:OS。6项研究报告了该指标,综合的HR值在KRAS基因野生型、突变型及总人群分中别为1.00(95%CI:0.92~1.09,P=0.97;异质性:P=0.21,I2=32%)、1.10(95%CI:0.95~1.27,P=0.20;异质性:P=0.19,I2=37%)、1.00(95%CI:0.92-1.08,P=0.95;异质性:P=0.12,I2=43%),见图2。上述研究间异质性均较小,采用固定效应模型分析,结果显示,3种人群中实验组和对照组OS差异均无统计学意义。不含Tol等[13]的研究的敏感性分析显示,OS在两组间差异也无统计学意义,三种人群的HR值分别为0.96(P=0.56)、1.03(P=0.69)、0.99(P=0.89)。
2.3.3 主要结局指标:不良反应。7项研究均给出不良反应指标,但Ye 等[11]的研究未单独列出西妥昔单抗联合FOLFOLX方案所致的不良反应;只有COIN研究[9]报告了19例与治疗相关的死亡,其中研究组9例,对照组10例,两组差异无统计学意义。总的不良反应发生率在西妥昔单抗联合化疗组明显高于对照组,尤其是皮疹(RR=46.06,95%CI:21.89~96.93)、腹泻(RR=1.55,95%CI:1.33~1.81)、过敏反应(RR=1.70,95%CI:1.03~2.79)和乏力(RR=1.34,95%CI:1.01~77);而神经毒性的发生率在实验组低于对照组(RR=0.74,95%CI:0.63~0.88);其余不良反应的发生率在两组间差异无统计学意义。由于异质性的不同,结果分别采用随机和固定效应模型,见图3。
2.3.4 次要结局指标:ORR。7项研究均给出治疗有效率数据,但Ye 等[11]的研究未给出西妥昔单抗联合FOLFOX的亚组数据,而COIN[9]只给出KRAS野生型的ORR。KRAS野生型(RR=1.28,95%CI:1.06~1.55,P=0.01)及总人群(RR=1.25,95%CI:1.03~1.52,P=0.03)实验组中的ORR均显著高于对照组,在KRAS突变型的人群中两组(RR=0.84,95%CI:0.60~1.18,P=0.31)ORR差异无统计学意义,见图4。
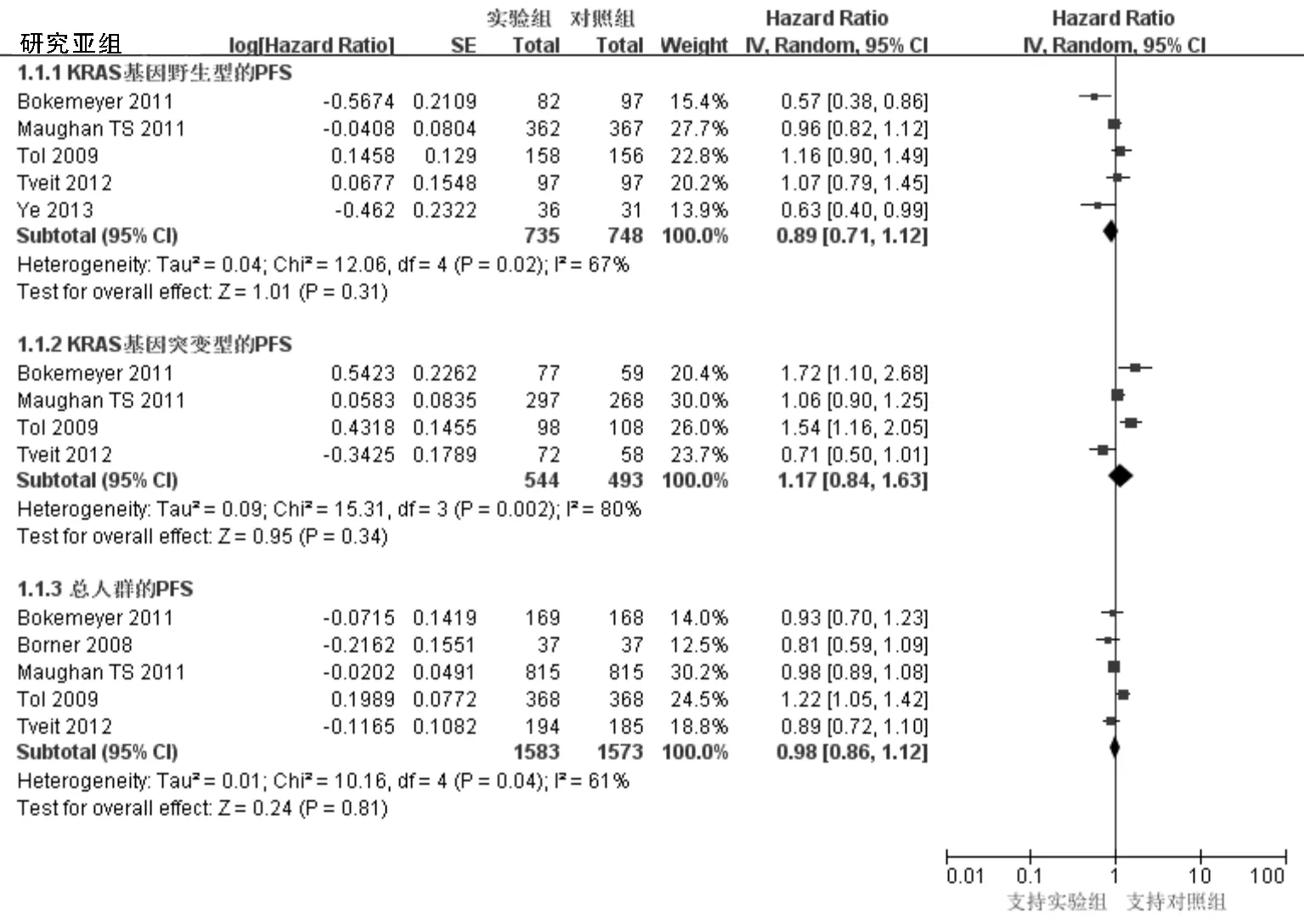
图1 纳入研究PFS的森林图
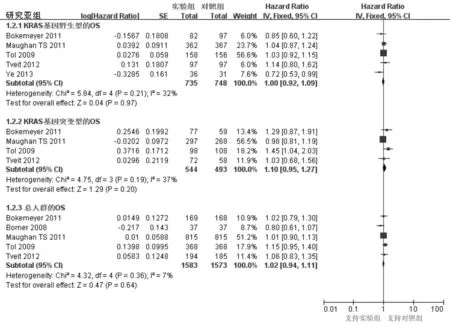
图2 纳入研究OS的森林图
2.3.5 次要结局指标:生活质量。7项研究中只有2项将生活质量作为次要结局指标,但NORDIC-VII研究[10]未报告相关数据。Tol 等[13]的研究结果显示,对照组较实验组有更好的总的生活质量(P=0.007)和一般健康状态(P=0.003)。两组在疼痛、功能减退(躯体上、情绪上、认知上及社会功能上)方面的评分差异无统计学意义。
2.3.6 次要结局指标:治疗费用。7项研究均未报告相关治疗费用,无法行成本—疗效分析。
2.4 发表偏倚 由于纳入研究小于10项,未行漏斗图检测发表偏倚。
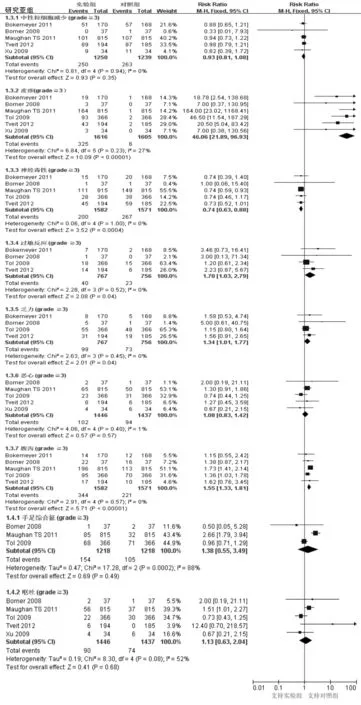
图3 纳入研究不良反应的森林图
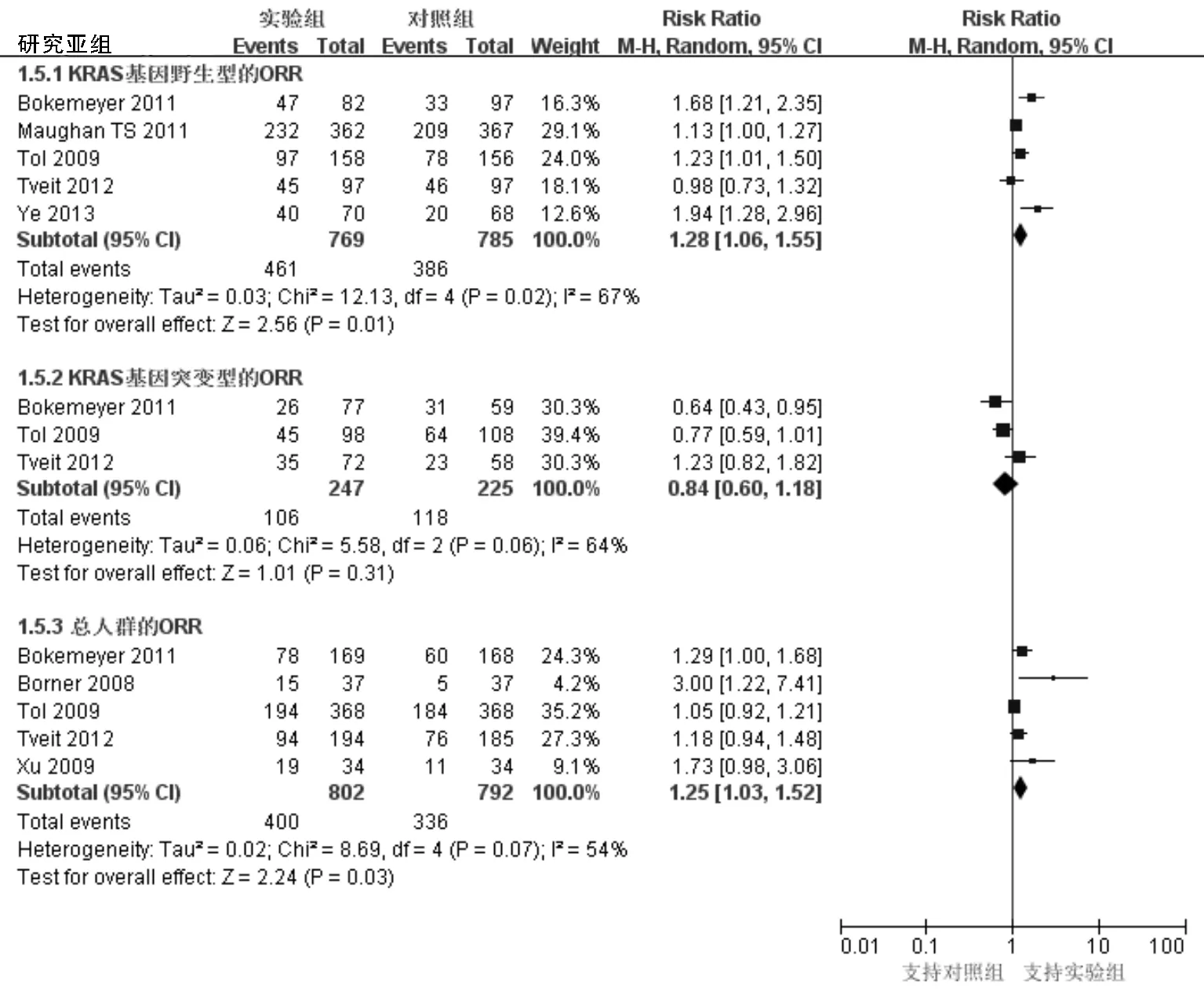
图4 纳入研究ORR的森林图
3 讨 论
本研究进行系统评价的结果显示,在mCRC的一线治疗中,即使在KRAS野生型的患者中,西妥昔单抗联合含奥沙利铂化疗方案与单纯化疗相比也并不能使患者在PFS、OS方面明显获益,且增加了不良反应发生率,但联合方案的治疗有效率显著高于单纯化疗。
本研究的不足包括:(1)本系统评价中部分纳入研究的样本量相对较小,尤其是具有明显获益的几个研究,这可能对综合结果有一定影响;(2)在有些国家,比如我国,西妥昔单抗价格较贵,这可能使得人群的选择有一定偏倚;(3)生活质量问题是最难评估的终点指标之一,本研究中仅有1篇文献报道了该指标;纳入文献均未报道治疗费用问题,无法评估成本—疗效关系。因此,今后仍需进行大规模的RCTs来进一步验证西妥昔单抗联合奥沙利铂为基础的化疗方案对CRC患者的疗效。未来研究中应注意以下方面:首先,应更加注重方法学的规范性,除了随机化,在分配隐藏、盲法及失访等方面的信息也应详细注明,尤其是国内的研究,以利于对文献质量及证据的正确评估;其次,应对随访时间及PFS定义标准及疗效评价时间采用相对统一的标准;再次,在个体化治疗的时代,应更注重患者的生活质量及治疗费用问题;最后,西妥昔的临床应用还处于探讨阶段,未来研究应在预测疗效的特定分子标志物或临床指标、联合用药等方面予以进一步探讨,以找出适合使用该药的人群,提供最适合患者的治疗方案。
[1]Saltz LB,Meropol NJ,Loehrer PJ Sr,et al.phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor[J].J Clin Oncol,2004,22(7):1201-1208.
[2]Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
[3]Tabernero J,Van Cutsem E,Diaz-Rubio E,et al.phase II trial of cetuximab in combination with fluorouracil,leucovorin,and oxaliplatin in the first-line treatment of metastatic colorectal cancer[J].J Clin Oncol,2007,25(33):5225-5232.
[4]Borner M,Koeberle D,Von Moos R,et al.Adding cetuximab to capecitabine plus oxaliplatin (XELOX)in first-line treatment of metastatic colorectal cancer: a randomized phase II trial of the Swiss Group for Clinical Cancer Research SAKK[J].Ann Oncol,2008,19(7):1288-1292.
[5]Bokemeyer C,Bondarenko I,Hartmann JT,et al.Efficacy according to biomarker status of cetuximab plus FOLFOX-4 as first-line treatment for metastatic colorectal cancer: the OpUS study[J].Ann Oncol,2011,22(7):1535-1546.
[6]Ku GY,Haaland BA,de Lima Lopes G Jr.Cetuximab in the first-line treatment of K-ras wild-type metastatic colorectal cancer: the choice and schedule of fluoropyrimidine matters[J].Cancer Chemother pharmacol,2012,70(2):231-238.
[7]Colucci G,Giuliani F,Garufi C,et al.Cetuximab plus FOLFOX-4 in untreated patients with advanced colorectal cancer: a Gruppo Oncologico dell'Italia Meridionale Multicenter phase II study[J].Oncology,2010,79(5-6):415-422.
[8]Ocvirk J,Brodowicz T,Wrba F,et al.Cetuximab plus FOLFOX6 or FOLFIRI in metastatic colorectal cancer: CECOG trial[J].World J Gastroenterol,2010,16(25):3133-3143.
[9]Maughan TS,Adams RA,Smith CG,et al.Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: Results of the randomised phase 3 MRC COIN trial[J].The Lancet,2011,377(9783):2103-2114.
[10]Tveit KM,Guren T,Glimelius B,et al.phase III trial of cetuximab with continuous or intermittent fluorouracil,leucovorin,and oxaliplatin (Nordic FLOX)versus FLOX alone in first-line treatment of metastatic colorectal cancer: the NORDIC-VII study[J].J Clin Oncol,2012,30(15):1755-1762.
[11]Ye LC,Liu TS,Ren L,et al.Randomized Controlled Trial of Cetuximab plus Chemotherapy for patients With KRAS Wild-Type Unresectable Colorectal Liver-Limited Metastases[J].J Clin Oncol,2013,31(16):1931-1938.
[12]徐晓辉,马锐,李琳琳,等.西妥昔单抗联合FOLFOX4方案治疗转移性结直肠癌临床观察[J].肿瘤研究与临床,2009 (21)10:695-696.
[13]Tol J,Koopman M,Cats A,et al.Chemotherapy,Bevacizumab,and Cetuximab in Metastatic Colorectal Cancer[J].NEW ENGLAND JOURNAL OF MEDICINE,2009,360(6):563-572.
[14]Vale CL,Tierney JF,Fisher D,et al.Does anti-EGFR therapy improve outcome in advanced colorectal cancer? A systematic review and meta-analysis[J].CANCER TREATMENT REVIEWS,2012,38(6):618-625.
[15]Zhou SW,Huang YY,Wei Y,et al.No survival benefit from adding cetuximab or panitumumab to oxaliplatin-based chemotherapy in the first-line treatment of metastatic colorectal cancer in KRAS wild type patients: a meta-analysis[J].pLoS One,2012,7(11):e50925.
[16]Kopetz S,Lesslie D p,Dallas N A,et al.Synergistic activity of the SRC family kinase inhibitor dasatinib and oxaliplatin in colon carcinoma cells is mediated by oxidative stress[J].Cancer Res,2009,69(9):3842-3849.
[17]Lu Y,Li X,Liang K,et al.Epidermal growth factor receptor (EGFR)ubiquitination as a mechanism of acquired resistance escaping treatment by the anti-EGFR monoclonal antibody cetuximab[J].Cancer Res,2007,67(17):8240-8247.
[18]Ekblad L,Johnsson A.Cetuximab sensitivity associated with oxaliplatin resistance in colorectal cancer[J].Anticancer Res,2012,32(3):783-786.
[19]Kohne CH,Cunningham D,Di Costanzo F,et al.Clinical determinants of survival in patients with 5-fluorouracil-based treatment for metastatic colorectal cancer: results of a multivariate analysis of 3825 patients[J].Ann Oncol,2002,13(2):308-317.
[20]Khambata-Ford S,Garrett CR,Meropol NJ,et al.Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab[J].J Clin Oncol,2007,25(22):3230-3237.
[21]Yoshida M,Shimura T,Sato M,et al.A novel predictive strategy by immunohistochemical analysis of four EGFR ligands in metastatic colorectal cancer treated with anti-EGFR antibodies[J].J Cancer Res Clin Oncol,2013,139(3):367-378.
[22]Hecht JR,Mitchell E,Chidiac T,et al.A randomized phase IIIB trial of chemotherapy,bevacizumab,and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer[J].J Clin Oncol,2009,27(5):672-680.

