冠心病患者外周血树突状细胞前体的数量变化及意义
黎音亮 张峰 孙爱军 葛均波
(复旦大学附属中山医院心内科,上海 200032)
冠状动脉粥样硬化是一种脂质相关的慢性炎性免疫疾病。树突状细胞(dendritic cells,DCs)广泛分布于人体器官,是目前已知功能最强大的专职抗原提呈细胞,对炎性免疫举足轻重。根据表型及功能不同,外周血DCs前体可分为两种亚型:促使Th1免疫应答的髓系DCs(myeloid DCs,mDCs)和促使Th2免疫应答的淋巴系DCs(plasmacytoid DCs,pDCs)。无论在动脉粥样硬化早期病变还是晚期的复合斑块中,DCs的聚集都明显增强,而其在正常血管组织中却分布很少[1]。有研究[2]表明,冠心病患者血液循环中DCs的绝对数量高于健康对照组,其中mDCs的绝对数量、百分比及 mDC/pDC比值均高于对照组,但不同亚型冠心病的DCs表达水平、功能和作用目前仍未阐明。
本研究参考了2012年美国不稳定心绞痛/非ST段抬高心肌梗死管理指南和2013年稳定性冠心病新定义。这些指南与定义将冠心病患者分为不同组[稳定型冠心病(stable coronary artery disease,SCAD)、不稳定型心绞痛(unstable angina,UA)、非ST段抬高型心肌梗死(non-ST-elevation myocardial infarction,NSTEMI)、ST段抬高型心肌梗死(ST-elevation myocardial infarction,STEMI)]。
1 资料与方法
1.1 入选与分组 选取我院心内科2008年1月—2008年3月住院疑似冠心病患者81例,入院后行冠脉造影。以冠状动脉直径狭窄≥50%为有意义。按冠脉造影结果分组:(1)阴性组(N组):冠脉狭窄<50%;(2)稳定型冠心病组(SCAD组):冠脉造影证实至少1支或以上冠脉狭窄,胸痛1个月以上,发作诱因、疼痛强度、疼痛时间、发作次数、硝酸甘油服用量和起效时间稳定不变者;(3)不稳定型心绞痛组(UA组):冠脉造影证实至少1支或以上冠脉狭窄,1个月内心绞痛,或在相对稳定的劳力相关心绞痛基础上出现的逐渐增强、诱发阈值降低的心绞痛,或在休息时发作的心绞痛。肌钙蛋白和血清心肌酶阴性;(4)非ST段抬高型心肌梗死组(NSTEMI组):冠脉造影证实至少1支或以上冠脉狭窄,临床症状与UA组相似,但心肌钙蛋白T(cTnT)或血清肌酸激酶同工酶MB(CK-MB)阳性,且心电图不出现典型ST段抬高改变;(5)ST段抬高型心肌梗死组(STEMI组):冠脉造影证实至少1支或以上冠脉狭窄,cTnT、血清心肌酶CK-MB阳性,心电图出现典型ST段抬高改变。
1.2 细胞计数及结果判定 所有入选者在入院后24 h内抽取静脉血3 mL,NSTEMI和STEMI患者于入院7 d后再次采血。应用全自动生化分析仪检测白细胞数、淋巴细胞含量、TC、TG、LDL-C、HDL-C等。采用流式细胞四色分析法检测DCs及其亚型的比例并计算每毫升绝对数。
所有对象采血2 h内进行全血样本荧光抗体染色,实验管由PE标志的CD1c 抗体定义mDC1s,FITC 标志的CD303抗体定义pDCs,APC 标志的CD141抗体定义mDC2s,PE-Cy5标志的CD14和CD19抗体定义单核细胞和B细胞;对照管加入鼠同型对照单克隆抗体。加入红细胞裂解液,离心后加入固定液和终止死细胞标志物,24 h内用FACS流式细胞仪检测。采用CELLQuest软件分析结果,圈定外周血pDCs、mDC1s和mDC2s。
2 结 果
2.1 一般资料比较 研究入选情况:N组18例、SCAD组17例、UA组15例、NSTEMI组15例、STEMI组16例。5组对象的年龄、性别、危险因素(高血压、糖尿病、吸烟、高脂血症)差异均无统计学意义。
2.2 冠心病患者外周循环DCs前体及亚型表达水平的分析 5组外周循环DCs及亚型mDCs、mDC1s、mDC2s、pDCs占外周循环白细胞的比例和在每毫升外周血中的绝对数见表1,5组外周循环mDCs与pDCs比值见表1。
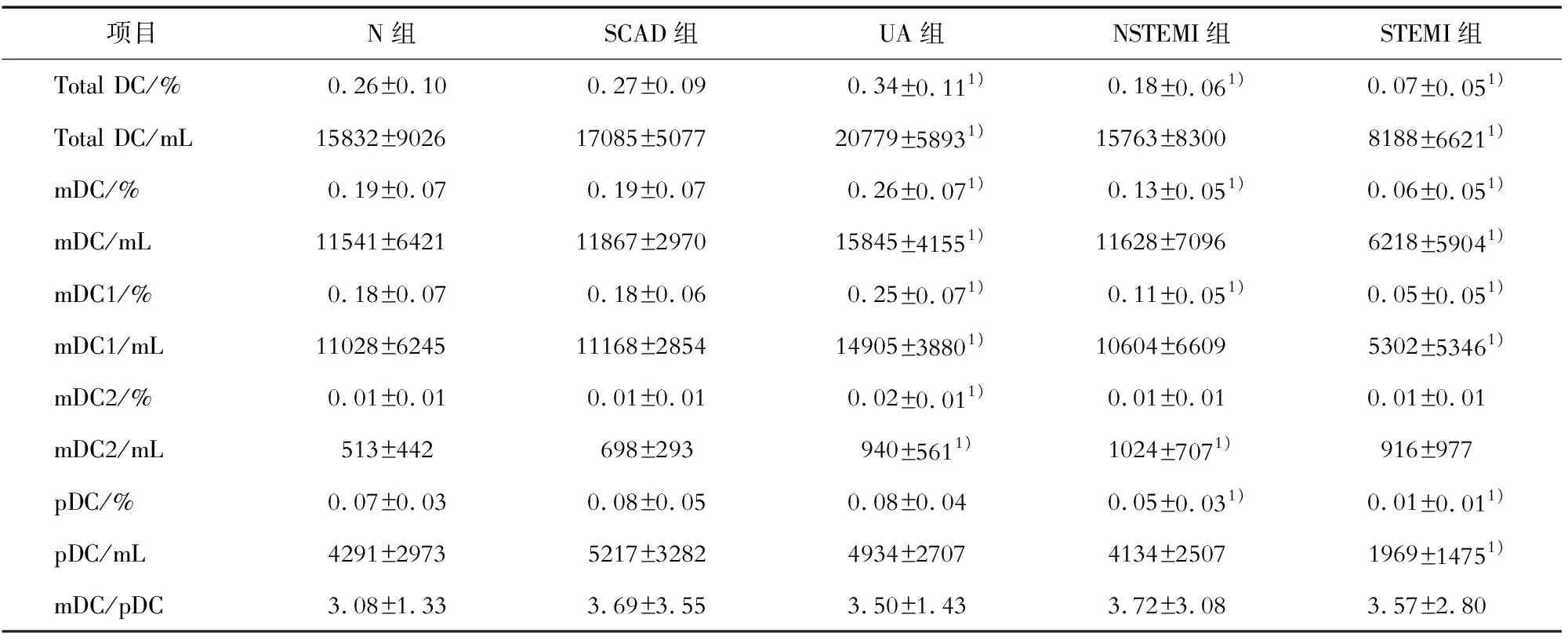
表1 各组外周血DCs及亚型的比例和绝对数
2.3 心肌梗死患者急性期外周循环DCs前体及亚型的变化 NSTEMI和STEMI患者为急性心肌梗死患者,入院1 d内和7 d后外周循环DCs及其亚型mDCs、mDC1s、mDC2s、pDCs占外周循环白细胞的比例和在每毫升外周血中的绝对数见表2。

表2 心肌梗死患者急性期外周血DCs及亚型比例和绝对数
3 讨 论
本研究将冠心病患者分为4个组,反映动脉粥样硬化斑块:从稳定-不稳定-破裂-血栓形成-血管完全闭塞的过程。以流式细胞仪四色分析法计数不同亚组冠心病患者外周循环DCs前体及亚型的比例及绝对数,探讨DCs在冠心病发展中的作用。
本研究发现,与N组相比,UA患者外周循环DCs明显增多,可能原因有:各种冠心病危险因素影响DCs的数量和功能;高血糖会显著增强DCs内活性氧的水平,促进DCs成熟,使DCs激活T淋巴细胞的能力明显增强[3];经烟碱处理的DCs促淋巴细胞增殖的作用加强,T淋巴细胞分泌细胞因子的能力提高而促进粒细胞和CD34+祖细胞从骨髓释放到血液,增加了mDCs的动员,导致DCs数量增加[4]。与N组比较,UA患者的危险因素和炎性免疫增强,DCs数量增多,从而使DCs刺激T细胞及产生细胞因子的能力增强。
本研究发现,与N组相比,UA患者外周循环mDCs和mDC1s明显增多,pDCs无变化。动脉粥样硬化早期即有活化T细胞浸润,以CD4+T细胞为主,Th1多于Th2。mDCs分泌大量的IL-12,促使发生Th1免疫应答,参与了斑块的不稳定过程[1]。本研究解释了冠心病中Th1和IL-12增多的可能原因,即mDCs可能参与Th1应答增强。
本研究还发现,急性心肌梗死患者入院时DCs及其亚型明显减少,7 d后外周循环DCs、mDCs、mDC1s、pDCs较入院时均明显升高,可能原因如下:在冠心病急性期,血液循环中的大量DCs迁移到粥样斑块中;DCs可能流入淋巴,进入区域淋巴结,进而激活T细胞;DCs亦有可能迁移到坏死心肌中,参与坏死心肌的炎性免疫,造成外周循环中DCs数量的下降[5]。
从SCAD到急性心肌梗死,动脉粥样硬化斑块经历了从稳定到破裂的过程,外周血DCs的比例和数量也经历了稳定-增多-骤然下降的过程,间接反映了DCs可能参与斑块的发生发展及破裂过程。今后应进一步观察大样本不同类型冠心病患者外周血DCs及其亚型的数量及比例,同时应从DCs的功能方面探索动脉粥样硬化的发病机制。
[1]Paulson KE,Zhu SN,Chen M,et al.Resident intimal dendritic cells accumulate lipid and contribute to the initiation of atherosclerosis [J].Circ Res,2010,106(2):383-390.
[2]Shi H,Ge J,Fang W,et al.Peripheral-blood dendritic cells in men with coronary heart disease [J].Am J Cardiol,2007,100(4):593-597.
[3]姚康,葛均波,孙爱军,等.高糖对人单核细胞源树突状细胞分化成熟和免疫功能的影响及其机制研究[J].中华心血管病杂志,2006,34 (1):60-64 .
[4]Aicher A,Heeschen C,Mohaupt M,et al.Nicotine strongly activates dendritic cell-mediated adaptive immunity: potential role for progression of atherosclerotic lesions[J].Circulation,2003,107(4):604-611.
[5]Kretzschmar D,Betge S,Windisch A,et al.Recruitment of circulating dendritic cell precursors into the infarcted myocar-dium and pro-inflammatory response in acute myocardial infarction[J].Clin Sci (Lond),2012,123(6):387-398.

