血管紧张素转化酶性质及胶原蛋白对其活性抑制效果的研究
李枭辰,刘 爽,邓小霞,王子华,孙晓悦,姜宏德,吴德峰,庞 海
(1.福建农林大学 动物科学学院,福建 福州 350002;2.吉林省金梓源生物科技有限公司,吉林 双辽136400;3.清华大学 医学院,北京 100084
血管紧张素转化酶性质及胶原蛋白对其活性抑制效果的研究
李枭辰1,2,刘 爽2,邓小霞2,王子华2,孙晓悦2,姜宏德1,2,吴德峰1*,庞 海3*
(1.福建农林大学 动物科学学院,福建 福州 350002;2.吉林省金梓源生物科技有限公司,吉林 双辽136400;3.清华大学 医学院,北京 100084
血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)与人和动物血压调节密切相关,为高血压疾病的药物靶标,筛选ACE抑制剂可为研制新型高血压疾病预防药物提供可靠的先导化合物。试验从猪肺中提取ACE,首先对其酶学性质进行了试验分析,继而考察了三个不同商品化的胶原蛋白肽对ACE抑制活性的影响。采用分光光度法,以马尿酰-组氨酸-亮氨酸(Hip-His-Leu,HHL)为底物测定血管紧张素转化酶的活力。结果表明:血管紧张素转化酶的最适pH为8.0;最适温度为40 ℃;350 mmol/L氯离子存在的情况下,能够明显提高ACE的活性;金属离子对酶活的影响表现出促进或抑制的作用。通过比较,在低温条件下提取的自制胶原蛋白肽的ACE抑制活性要高于另外两种商品化胶原蛋白肽产品。
血管紧张素转化酶;酶学性质;胶原蛋白;抑制活性
高血压作为一种慢性疾病,在我国乃至全球都威胁着人类的健康,并且每年其发病率都呈上升趋势[1]。据统计,在2012年我国高血压患病率约为24%[2]。作为经常性伴有危险因素的疾病,高血压也会导致身体出现各种相关疾病,并且它是导致心血管疾病的主要诱因之一,其危害性可见一斑[3]。与此同时,高血压对动物健康也存在着很大隐患,尤其是现代猫犬等宠物对人们的生活越来越重要,长期的养尊处优并且缺少运动,使得他们患有高血压等“富贵病”的几率大大上升。
血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)是一种哺乳动物组织中普遍存在的,含锌离子的膜结合外肽酶,催化血管紧张素I(Angitensin I,A I)形成具有强烈收缩血管功能的血管紧张素II(Angitensin II,A II),引起血压升高[4]。因而,ACE在血压的调节中发挥重要作用,与高血压的形成密切相关。因此,通过研究ACE的酶学性质,不仅对高血压的防治具有积极作用,并且对新型ACE抑制剂的研究和开发大有帮助。
由于化学合成的ACE抑制药具有引发咳嗽[5]、肾功能障碍[6]等不良反应。因此,安全且副作用低的天然ACE抑制剂日益受到人们的关注。时下热门的胶原蛋白,广泛地存在于动物的结缔组织中,是一种细胞外基质蛋白,对机体和脏器起着支持、保护等作用,也是修复各种损伤组织的重要物质[7]。作为天然保健品的胶原蛋白,经过研究证明具有抑制ACE活性作用[8-9]。因此,本试验选取三种不同产地的胶原蛋白,对其ACE抑制活性进行评价和比较,以期为发掘具有ACE抑制活性以及为治疗人和动物的高血压的胶原蛋白提供基本依据。
1 材料与方法
1.1 试验材料与试剂
新鲜猪肺由市场购得。HHL和马尿酸标准品 (Hippuric acid,HA)均购自Sigma公司,硫酸铵、盐酸、磷酸二氢钠、磷酸氢二钠、乙酸乙酯等试剂均为国产分析纯。自制胶原蛋白由吉林省金梓源生物技术有限公司生产,德国产胶原蛋白(AYMIN)和法国产胶原蛋白(FRANSAU)均购自市场。
1.2 试验方法
1.2.1 ACE的提取 根据参考文献[10-11]的做法:取200 g新鲜猪肺,用预冷的0.9%的生理盐水清洗,剪成小块,除去脂肪和大血管,加入600 mL的蒸馏水,断续匀浆10×20 s,加入15 mL的10%Triton X-100,慢速搅拌30 min,4层纱布过滤,滤液4 ℃离心(6000 g×20 min),取上清液,1.6~2.6 mol/L硫酸铵分级沉淀,收集沉淀,再用预冷的100 mmol/L的磷酸缓冲液(含0.3 mol/L NaCl,pH8.3)溶解。离心后取上清进行透析,再用100 KD分子量截留的超滤管,3 500 r/min离心浓缩,得ACE浓缩液。
1.2.2 HA标准曲线的制作 将HA标准样品用磷酸缓冲液溶解配成1 mg/mL的标准母液。然后将标准母液稀释成5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL、30 μg/mL、35 μg/mL系列浓度。经0.45 μM滤膜过滤后,在228 nm下分别测定吸光值。以HA浓度为横坐标,其吸光值为纵坐标,绘制标准曲线。
1.2.3 ACE活性的测定 ACE活力测定参考Cushman[12]的经典方法并稍作修改,即在37 ℃,pH8.3的条件下,ACE催化血管紧张素I的模拟物HHL产生HA。HA在波长228 nm处具有特殊吸收峰。根据HA标准曲线上相对应的值即可进行活性计算。
酶活性单位定义:1单位酶活定义在37 ℃,1min内催化HHL形成1 μmolHA的酶量。
1.2.4 ACE的酶学性质
1.2.4.1 最适反应pH 配制pH4.0~10.0的缓冲液,将1 μL酶液加入其中,在37 ℃下用标准方法测定酶活,以最大酶活为100%,分别计算各pH下的相对酶活。
1.2.4.2 最适反应温度 在反应体系中加入酶液(pH8.3),在不同温度下测定ACE的酶活。测定时间为10 min,以最大酶活为100%。分别计算各温度下的相对酶活。
1.2.4.3 氯离子对酶活的影响 在反应体系中加入不同浓度的氯离子,按标准方法测定酶活。以不加任何物质时的酶活为100%。计算在不同浓度氯离子存在情况下的相对酶活。
1.2.4.4 金属离子对酶活的影响 在反应体系中加入不同浓度的二价金属离子。二价金属离子包括:Mg2+、Fe2+、Co2+、Zn2+。以不加任何物质时的酶活为100%。计算在不同浓度金属离子存在情况下的相对酶活。
1.2.5 不同产地胶原蛋白对ACE抑制效果的比较 将三种不同产地的胶原蛋白用磷酸缓冲液溶解配制成1 mg/mL的标准母液。经过稀释之后配成0.01 mg/mL、0.05 mg/mL、0.1 mg/mL、0.5 mg/mL、1.0 mg/mL系列浓度后分别与先前提取的适量ACE混合,将混合物于37 ℃水浴锅中温浴10 min。
试验具体操作步骤根据参考文献[13]并稍作修改:反应的总体积为350 μL,其中含100mmol/L pH8.3磷酸缓冲液、0.3 mol/LNaCl、5 mmol/L HHL。在37 ℃恒温水浴3 min,然后加入温浴10 min后的混合物启动反应,恒温保持30 min后,加入250 μL 1 mol/L HCl中止反应。再加入1.5 mL乙酸乙酯,用力混合15 s,3 500 r/min离心15 min后取出1.0 mL酯层转入另一试管中,在120 ℃的烘箱经30 min蒸干,再将它重新溶于1.0 mL的磷酸缓冲液中,在228 nm处测定吸光值。
抑制率的计算方法根据参考文献[14]如下式计算:
Inhibition/%=(ODA-ODB)/(ODA-ODC)
式中:ODA为不存在抑制剂时的光密度;ODB为存在抑制剂与酶时的光密度;ODC为抑制剂与酶都不存在时的光密度。
对ACE抑制率达到50%时的抑制剂浓度即为半抑制浓度,记为IC50。IC50值越小,说明抑制剂活性越大。
2 结果与分析
2.1 标准曲线的绘制
绘制的HA标准曲线如图1所示,其回归方程为y=0.0298x+0.036,R2=0.9905,表明HA浓度在5 μg/mL~35 μg/mL的范围内,其浓度与吸光值线性关系良好。ACE的活力测定中HA含量的确定将根据此标准曲线计算。
2.2 ACE的最适pH
pH对ACE活力的影响见图2。从图2可以看出,ACE在pH8.0的情况下活性最高,相对酶活定为100%。在不同的pH下,ACE的活力有着比较大的变化。pH在7.0~9.0范围内时,ACE相对活性均在80%以上,酶活损失率低。 当ACE处于pH4.0时,ACE的相对酶活仅为3%,活性几乎被完全抑制。

图1 马尿酸标准曲线Fig.1 Standard curve of HA
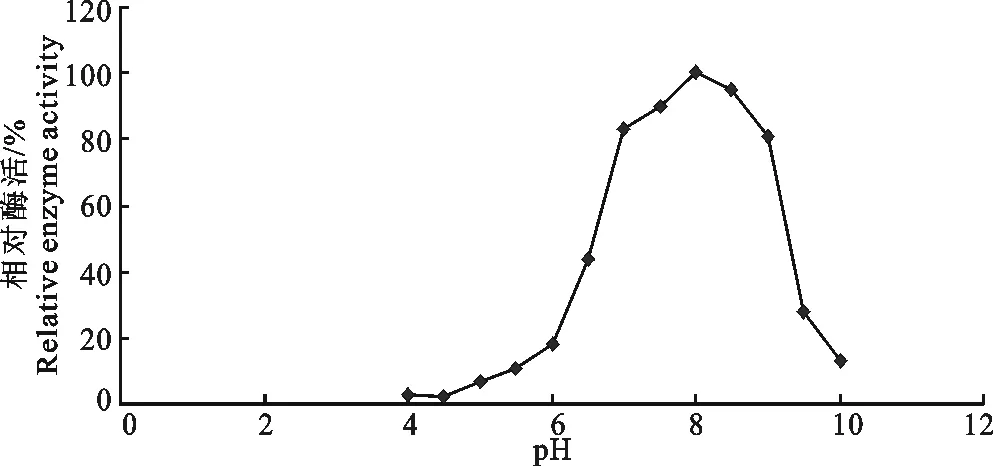
图2 pH对ACE活性的影响Fig.2 Effect of pH on activity of ACE
2.3 ACE的最适反应温度
从图3可知,在40 ℃下ACE活性最高,相对酶活定为100%。说明ACE反应的最适温度为40 ℃。在35~45 ℃范围内,ACE显示出比较高的活性,损失率均在20%以下,低于30℃以及高于50 ℃的条件下都会对ACE活性有比较大的影响,酶活损失率都在50%以上。
2.4 氯离子对ACE活性的影响
从图4可知,在加入Cl-后,与空白组相比,ACE的活性明显升高。尤其是当反应体系中的浓度仅达到50 mmol/L时,相对酶活即从100%上升至380%。而后继续升高浓度,酶活均有小幅提升,直至浓度达到350 mmol/L时,酶的活性最高,但此时随着浓度的升高,酶活性反而下降。
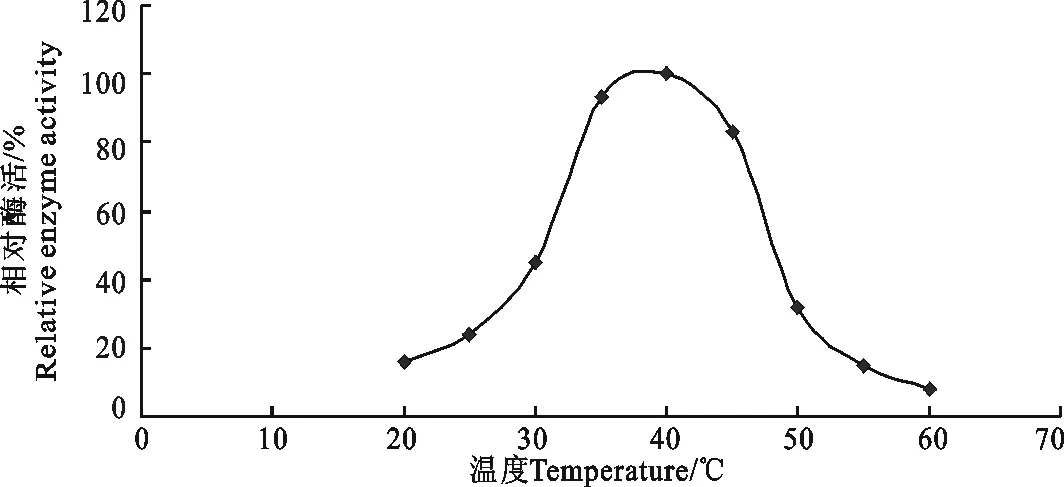
图3 温度对ACE活性的影响Fig.3 Effect of pH on activity of ACE

图4 氯离子对ACE活性的影响Fig.4 Effect of chloride ion on activity of ACE
2.5 金属离子对ACE活力的影响
从图5可知,在加入五种金属离子的反应体系之中,Co2+对于ACE活性的促进作用最强,当Co2+的浓度达到200 μmol/L时,ACE的相对酶活达到了235%,而后随着浓度的增加,虽然其促进作用有着一定程度的降低,但是ACE的相对活性一直保持在100%以上,也就是说相对空白对照组,Co2+对ACE活力有比较好的促进作用。而Zn2+加入反应体系后,浓度从100 μmol/L升至500 μmol/L,ACE的活力变化不大,说明Zn2+对ACE活力促进并没有太大作用,影响较小。Mg2+、Fe2+浓度在低浓度时,对ACE的活性影响较小,但随着浓度的逐渐加大,这两种金属离子显示出对ACE的一定的抑制作用。尤其是Fe2+,当加入反应体系中的浓度达到500 μmol/L时,ACE的相对活性仅为61%。而Mg2+的酶活也降到20%左右。
2.6 不同胶原蛋白的ACE抑制作用比较
从图6可知,当浓度在0.01 mg/mL~0.05 mg/mL时,三种不同的胶原蛋白均对ACE活性的抑制率较低,没有表现出明显的活性抑制作用。
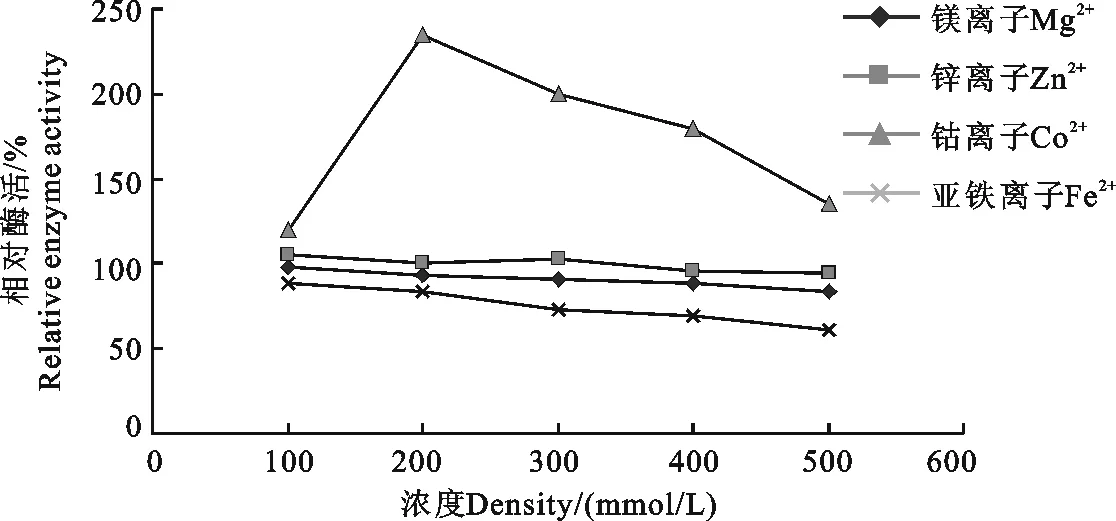
图5 金属离子对ACE活性的影响Fig.5 Effect of metal ion on activity of ACE

图6 不同胶原蛋白对ACE活性的影响Fig.6 Effect of different collagens on activity of ACE
当加入的浓度到达0.1 mg/mL时,自制胶原蛋白对ACE活性的抑制率就达到了27%,而另外两种商品化胶原蛋白的抑制率未超过20%。继续升高浓度,自制胶原蛋白依然在ACE活性抑制作用上表现出很好的效果,在加入浓度为0.5 mg/mL时,就已达48%的抑制率,在同样的浓度下,另外两种商品化胶原蛋白的ACE抑制率与其相比差距明显。而当浓度升至1 mg/mL时,这种差距进一步被拉大。
IC50是一种公认检验ACE抑制剂效果的指标,IC50的值越小说明抑制ACE作用的效果越好。本研究中,自制胶原蛋白、德国产胶原蛋白、法国产胶原蛋白的ACE活性抑制回归方程分别为:y=-29.702x2+88.499x+11.779,R2=0.9914、y=-34.766x2+85.556x+7.974,R2=0.9906以及y=-16.381x2+55.308x+11.774,R2=0.969。通过回归方程计算得出其IC50分别为0.5241 mg/mL、0.6780 mg/mL和0.9696 mg/mL。可见自制胶原蛋白对ACE的抑制效果要优于另外两种商品化的胶原蛋白,其抑制效果接近法国产胶原蛋白的2倍。
3 讨 论
本研究中,ACE反应的最适pH为8.0,pH上升或降低,ACE的活性都会受到一定程度的影响。当处于弱碱性环境中时,ACE表现出良好的活性,酶活变化不大。当处于强酸性或强碱性环境中时,对酶活产生明显的抑制作用,相对酶活均在50%以下。说明ACE是一种适合在弱碱性的环境中发挥作用的酶,这与体内环境相似。ACE反应的最适温度为40 ℃,温度的升高或降低,都会对ACE的活性有着一定的影响,说明ACE适合在比较温和的温度条件下发挥作用。
氯离子加入ACE反应体系中后,能够明显提高ACE的活性。在适当的浓度范围内,氯离子对ACE活性的促进作用不断增强。而随着浓度继续加大,对ACE活性的促进作用有小幅度的下降。说明在反应体系中加入适当浓度的氯离子,能够极大地促进ACE的反应效率。
通常情况下,以金属离子作为辅基的酶,金属离子对酶活非常重要,这种酶都具有特定的金属离子辅基,反应体系中的金属离子对酶活的影响与其浓度关系密切。本研究中,在低浓度下,Co2+对ACE活性有着明显的促进作用,当反应体系中Co2+浓度在300 mM时,ACE的活性最高,但随着浓度的继续升高(>400 mM),酶活略有下降,但总体都显示出其对ACE活性促进的作用。Zn2+对于ACE活性的作用不明显,随着浓度的升高,ACE活性并没有太大的变化,与空白组相比,酶活力变化很小。而Mg2+、Fe2+均有不同程度地对抑制ACE的活性,随着浓度的增大,抑制作用也越加明显。尤其是Fe2+,具有很强的ACE活性抑制效果。因此,添加适宜的金属离子,对于ACE活性具有有效的促进或抑制作用。
胶原蛋白,被广泛证明能够抑制ACE的活性。本研究中,自制的胶原蛋白肽对ACE抑制活性要高于国外进口胶原蛋白肽商品,并且通过与近年来发表的参考文献[15-16]中的IC50相比较,自制胶原蛋白肽显示出较好的ACE抑制活性,这与该胶原蛋白肽的生产工艺关系密切。市售商品化胶原蛋白肽多数为加入强酸、强碱或酶生产的胶原肽,其实质上已经使大部分胶原蛋白变性,破坏了胶原蛋白原有的三维结构,从而失去了原有生物活性。而本研究制备的胶原蛋白肽是在酸碱温和、低温(18 ℃)的条件下制备的产品,最大限度地保留了胶原蛋白原有的三维空间构象,使之表现出了较高的生物活性。总之,胶原蛋白肽可能对高血压病具有很好的降血压效果,这将对人和动物的高血压疾病治疗提供了新的途径。胶原蛋白肽的降血压作用的动物和人体试验,将会在后续试验中得到确切验证。
[1]王 文,张维忠,孙宁玲,等.中国血压测量指南[J].中华高血压杂志,2011,19(12):1 101-1 115.
[2]邹剑铭,李蕊均.高血压流行病学研究进展及危险因素分析[J].中国疗养医学,2013,22(9): 796-798.
[3]陈再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:251-264.
[4]林 琳,周存山,杨虎清,等.血管紧张素转化酶及其活性检测研究进展[J].食品工业科技,2009(12):417-491.
[5]王金玉.血管紧张素转换酶抑制剂不良反应及处理方法[J].临床医学,2012,32(7):102-103.
[6]郑 桢,邢爱华.血管紧张素转换酶抑制剂的临床不良反应[J].中外医学研究,2011,9(19): 138.
[7]白海英,柯蕾芬,朱文赫,等.胶原蛋白应用的研究进展[J].吉林医药学院报,2013,34(2):133- 135.
[8]蒋 哲,孟凡国,陈琼华,等.鲨鱼皮胶原蛋白肽的成分分析及对血管紧张素转化酶活力的影响[J].厦门大学学报:自然科学版,2008,47(6):879-882.
[9]Saiga A,Iwai K,Hayakawa T.Angiotensin I-converting enzyme inhibitory peptides obtained from chicken collagen hydrolysate[J].Journal of Agriculture and Food Chemistry,2008,56(20):9 586-9 591.
[10]刘 宏,陈兰英.血管紧张素转换酶纯化与性质研究[J].中国生物化学与分子生物学报,2000,16(6):788-792.
[11]刘淑集,王 茵,苏永昌,等.血管紧张素转换酶(ACE)的提取与活性验证[J].福建水产,2009(2):1-5.
[12]Cushman D W,Cheung H.Spectrophotometric assay and properties of the angiotensinconverting enzyme of rabbit lung[J].Biochemical Pharmacology,1971,20(7):1 637-1 648.
[13]Wang J P,Hu J N,Cui J Z,et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry,2008,111(2):302-308.
[14]Tsai J S,Chen J L,Bonnie S P.ACE-inhibitory peptides identified from the muscle protein hydrolysate of hard clam (Meretrix lusoria)[J].Process Biochemistry,2008,43(7):743-747.
[15]Pradipta B C,Shanthi.Isolation of novel bioactive regions from bovine Achilles tendon collagen having angiotensin I-converting enzyme-inhibitory properties[J].Process Biochemistry,2012,47(12):2 335-2 346.
[16]Lin L,Li S,Li B.Angiotensin I-converting enzyme(ACE)-inhibitory and antihypertensive properties of squid skin gelatin hydrolysates[J].Food Chemisty,2012,131(1):225-230.
[17]Zhuang Y L,Sun L P,Li B F.Production of the angiotensin-I-Converting enzyme (ACE) -inhibitory peptide from hydrolysates of Jellyfish ( Rhopilema esculentum ) Collagen[J].Food and Bioprocess Technology,2012,5(5):1 622.
StudyonPropertiesofAngiotensinConvertingEnzymeandEffectofItsActivityInhibitedbyCollagenPeptides
LI Xiao-chen1,2,LIU Shuang2,DENG Xiao-xia2,WANG Zi-hua2,SUN Xiao-yue2,JIANG Hong-de1,2,WU De-feng1*,PANG Hai3*
(1.CollegeofAnimalScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China;2.JinziyuanBiotechCo.LTD.,Shuangliao,Jilin136400,China;3.SchoolofMedicine,TsinghuaUniversity,Beijing100084,China)
Angiotensin Converting Enzyme (ACE),associated with human and animal blood pressure,is a drug target for treatment of hypertension disease.Screening of ACE inhibitors is important to the discovery of drug compounds which will help develop a new drug in preventing hypertension.In the study,ACE from pig lung tissues was purified.First,the ACE properties were investigated,and three different collagen peptides to inhibit the ACE activity were experimentally compared.Using spectrophotometry and ACE reaction substrate HHL (Hip-His-Leu),activity of the ACE was examined.The results showed that optimal pH of the ACE is 8.0 and its optimal temperature is 40 ℃.The ACE activity was significantly enhanced in 350 mmol/L Cl- solution.But,some metal ions showed inhibit or enhance the activity of ACE.In comparison,the collagen peptide in the experiment showed higher inhibitory activity to the ACE than other two commercial collagen peptides.
agiotensin converting enzyme; enzymatic properties; collagen peptides; inhibitory activity
2014-03-26,
2014-04-18
李枭辰(1988-),男,福建南平人,硕士研究生,主要从事中西兽药药理学及新制剂研究。E-mail: 742936379@qq.com
*[通讯作者]吴德峰(1951-),男,浙江金华人,教授,博士生导师,主要从事中兽医学、药理学及生态学等领域研究。 E-mail: zj99289@yeah.net 庞 海(1961-),男,吉林通化人,副教授,博士生导师,主要从事蛋白质结构生物学研究。 E-mail: panghai@mail.tsinghua.edu.cn
S811.6
A
1005-5228(2014)07-0049-05

