威宁黄牛CIS基因启动子区SNP及其与生长性状相关研究
蒋会梅,张义玲,张贵祥,袁 军,杨永强,刘若余*
(1.贵州毕节地区畜牧技术推广站,贵州 毕节 551700;2.贵州大学 动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025)
科学研究
威宁黄牛CIS基因启动子区SNP及其与生长性状相关研究
蒋会梅1,张义玲1,张贵祥1,袁 军1,杨永强2,刘若余2*
(1.贵州毕节地区畜牧技术推广站,贵州 毕节 551700;2.贵州大学 动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025)
为研究CIS基因启动子区SNP与黄牛生长相关性状关联性,选择106头威宁黄牛作为研究对象,利用PCR-SSCP分析CIS基因启动子区SNP与不同个体生长相关性状的相关性。结果表明:A-726G位点在威宁黄牛中有不同分型,母畜群体中,该SNP位点与体直长、胸围、胸宽、腰高、坐骨端宽有显著关联(P<0.05),其中对胸宽的影响达到极显著水平(P<0.01),AA型个体多项性状均值均最高;在公畜群体中,A-726G位点与胸宽有显著关联,A-726G可能作为影响黄牛生长性状的重要功能性SNP,研究结果为进一步阐明CIS基因功能奠定试验基础。
CIS;SNP;启动子;威宁黄牛
细胞因子信号传导抑制子(SOCS)家族对生长激素(GH)在内的细胞因子或生长因子信号通路起负调控作用[1-3]。包括CIS和SOCS1-7共8个成员,CIS蛋白包含C端的SH2结构域、SOCS box和N端结构域。CIS蛋白可抑制GH诱导的JAK2、GHR、STAT5a和STAT5b磷酸化作用而减弱GH信号级联反应[4],但首先需要引起GHR胞质内在化(internalization)[5],而高浓度GH导致CIS基因表达水平瞬时上升[6]。CIS蛋白还可通过直接与GHR酪氨酸磷酸化残基结合抑制GH信号途径[7]。基因启动子变异影响基因表达水平。目前对于牛CIS基因启动子多态性研究极少,杨永强等[8]在贵州务川黑牛、贵州荷斯坦奶牛CIS基因启动子区筛查到3个SNP位点。贵州地方黄牛品种存在生长速度慢,体型较小等问题,提高贵州黄牛生长性能是今后贵州黄牛品种选育的主要任务。本试验为进一步研究CIS基因启动子区SNP功能,选择贵州地方优良黄牛品种威宁黄牛为研究对象,针对上述3个SNP位点研究其与威宁黄牛生长相关性状间关联性,为筛选影响黄牛生产性能的分子标记奠定基础。
1 材料与方法
1.1 试验材料
106头威宁黄牛血样采自贵州省威宁县,均为成年牛,其中公畜51只,母畜55只,按相应标准测定个体体高、体斜长、体直长、胸围、管围、胸深、胸宽、腰高和坐骨端宽共9个生长相关性状指标。利用生工生物公司的血液基因组提取试剂盒提取牛DNA,1%琼脂糖凝胶电泳检测DNA提取效果,每个DNA样品浓度使用紫外分光光度计测量3次,取平均值。
1.2 引物设计和DNA扩增
根据牛CIS基因(GenBank登录号:AC_000179.1)DNA序列,利用Primer-BLAST软件设计2对特异性引物,引物信息见表1。PCR反应体系为15 μL:上、下游引物(浓度为10 pmol/μL)各0.75 μL,2×Taq PCR Master Mix试剂7.5 μL,模板DNA 1 μL,三蒸水5 μL。采用Bio-Rad公司PCR扩增仪进行DNA扩增,PCR扩增条件:94 ℃预变性4 min;94 ℃变性30 s,最佳温度退火30 s,72 ℃延伸30 s,35个循环,72 ℃延伸10 min。1%琼脂糖凝胶电泳检测PCR产物,凝胶成像系统观察电泳结果。
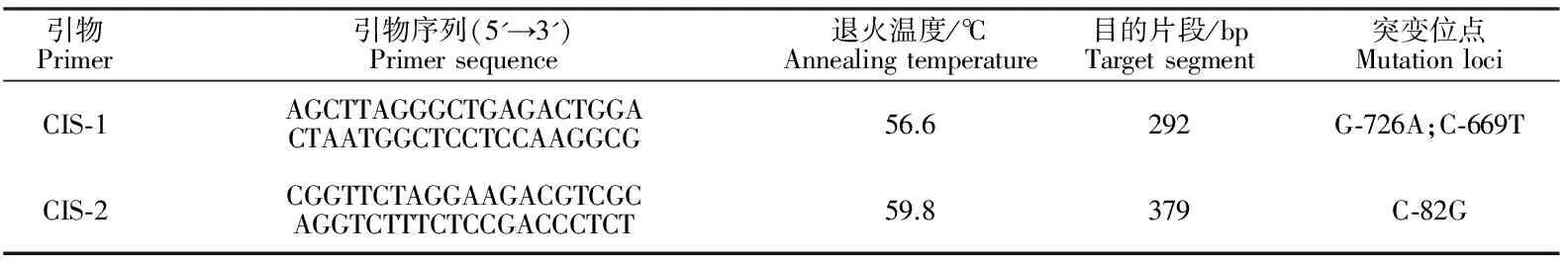
表1 引物序列、退火温度及目的片段长度Table 1 Sequences of primer,annealing temperature and predicted length of amplified DNA
1.3 基因分型和数据统计
扩增出特异性PCR产物后,利用PCR-SSCP方法对所有个体进行基因型检测,SSCP条件为:PCR产物与变性剂按1∶1比例混合,100 ℃水浴变性10 min,迅速放置于-20 ℃冰箱15 min,利用10%聚丙烯酰胺凝胶电泳在200V电压下运行8 h,银染法进行染色、显色。挑选不同基因型个体进行DNA测序确定不同基因型。EXCEL软件计算等位基因频率、基因型频率等,考虑性别因素,利用SPSS软件建立一般线性模型,进行SNP与生长性状间关联性分析。
2 结果与分析
2.1 PCR产物检测
针对3个SNP位点设计2对特异性引物进行PCR扩增,分别为292 bp和379 bp,从图1可看出,扩增条带单一、明亮,扩增产物为目标序列,说明引物特异性好,可用于后续SSCP分型研究。

图1 威宁黄牛CIS基因不同引物DNA扩增结果Fig.1 Results of DNA amplification of CIS in Weining Cattle
2.2 基因分型及测序验证
利用106个威宁黄牛个体进行PCR-SSCP研究,结果见图2。由图2知,CIS-1引物扩增产物具有三种基因型,分别命名为GG、GA、AA,而CIS-2引物扩增产物未发现不同基因型,可能威宁黄牛个体中-85 bp位点不具有多态性特征。挑选不同基因型个体进行DNA测序,利用DNAStar软件对测序结果进行分析,测序峰图见图3。

图2 CIS基因启动子区PCR扩增产物SSCP检测结果A.CIS-1引物SSCP检测;B.CIS-2引物SSCP检测Fig.2 SSCP results of PCR production in CIS promoter regionA.represented CIS-1;B.represented CIS-2
由表2可知,A-726G位点在公畜、母畜群体中G等位基因均为优势基因,频率分别为0.5295、0.6000,公畜中GG、AG基因型频率接近,AA基因型频率最低,而母畜中AA、AG基因型频率接近,AA基因型频率同样为最低,均符合Hardy-Weinberg平衡(P>0.05),表明威宁黄牛A-726G位点的基因型频率没有受到选择、突变或迁移等因素影响。随后建立一般线性模型进行SNP位点与9个体尺性状间关联性分析,结果见表3。在母畜中,A-726G位点对体直长、胸围、胸宽、腰高、坐骨端宽的影响达到显著水平(P<0.05),对胸宽达到极显著水平(P<0.01),AA型个体具有更出色的体直长、胸围、胸宽、腰高、坐骨端宽性状,而在公畜中,A-726G位点仅对胸宽的影响达到显著水平,AA型个体胸宽均值最高,而SNP对其他性状无显著性关联。结果表明A-726G对威宁黄牛体尺性状有重要影响。
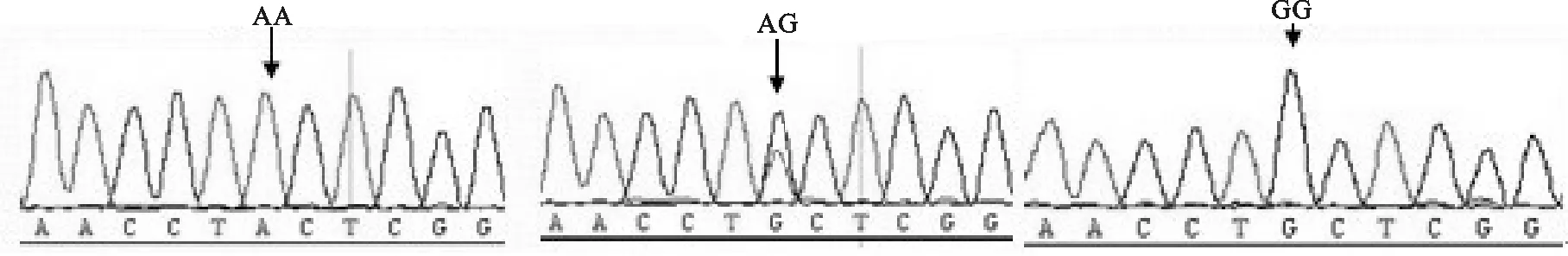
图3 CIS基因G-726A位点不同基因型个体测序结果Fig.3 Sequencing of various genotypes in G-726A of CIS gene
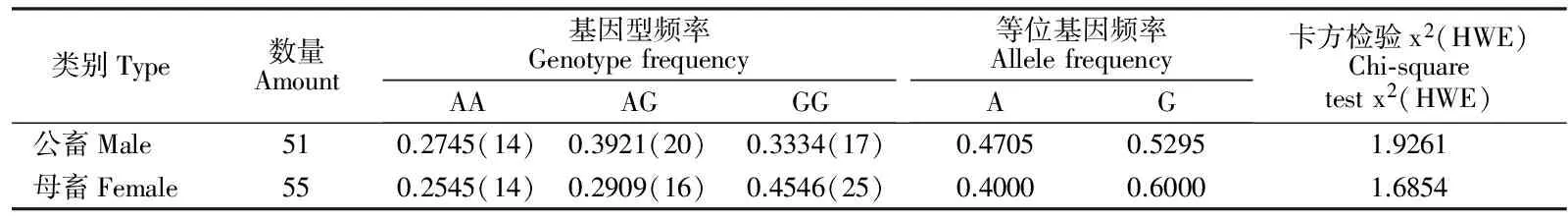
表2 A-726G在威宁黄牛群体中等位基因和基因型频率Table 2 Allele and genotype frequencies at A-726G locus in Weining Cattle
注:括号中数字为个体数。
Notes:data in brackets are individual numbers.

表3 CIS基因中A-726G与威宁黄牛体尺性状的关联性分析Table 3 Association analysis of A-726G SNP genotypes with body measurement traits at Weining Cattle CIS gene
注:同列数据肩标不同小写字母表示差异显著(P<0.01),肩标大写字母不同表示差异极显著(P<0.01)。
Notes:In the same wlumn,datm with different superscripts lowercase letters indicate significant difference(P<0.05),with different superseripts uppercase letters irdicate highly sighificant different(P<0.01).
3 讨 论
CIS基因能被GH等多种细胞因子或生长因子激活[9-10]。GH首先诱导细胞膜受体GHR二聚体化,进而激活STAT蛋白形成二聚体进入核内作为转录因子诱导下游基因表达[11],CIS蛋白通过抑制STAT蛋白与下游蛋白的结合而减弱GH信号通路。CIS蛋白一条途径通过与STAT5B竞争GHR酪氨酸磷酸化位点而部分抑制GH通路,另一条途径介导蛋白酶体降解进行时间依赖性抑制[12]。
CIS蛋白在GH信号通路中具有重要调控作用,其遗传变异可能影响哺乳动物GH功能发挥,牛CIS基因mRNA长度为1 952 bp,共有3个外显子,编码254个氨基酸,本试验首次研究CIS基因5'调控区SNP与黄牛生长性状间关联性。威宁黄牛主要分布于贵州西部高寒山区,属小型役肉兼用型品种,具有耐寒、耐粗饲、遗传性能稳定等优良特性[13]。威宁黄牛肉质鲜美,蛋白质含量高,脂肪含量适中,矿物质营养丰富[14],但其生长性能需要进一步改良提高。本研究发现在威宁黄牛母畜中,A-726G与体直长、胸围、胸宽、腰高、坐骨端宽有显著关联,AA型个体多项生长性能指标均最高,公畜群体中也与胸宽有显著关联,CIS基因是否与哺乳动物性腺激素分泌有关需深入探究。本研究首次证实了CIS基因多态性与贵州黄牛生长性状有关联,A-726G突变可能是重要的功能突变位点,这一结论对肉牛选种选育具有重要意义,对CIS基因SNP研究结果为进一步分析CIS启动子功能和阐明CIS蛋白对黄牛生长所起作用奠定基础。
[1]Tamiya T,Kashiwagi I,Takahashi R,et al.Suppressors of Cytokine Signaling (SOCS) Proteins and JAK/STAT Pathways[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2011,31(5):980-985.
[2]Yoshimura A,Yasukawa H.JAK's SOCS: A Mechanism of Inhibition[J].Immunity,2012,36(2):157-159.
[3]Kiu H,Nicholson S.Biology and significance of the JAK/STAT signalling pathways[J].Growth factors,2012,30(2):88-106.
[4]Gonzalez L,Miquet J,Sotelo A,et al.Cytokine-Inducible SH2 Protein Up-Regulation Is Associated with Desensitization of GH Signaling in GHRH-Transgenic Mice[J].Endocrinology,2002,143(2):386-394.
[5]Landsman T,Waxman D J.Role of the cytokine-induced SH2 domain-containing protein CIS in growth hormone receptor internalization[J].J Biol Chem,2005,280(45):37 471-37 480.
[6]Adams T E,Hansen J A,Starr R,et al.Growth hormone preferentially induces the rapid,transient expression of SOCS-3,a novel inhibitor of cytokine receptor signaling[J].Journal of Biological Chemistry,1998,273(3):1 285-1 287.
[7]Greenhalgh C J,Bertolino P,Asa S L,et al.Growth enhancement in suppressor of cytokine signaling 2 (SOCS-2)-deficient mice is dependent on signal transducer and activator of transcription 5b (STAT5b)[J].Molecular Endocrinology,2002,16(6):1 394-1 406.
[8]杨永强,龚 俞,焦仁刚,等.牛CIS基因启动子区SNP及生物信息学研究[J].中国畜牧杂志,2013,49(11):9-13.
[9]Yoshimura A,Ohkubo T,Kiguchi T,et al.A novel cytokine-inducible gene CIS encodes an SH2-containing protein that binds to tyrosine-phosphorylated interleukin 3 and erythropoietin receptors[J].EMBO J,1995,14(12):2 816-2 826.
[10]Tormo A J,Letellier M C,Sharma M,et al.IL-6 activates STAT5 in T cells[J].Cytokine,2012,60(2):575-582.
[11]Deng L,Jiang J,Frank S J.Growth Hormone-induced JAK2 Signaling and GH Receptor Down-regulation: Role of GH Receptor Intracellular Domain Tyrosine Residues[J].Endocrinology,2012,153(5):2 311-2 322.
[12]Ram P A,Waxman D J.Role of the cytokine-inducible SH2 protein CIS in desensitization of STAT5b signaling by continuous growth hormone[J].J Biol Chem,2000,275(50):39 487-39 496.
[13]刘若余,杨公社,夏先林,等.贵州威宁黄牛线粒体 DNA D-loop 区全序列分析[J].黑龙江畜牧兽医,2005(10):11-12.
[14]卢存仁,杨正德,戴 燚,等.威宁黄牛肉质营养特性研究[J].贵州农业科学,2009,37(12):139-141.
AssociationofPolymorphisminPromoterRegionofCISgenewithGrowthTraitsinWeiningCattle
JIANG Hui-mei1,ZHANG Yi-ling1,ZHANG Gui-xiang1,YUAN Jun1,YANG Yong-qiang2,LIU Ruo-yu2*
(1.BijieAnimalScienceandTechnologyExtensionStation,BijieGuizhou,551700;2.CollegeofAnimalSciences,GuizhouUniversity/KeyLaboratoryofAnimalGenetics,BreedingandReproductioninthePlateauMountainousRegion,MinistryofEducation,GuiyangGuizhou,550025,China;)
In order to study the correlation between the SNP in the promoter region of CIS gene and growth traits in cattle,a total of 106 Weining cattle were selected in this study.PCR-SSCP and DNA sequencing methods were used to analyse the association between SNP and specific growth traits.Results showed that various genotypes existed in different animals for the SNP of A-726G.For the female cattle populations,A-726G had significant effects on body length,heart girth,chest width,hip height and hucklebone width,with a highly significant effect on chest width,and the individuals with AA genotype had significantly higher mean value for those traits.Additionally,for the male cattle populations,A-726G had significant effect on chest width (P<0.05).It indicated that A-726G is an important functional SNP site that affect the cattle growth performance.This could lay an experimental foundation for the identification of function of CIS gene in cattle.
CIS; SNP; promoter; Weining cattle
2014-01-24,
2014-03-24
贵州省重大科技专项计划项目(黔科合重大专项字[2011]6009号)
蒋会梅(1963-),女,贵州人,高级畜牧师,本科,研究方向:动物遗传育种。E-mail:jhm9088@163.com
*[通讯作者]刘若余(1963-),男,湖南邵东人,教授,硕士研究生导师,博士,研究方向:分子遗传与动物育种。 E-mail:liury04@163.com
S811.6
A
1005-5228(2014)07-0013-04

