富血小板纤维蛋白对人牙周膜成纤维细胞迁移及成骨分化的影响
李 玮,李坤阳,范 云,余方方,陈 栋#
1)郑州人民医院颐和医院口腔科 郑州 450008 2)郑州市口腔医院牙周科 郑州 450000 3)郑州大学口腔医学院 郑州 450052
富血小板纤维蛋白对人牙周膜成纤维细胞迁移及成骨分化的影响
李 玮1),李坤阳2),范 云3),余方方3),陈 栋3)#
1)郑州人民医院颐和医院口腔科 郑州 450008 2)郑州市口腔医院牙周科 郑州 450000 3)郑州大学口腔医学院 郑州 450052
#通讯作者,男,1971年10月生,博士,副主任医师,研究方向:牙周病病因防治,E-mail:chendongfmmu@163.com
牙周膜成纤维细胞;富血小板纤维蛋白;迁移;成骨分化
目的:观察Choukroun’s富血小板纤维蛋白(PRF)对自体人牙周膜成纤维细胞(hPDLCs)迁移、成骨分化的影响,探讨PRF在牙周组织再生治疗中的潜能。方法原代培养hPDLCs;制备PRF,实验分为P1组(1片PRF浸出液)、P2组(2片PRF浸出液)和对照组,划痕实验观察记录各组第24、48、72 h细胞迁移的距离;Transwell制备迁移模型,按实验分组培养24 h后结晶紫染色观察;成骨矿化诱导液制备不同浓度的PRF浸出液(P1组、P2组),碱性磷酸酶(ALP)试剂盒检测3、5、7 d细胞破碎液中ALP活性;成骨矿化诱导液连续培养21 d,茜素红染色后测定矿化结节面积。结果划痕实验中P1组、P2组细胞迁移距离大于对照组(F=316.248、32.846和1 169.847,P均<0.001),P1组、P2组比较差异无统计学意义(P均>0.05)。Transwell 迁移实验中P1组、P2组与对照组比较,迁移细胞数增加(F=742.729,P<0.001),P1组、P2组比较差异无统计学意义(P>0.05)。ALP活性P1组、P2组与对照组比较差异均有统计学意义(F=474.202、1 383.521、2 317.965,P均<0.001),P1组、P2组比较差异无统计学意义(P均>0.05)。P1组、P2组与对照组矿化结节面积比较差异有统计学意义(F=332.280,P<0.001),P1组与P2组比较差异无统计学意义(P>0.05)。结论PRF对hPDLCs具有促进其迁移和成骨分化的作用,提示PRF在牙周组织再生工程中具有很大的临床应用潜能。
Choukroun’s富血小板纤维蛋白(platelet-rich fibrin,PRF)是通过自体外周血一次离心获取的富含白细胞和血小板的纤维蛋白凝胶。血小板在组织抗感染和愈合过程中起着重要的作用,其释放的各种生长因子可影响细胞的附着、增殖等一系列生物学行为,被用于各种组织修复的临床治疗[1]。许多研究[2]都是为了寻找更好的促进牙周组织再生的方法,包括生长因子的应用、EMD处理根面等,但这些治疗的临床效果尚不能完全确定,且增加了患者的经济负担,因此需要寻找一种经济有效的生物活性材料用于牙周组织再生治疗。目前少有PRF对牙周膜细胞迁移及成骨分化影响的实验研究,该实验将PRF浸出液与人牙周膜成纤维细胞(human periodontal ligament cells,hPDLCs)共培养,体外观察PRF对hPDLCs生物学行为的作用,为PRF应用于牙周组织再生工程提供理论依据。
1 材料与方法
1.1主要试剂胎牛血清(Gibco公司,美国),RPMI 1640培养基(Solarbio公司,北京),CCK-8(同仁公司,日本),Transwell 小室(Corning公司,美国),碱性磷酸酶检测试剂盒(建成公司,南京),成骨诱导分化培养液(赛业公司,广州)。
1.2hPDLCs原代培养及鉴定经郑州大学伦理委员会讨论批准,向每位被采集牙周膜组织的患者充分说明该实验的性质、目的、可能的收益和风险以及《赫尔辛基宣言》规定的原则和义务,在没有强迫、不正当压力和引诱的情况下,与每位受试患者签署《富血小板纤维蛋白研究知情同意书》。取材于河南省口腔医院收治的12~18岁因正畸拔除的牙周健康、无龋坏的新鲜前磨牙。酶消组织块法原代培养hPDLCs,免疫荧光法DAPI染色鉴定。
1.3PRF及其浸出液的制备采用Choukroun方法制备PRF[1],无菌采血管采取牙周膜组织来源同一患者肘静脉血,3 000 r/min离心10 min,静置10 min,剪去红细胞层,无菌纱布轻压10 s制成膜片。
取5 mL血液制备1片PRF膜片,将1片和2片PRF分别放入无菌EP管中,加入5 mL含体积分数2%或不含 FBS的RPMI 1640及成骨分化诱导培养液,CO2恒温培养箱孵育24 h。吸出浸出液于EP管中,4 ℃保存[3]。
1.4划痕实验观察PRF对hPDLCs迁移的影响6孔板背后划平均宽度的5条平行横线,调整细胞浓度为5×105mL-1后接种于6孔板。待细胞长满后,用10 μL的枪头划1条垂直于横线的划痕,划破单层细胞。分别加入1片PRF(P1组)、2片PRF(P2组)的浸出液,对照组加入不含PRF的RPMI 1640培养液。每组设3个复孔,培养24、48、72 h。40倍显微镜下拍照记录迁移距离。
1.5Transwell检测PRF对hPDLCs迁移的影响
取24孔板,按1.4分组分别加入600 μL培养液。将Transwell小室放入24孔板内,并加入1×105mL-1100 μL的无血清细胞悬液,孵育24 h。固定,结晶紫染色,棉签擦去小室内面未迁移的细胞。200倍显微镜下观察,每孔选取10个视野拍照,计数,计算平均值。
1.6PRF对hPDLCs碱性磷酸酶活性的影响采用成骨诱导培养液配制PRF浸出液,调整细胞浓度为2×104mL-1后接种于24孔板,按1.4分组加入培养液,收集3、5、7 d的细胞制备细胞破碎液。按照碱性磷酸酶检测试剂盒说明进行加样,测定吸光度值,即为碱性磷酸酶活性。实验重复10次。
1.7PRF诱导hPDLCs成骨分化的观察调整细胞浓度为2×104mL-1后接种于6孔板,细胞长至60%~70%时,按1.4分组换液,连续培养21 d。固定,茜素红染色,200倍显微镜下观察、拍照。从各组染色结果选取10个检测位点,采用Image Pro Plus 6.0对矿化结节面积进行测量,结果取平均值。
1.8统计学处理采用SPSS 17.0对数据进行分析。对照组、P1组和P2组细胞迁移距离、细胞迁移数、碱性磷酸酶活性、矿化结节面积的比较以及不同时间细胞迁移距离、碱性磷酸酶活性的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1hPDLCs的原代培养及鉴定所培养的hPDLCs呈典型的成纤维样细胞形态,抗波形丝蛋白免疫荧光染色呈阳性,抗角蛋白免疫荧光染色呈阴性,所培养hPDLCs为间充质来源(图1)。

图1 hPDLCs免疫荧光鉴定结果(DAPI,×200)
2.2PRF及其浸出液的制备离心后管内容物分为3层:淡黄色上清为贫血小板血浆(platelet-poorplasma,PPP),红色液体为红细胞,中间层浅黄色凝胶为PRF;剪去底部的红细胞层,无菌纱布压制形成白色膜片(图2)。

图2 PRF制备形成的3层结构
A:离心后的3层结构,即PPP、PRF、红细胞层;B:PRF凝胶;C:PRF膜片。
2.3划痕实验观察PRF对hPDLCs迁移的影响结果见图3、表1。P1组和P2组细胞迁移的距离随时间增加逐渐增加,且P1组和P2组细胞迁移的距离大于对照组,但P1组和P2组比较差异无统计学意义。

图3 划痕实验细胞迁移的情况(×40)
2.4Transwell检测PRF对hPDLCs迁移的影响
结果见表2和图4。P1组、P2组细胞迁移数大于对照组,P1组、P2组比较差异无统计学意义。
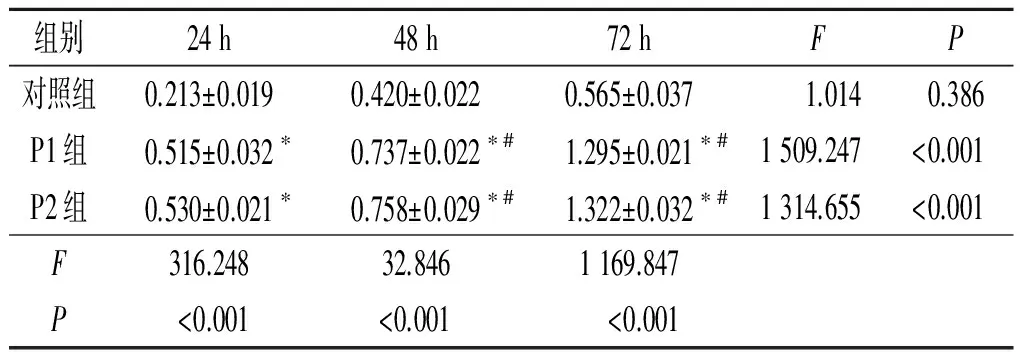
表1 各组细胞迁移距离比较(n=3) mm
*:与对照组比较,P<0.001; #:与24 h比较,P<0.001。

表2 各组细胞迁移数和矿化结节面积的比较(n=10)
*:与对照组比较,P<0.001。

图4 各组细胞迁移情况和矿化结节的形成(×200)
2.5PRF对hPDLCs碱性磷酸酶活性的影响结果见表3。各组碱性磷酸酶活性随时间的增加持续增加,且P1组、P2组活性均高于对照组,但P1组、P2组比较差异无统计学意义。

表3 各组hPDLCs碱性磷酸酶活性比较(n=10)
*:与对照组比较,P<0.001;#:与3 d比较,P<0.001。
2.6PRF诱导hPDLCs成骨分化的观察结果见图4、表2。hPDLCs经成骨诱导后表现成骨潜能,茜素红染色发现P1组、P2组矿化结节面积较对照组增加。
3 讨论
牙周基础治疗和非手术治疗主要是控制炎症,治疗后往往形成的是长结合上皮性愈合,牙周组织再生治疗则是使牙周炎造成的已破坏的牙周组织重建,恢复其结构和功能。其关键在于具有多向分化功能的牙周膜细胞在时间和空间上优先占领牙根面,形成新的牙骨质、胶原纤维和牙槽骨,获得真正的新附着[4]。
Choukroun’s PRF能够释放大量生长因子:转化生长因子-β、血小板源性生长因子、胰岛素样生长因子、血管内皮生长因子等,这些生长因子在PRF制备完成60 min内逐渐增加,在120~300 min内迅速释放[5],能够促进细胞增殖、分化、迁移,诱导基质矿化和骨基质蛋白的分泌,诱导新生血管的形成,为组织修复提供氧气及营养物质[1]。Tsai等[6]研究发现PRF可促进hPDLCs及成骨细胞增殖而抑制牙龈上皮细胞增殖,这种细胞选择性可以避免长结合上皮的形成。该研究结果显示2种浓度的PRF浸出液对自体hPDLCs的迁移具有明显的促进作用,2个实验组hPDLCs迁移的距离和数量均高于对照组,提示PRF能够促进hPDLCs迁移,有利于hPDLCs在牙周组织愈合过程中优先占领根面,形成新附着。
PDLCs成骨细胞表型可以在牙周组织修复中不断形成新的牙骨质及牙槽骨,对于牙周组织再生有着重要的作用[1]。碱性磷酸酶是参与骨组织形成、代谢和再生的重要调节物质,可反映细胞向成骨分化的趋势[7]。该实验结果表明PRF能够增加hPDLCs的碱性磷酸酶活性,提示PRF通过促进hPDLCs分泌与成骨相关的碱性磷酸酶、促进矿化结节的形成,来提高hPDLCs成骨分化和骨形成的能力。
hPDLCs优先占领根面、快速增殖、向成骨分化形成牙骨质和牙槽骨是新附着形成的关键,该实验结果提示PRF通过影响这一愈合过程达到促进牙周组织再生的治疗目的。PRF取自自体,不添加任何人工制剂,可以避免免疫排斥和交叉感染的发生,使用安全简便,能够作为一种天然的、经济有效的、促进组织修复的自体生物活性材料应用于牙周组织再生。以往研究[8-9]表明PRF对成骨细胞、骨髓间充质干细胞的增殖具有促进作用,并表现有剂量依赖性。该实验设有2种浓度的PRF浸出液,观察PRF对hPDLCs作用是否具有剂量依赖性。结果与以往研究结果有所差异,未表现出剂量依赖性,可能是PRF作用方式和PRF浸出液制备方法不同导致,需要进一步的实验来确定。
[1]Choukroun J, Diss A, Simonpieri A, et al. Platelet-rich fibrin(PRF): a second-generation platelet concentrate. Part Ⅳ: clinical effects on tissue healing[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006,101(3):e56
[2]Ramseier CA, Rasperini G, Batia S, et al. Advanced reconstructive technologies for periodontal tissue repair[J].Periodontol 2000, 2012,59(1):185
[3]李龙,赵建辉,刘斌,等. 富血小板纤维蛋白体外释放VEGF影响因素的探讨[J].中国美容医学,2012,21(3):427
[4]曹采方.临床牙周病学[M].北京: 北京大学医学出版社,2009.
[5]Su CY, Kuo YP, Tseng YH,et al. In vitro release of growth factors from platelet-rich fibrin (PRF): a proposal to optimize the clinical applications of PRF[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009,108(1):56
[6]Tsai CH, Shen SY,Zhao JH,et al. Platelet-rich fibrin modulates cell proliferation of human periodontally related cells in vitro[J].J Dent Sci,2009,4(3):130
[7]Pavlin D, Dove SB, Zadro R,et al. Mechanical loading stimulates differentiation of periodontal osteoblasts in a mouse osteoinduction model: effect on type Ⅰ collagen and alkaline phosphatase genes[J].Calcif Tissue Int,2000,67(2):163
[8]Dohan Ehrenfest DM, Doglioli P, de Peppo GM,et al. Choukroun’s platelet-rich fibrin (PRF) stimulates in vitro proliferation and differentiation of human oral bone mesenchymal stem cell in a dose-dependent way[J].Arch Oral Biol, 2010,55(3):185
[9]Dohan Ehrenfest DM, Diss A, Odin G, et al. In vitro effects of Choukroun’s PRF (platelet-rich fibrin) on human gingival fibroblasts, dermal prekeratinocytes, preadipocytes, and maxillofacial osteoblasts in primary cultures[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009,108(3):341
(2013-04-23 收稿 责任编辑 姜春霞)
Effects of platelet-rich fibrin on human periodontal ligament cells migration and osteogenetic differentiation
LIWei1),LIKunyang2),FANYun3),YUFangfang3),CHENDong3)
1)DepartmentofStomatology,YiheHospital,ZhengzhouPeople’sHospital,Zhengzhou450008 2)DepartmentofPeriodontology,StomatologicalHospitalofZhengzhouCity,Zhengzhou450000 3)SchoolofStomatology,ZhengzhouUniversity,Zhengzhou450052
periodontal ligament cell; platelet-rich fibrin; migration; osteogenetic differentiation
Aim: To investigate the effects of platelet-rich fibrin(PRF) on the migration and osteogenetic differentiation of human periodontal ligament cells(hPDLCs), and to evaluate the potential value of PRF used in periodontal tissue regeneration. Methods: The hPDLCs were primarily cultured and the PRF was prepared. There were three groups: 1 piece of PRF group (P1 group), 2 pieces of PRF group (P2 group), and control group. The cell migration distances at the 24th, 48th, 72th h were recorded under microscope in scratches experiment. Transwell was used to prepare migration model, and the results were observed by crystal violet staining after 24 h. Alkaline phosphatase(ALP) activity was detected by the kits of ALP at three time points. hPDLCs were induced differentiation by osteogenesis mineralization fluid and to observe mineralized nodules after being cultured for 21 days. Results: Scratch experimental results showed that the cell migration distances of the experimental groups were significantly greater than that of the control group (F=316.248,32.846, and 1 169.847,P<0.001), but there was no significant difference between two experimental groups (P>0.05). Transwell migrating experiment showed that compared with control group, the cells of the experimental groups migrating to the outside of the Transwell chambers were significantly more than that of control group (F=742.729,P<0.001), but there was no significant difference between the two experimental groups (P>0.05). The ALP activity of P1 group and P2 group were significantly more than that of control group (F=474.202,1 383.521,2 317.965,P<0.001), but there was no significant difference between P1 group and P2 group (P>0.05). There were significant differences in mineralized nodule area between experimental groups and control group (F=332.280,P<0.001), but there was no significant difference between P1 group and P2 group(P>0.05). Conclusion: PRF could promote hPDLCs migration and osteogenetic differentiation, and PRF may have great potential value in clinical application of periodontal tissue engineering.
R781.4
10.3969/j.issn.1671-6825.2014.01.031

