SYAP1真核表达载体的构建及蛋白表达定位*
郝慧鑫,菅辉玲,朱美意,黄 瑾,罗 星#
1)石河子大学医学院生物化学教研室 石河子 832000 2)石河子大学第一附属医院急诊外科 石河子 832000
SYAP1真核表达载体的构建及蛋白表达定位*
郝慧鑫1),菅辉玲1),朱美意2),黄 瑾1),罗 星1)#
1)石河子大学医学院生物化学教研室 石河子 832000 2)石河子大学第一附属医院急诊外科 石河子 832000
#通讯作者,男,1973年10月生,博士,副教授,研究方向:蛋白质的功能与疾病,E-mail:Luoxingxing@126.com
突触相关蛋白1;亚细胞定位;真核表达载体
目的:构建pcDNA3.1(-)-Myc-突触相关蛋白1(SYAP1)真核表达载体。方法合成SYAP1基因序列,加入Myc标签序列、EcoR Ⅰ和Hind Ⅲ酶切位点,并与线性化pcDNA3.1(-)连接,得重组质粒pcDNA3.1(-)-Myc-SYAP1。重组质粒经菌落PCR、酶切及测序鉴定正确后,脂质体转染HEK293细胞,采用Western blot和间接免疫荧光法检测转染细胞中SYAP1蛋白的表达及定位情况。结果Myc-SYAP1成功插入pcDNA3.1(-)载体,SYAP1蛋白成功表达且定位于胞浆。结论pcDNA3.1(-)-Myc-SYAP1载体构建成功。
各种神经损伤和神经系统退行性病变一直是困扰人类的一大类疾病,其预后主要取决于神经受损后的再生修复能力。在众多参与神经发育分化的蛋白质分子中,突触相关蛋白(synapse-associated protein,SYAP)能促进突起的生长,与神经系统可塑性密切相关[1]。SYAP1蛋白作为SYAP家族中的一员,对于提高受损神经的修复能力,改善神经损伤和神经系统疾病患者的生存质量,具有非常好的应用前景。研究[2]表明:除心脏、骨骼肌、脾脏和睾丸外,其他组织均能表达SYAP1,且SYAP1于脑组织中高表达,提示SYAP1在神经系统中发挥着重要作用。目前对SYAP1的研究大多集中在结构分析方面,鲜见有关其功能的报道。作者旨在构建SYAP1真核表达载体,为深入研究SYAP1蛋白在神经再生与神经系统可塑过程中的功能奠定实验基础。
1 材料与方法
1.1主要试剂和细胞限制性内切酶EcoR Ⅰ、Hind Ⅲ和T4 DNA连接酶(TaKaRa公司);PCR试剂盒、质粒提取试剂盒、Myc单克隆抗体和β-actin单克隆抗体(北京康为世纪生物科技有限公司);LipofectamineTM2000(Invitrogen公司);ECL化学发光试剂盒(Thermo公司);DMEM培养基和抗鼠荧光二抗(Sigma公司);PVDF膜(Whatman公司)。大肠杆菌DH5α、pcDNA3.1(-)空质粒由石河子大学医学院生物化学教研室保存;HEK293细胞购自上海中科院细胞研究所。
1.2目的基因的合成依据GenBank收录的人SYAP1基因序列(登录号:NM_032796.3),全基因合成SYAP1序列[3-6],并在5’端引入EcoR Ⅰ酶切位点,3’端引入Myc(5’-CAAAAACTCATCTCAGAAGAG GATCTGTGA-3’)标签序列和Hind Ⅲ酶切位点。
1.3PCR引物的设计与合成根据SYAP1基因序列在靠近5’端设计一对特异引物:上游5’-CCGCTCGAGACCTTAAGTCCGTCTTCACAC-3’,下游5’-ATTTGCGGCCGCTCAAGGCTCTTTTATGTC-3’,扩增片段大小为280 bp,由上海生工生物工程服务有限公司合成。
1.4重组质粒pcDNA3.1(-)-Myc-SYAP1的构建目的基因片段经EcoR Ⅰ、Hind Ⅲ双酶切、胶回收后,与双酶切的质粒pcDNA3.1(-)经T4 DNA连接酶于16 ℃连接过夜。将连接产物转化大肠杆菌DH5α,将PCR初步鉴定为阳性的菌落于含有100 mg/L氨苄青霉素的LB液体培养基中培养过夜,抽提质粒,用EcoR Ⅰ、Hind Ⅲ双酶切进行鉴定。PCR产物送北京六合华大基因科技有限公司测序。
1.5细胞内SYAP1蛋白表达的检测应用Western blot方法。采用含体积分数10% 胎牛血清的DMEM 培养基培养HEK293细胞,置体积分数5%CO2、37 ℃温箱中,待细胞融合度达到60%~70%时,采用脂质体LipofectamineTM2000转染重组质粒。48 h后收取总蛋白,经SDS-PAGE分析,电转移至PVDF膜。50 g/L脱脂奶粉常温封闭30 min,加入稀释1 000倍的Myc一抗,4 ℃孵育过夜。TBST洗膜4次,加入HRP标记的二抗(按150 000稀释),常温孵育30 min。TBST洗膜4次,ECL发光试剂盒显影。以目的蛋白和内参β-actin条带灰度值的比值作为目的蛋白的相对表达量。
1.6SYAP1蛋白的细胞定位应用间接免疫荧光分析方法。将HEK293细胞转染重组质粒,具体方案同1.5。转染24 h后制备爬片,24 h后取出爬片,PBS洗涤,40 g/L多聚甲醛溶液固定,室温静置20 min。牛血清白蛋白室温封闭30 min。用稀释200倍的Myc一抗孵育,4 ℃过夜,PBS洗涤;加二抗于37 ℃避光孵育2 h,PBS洗涤;滴加缓冲甘油,覆以盖玻片。荧光显微镜下观察。
2 结果
2.1pcDNA3.1(-)-Myc-SYAP1重组质粒的PCR鉴定阳性菌落经PCR鉴定,可见到280 bp大小的片段,与预期目的片段的大小相符(图1)。

图1 重组质粒的菌落PCR电泳图
2.2重组质粒pcDNA3.1(-)-Myc-SYAP1的酶切鉴定对pcDNA3.1(-)-Myc-SYAP1进行双酶切,得到5 600 bp的载体片段和1 101 bp的目的片段,与预期相符(图2)。测序结果证实插入正确。
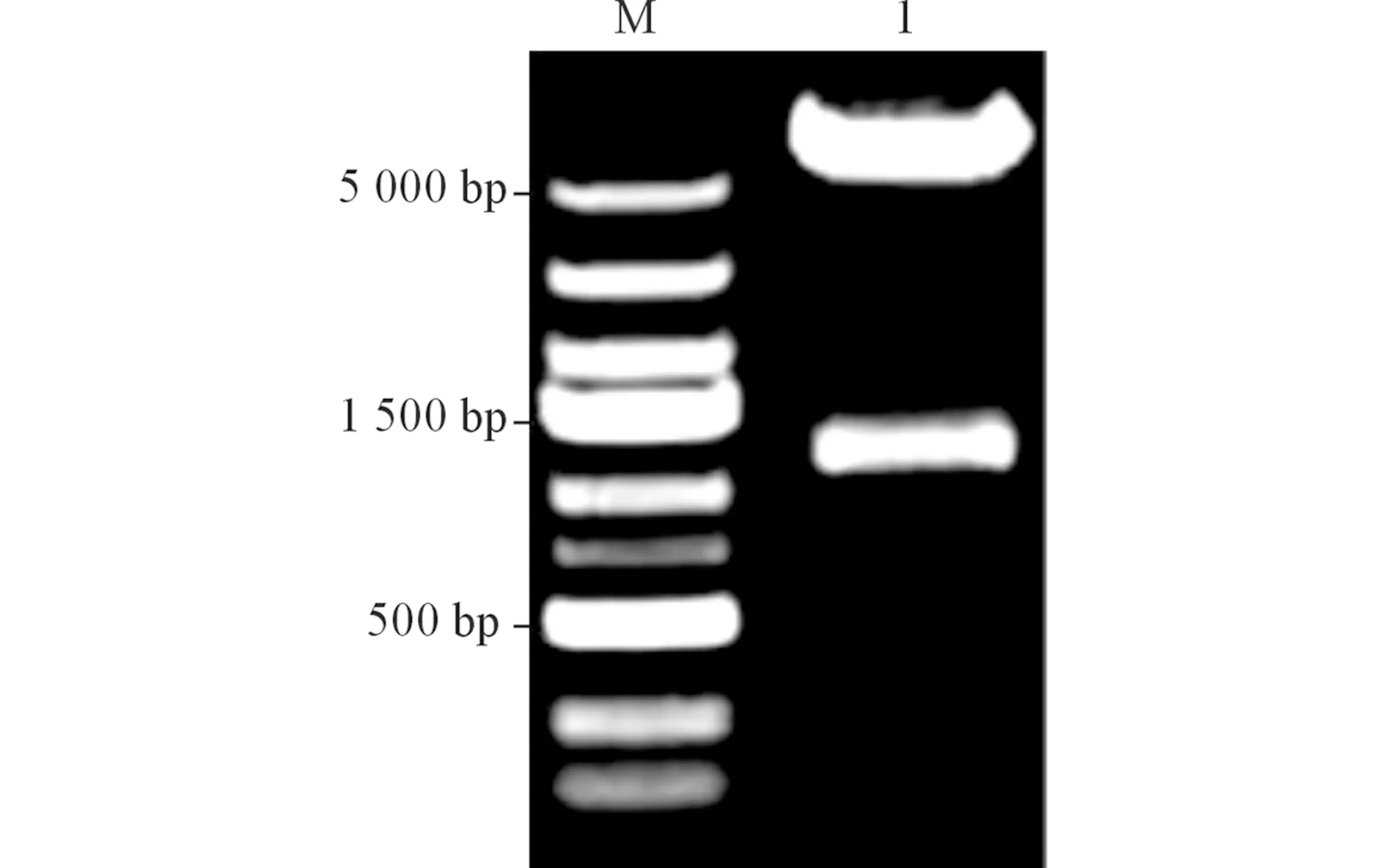
图2 重组质粒的双酶切电泳图
2.3重组质粒转染细胞SYAP1蛋白的表达转染pcDNA3.1(-)-Myc-SYAP1的HEK293细胞可见目的条带(图3)。

图3 SYAP1蛋白表达的Western blot检测结果
2.4SYAP1蛋白的细胞定位间接免疫荧光结果显示SYAP1蛋白表达于胞浆(图4)。

图4 SYAP1蛋白的亚细胞定位(×400)
3 讨论
突触是神经元之间传递电、化学物质的结构,其终末成分包含了完整的突触前末梢、突触后膜以及突触后致密物,集中了全部的突触相关蛋白,承担着储存、释放、再提取神经递质和维持突触可塑性的重要作用[7]。突触可塑性是学习记忆的生物学基础。研究[8]表明:突触结构和功能的改变在神经系统疾病发病机制中的作用越来越明显,尤其是在认知功能损害中的作用。SYAP1蛋白对于突触传递及其相关调节都极为重要,例如在Alzheimer病中突触结构、功能与神经元的功能、活性有关,且突触损伤的发生早于神经元死亡丢失[9-10]。为了进一步阐明神经系统疾病相关突触传递和突触可塑性的分子机制,SYAP1的研究正逐渐成为一个亮点。
课题组酵母双杂交[11]结果显示:SYAP1与神经营养因子Neuritin有相互作用,推测:Neuritin可能作为上游因子,通过与SYAP1相互作用,促进突触生长发育,维持神经系统可塑性;也可能是作为SYAP1的正向调节因子或修饰分子,通过与SYAP1的相互作用,促进突触相关蛋白向轴突终末转运,而产生相应的生物效应。SYAP1在大多数成人的组织中能够被检测到,并且在人肝癌组织中表达下调。国内未见针对SYAP1蛋白的更深入的相关功能和机制研究。SYAP1蛋白为一相对分子质量40 000的蛋白,为了取得满意的实验结果,作者在C端带了Myc标签序列,Myc蛋白的相对分子质量为1100。此举措将有助于将来的蛋白纯化,同时防止表达产物的降解。此次重组质粒pcDNA3.1(-)-Myc-SYAP1的成功构建为后续SYAP1蛋白的功能研究奠定了实验基础。
[1]Bai F,Witzmann F.Synapyosome proteomics[J].Subcell Biochem,2007,43:77
[2]Yc C,Yu YL,Wang N,et al.Coning and characterization of SYAP1,a down regulated gene in human hepatocellular carcinoma[J].Acta Biol Exp Sinica,2004,34(4):319
[3]Hoover DM,Lubkowski J.DNAWorks: an automated method for designing oligonucleotides for PCR-based gene synthesis[J].Nucleic Acids Res,2002,30(10):e43
[4]Rouillard JM,Lee W,Truan G,et al.Gene2Oligo: oligonucleotide design for in vitro gene synthesis[J].Nucleic Acids Res,2004,32(Web Server issue):W176
[5]Young L,Dong QH.Two-step total gene synthesis method[J].Nucleic Acids Res,2004,32(7):e59
[6]Kodumal SJ,Patel KG,Reid R,et al.Total synthesis of long DNA sequences: synthesis of a contiguous 32-kb polyketide synthase gene cluster[J].Proc Natl Acad Sci U S A,2004,101(44):15573
[7]Schrimpf SP,Meskenaite V,Brunner E,et al.Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry[J].Proteomics,2005,5(10):2531
[8]Huang KM,Geunes-Boyer S,Wu S,et al.Organization and annotation of the Xcat critical region: elimination of seven positional candidate genes[J].Genomics,2004,83(5):893
[9]Gasic GP,Nicotera P.To die or to sleep, perhaps to dream[J].Toxicol Lett,2003,139(2/3):221
[10]Deisseroth K,Mermelstein PG,Xia H,et al.Signaling from synapse to nucleus: the logic behind the mechanisms[J].Curr Opin Neurobiol,2003,13(3):354
[11]Putz U,Harwell C,Nedivi E.Soluble CPG15 expressed during early development rescues cortical progenitors from apoptosis[J].Nat Neurosci,2005,8(3):322
(2013-06-21 收稿 责任编辑 李沛寰)
Construction of eukaryotic expression vector of SYAP1 and intracellular location
HAOHuixin1),JIANHuiling1),ZHUMeiyi2),HUANGJin1),LUOXing1)
1)DepartmentofBiochemistry,MedicalSchool,ShiheziUniversity,Shihezi832000 2)DepartmentofEmergencySurgery,theFirstAffiliatedHospital,ShiheziUniversity,Shihezi832000
synapse-associated protein 1;subcellular location;eukaryotic expression vector
Aim: To construct eukaryotic expression vector pcDNA3.1(-)-Myc-SYAP1. Methods: SYAP1 sequence was synthesized, joined with Myc-tag sequence andEcoR Ⅰ,Hind Ⅲ restriction sites, and then connected with linearized pcDNA3.1(-). After the identification by the results of colony PCR, restriction analysis and sequencing,the plasmid was transfected into HEK293 cells by lipid transfection, Western blot and indirect immunofluorescence were applied to observe the expression level and position of SYAP1 protein in cells. Results: The results of colony PCR, sequencing and restriction enzyme digestion showed that the target nucleotide sequences were successfully inserted into the expected sites of the vector. Western blot showed that SYAP1 protein was successfully expressed in transfected HEK293 cells,and lind indirect immunofluorescence result showed that SYAP1 protein located in cytoplasm. Conclusion: Recombinant vector of pcDNA3.1(-)-Myc-SYAP1 has been successfully constructed.
*国家自然科学基金项目 31160182;兵团国际科技合作计划项目 2011BC009
R651.3
10.3969/j.issn.1671-6825.2014.01.006

