冻存对细胞因子诱导的杀伤细胞免疫表型及细胞内因子表达的影响*
王 菲,王丽萍, 张 震,岳冬丽2,,段秀芳2,,张 斌,张 毅
1)郑州大学生物工程系 郑州 450001 2)郑州大学第一附属医院生物治疗中心 郑州 450052 3)郑州大学第一附属医院肿瘤科 郑州 450052 4)美国西北大学医学院 芝加哥60611 5)河南省高等学校临床医学重点学科开放实验室 郑州 450052
冻存对细胞因子诱导的杀伤细胞免疫表型及细胞内因子表达的影响*
王 菲1,2),王丽萍3), 张 震1,2),岳冬丽2,3),段秀芳2,3),张 斌2,4),张 毅1,2,3,5)#
1)郑州大学生物工程系 郑州 450001 2)郑州大学第一附属医院生物治疗中心 郑州 450052 3)郑州大学第一附属医院肿瘤科 郑州 450052 4)美国西北大学医学院 芝加哥60611 5)河南省高等学校临床医学重点学科开放实验室 郑州 450052
#通讯作者,男,1964年4月生,博士,教授,研究方向:肿瘤免疫学、肿瘤干细胞和生物细胞治疗,E-mail:yizhang@zzu.edu.cn
细胞因子诱导的杀伤细胞;细胞内因子;冻存;免疫表型
目的:探讨冻存对外周血来源的细胞因子诱导的杀伤细胞(CIK)免疫表型及细胞内因子表达的影响。方法采集10例癌症患者的外周血,采用Ficoll两步法分离外周血单个核细胞,用细胞因子诱导培养得CIK。收集冻存3个月后复苏4、24、72 h的CIK,采用流式细胞术及胞内染色法检测细胞穿孔素、颗粒酶B及干扰素-γ的表达水平,采用AnnexinV/PI双染法检测细胞活性。以未冻存的新鲜CIK作对照。结果冻存前及复苏4 h后CIK颗粒酶B及干扰素-γ表达水平差异无统计学意义(t=1.029、0.237,P>0.05)。冻存前及复苏4、24、72 h后CIK穿孔素表达水平分别为(35.97±7.12)%、(10.00±6.04)%、(17.60±3.92)%和(35.20±6.23)%,差异有统计学意义(F=47.480,P<0.001),冻存后CIK穿孔素表达水平显著降低,随着复苏时间的延长, 穿孔素表达水平逐渐恢复正常。复苏4、24、72 h后CIK活细胞比例逐渐增多(P<0.05),复苏72 h后活细胞比例接近100%,细胞活性恢复正常。结论冻存可能使CIK细胞亚型发生改变。
细胞因子诱导的杀伤细胞(cytokine-induced killer cell, CIK)是一群异质性免疫活性细胞,具有较强的抗肿瘤能力[1]。CIK既能通过释放大量的炎性分子,如白介素(interleukin,IL)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子(tumor necrosis factor,TNF)等细胞因子调节机体免疫系统,从而间接杀伤肿瘤,又能通过释放颗粒酶B(granzyme-B)、穿孔素(perforin)等毒性颗粒,直接导致肿瘤细胞裂解[2]。冻存是贮藏有活性的淋巴细胞并应用于后期实验的一种常用方法,有关冻存对细胞参数的影响已有过研究,包括细胞活力、细胞增殖、细胞表面标志物等[3-4],但有关冻存对CIK穿孔素、颗粒酶B、IFN-γ表达的影响报道甚少。作者收集了10例癌症患者的外周血,分离出单个核细胞并诱导为CIK,观察冻存前后CIK免疫表型、细胞活性,并用流式细胞术检测细胞内因子穿孔素、颗粒酶B及IFN-γ表达水平的变化,为CIK的应用提供实验依据。
1 材料与方法
1.1标本来源外周血标本来自郑州大学第一附属医院确诊为癌症的10例患者,标本采集均征得患者同意并签订知情同意书。
1.2试剂和仪器流式细胞仪FASCanto Ⅱ购自美国 BD公司,各种免疫荧光抗体购自美国BD Pharmingen 公司,抗CD3单克隆抗体购自以色列Prospec-tang公司,Hyclone RPMI 1640培养基购自赛默飞世尔生物化学制品有限公司,胎牛血清购自Gibco公司,重组人IL-2购自北京双鹭药业股份有限公司,重组人IFN-γ购自上海凯茂药业有限公司,Ficoll-Plaque淋巴细胞分离液购自上海华精生物高科技有限公司,AnnexinV/PI试剂盒购自北京碧云天公司,佛波酯(PMA)和离子霉素购自美国Sigma 公司。
1.3外周血CIK的获取无菌条件下采集外周血30~40 mL(肝素钠抗凝),加入Ficoll-Plaque淋巴细胞分离液并进行密度梯度离心(2 500 r/min,25 min),提取白膜层,PBS洗涤后重悬于RPMI 1640培养基中,调整细胞密度为2×106mL-1,加入IFN-γ(1 000 U/mL)置于37 ℃、体积分数5% CO2培养箱中培养,24 h后加入抗CD3单克隆抗体(100 mg/L)、IL-2(2 000 U/mL)继续培养,每隔3 d分瓶一次并补加完全培养液及IL-2,培养13 d后,CIK成熟。将CIK分为两部分,一部分直接用于指标测定,另一部分经冻存、复苏后再进行指标测定。
1.4CIK的冻存和复苏冻存:取诱导成熟的CIK,计数后1 500 r/min离心10 min,弃上清,加入冻存液[RPMI 1640小牛血清二甲基亚砜(体积比)=541],首先于4 ℃冰箱中放置1 h,然后-20 ℃冰箱中放置2 h,转至-80 ℃低温冰箱放置3个月。复苏:将冻存的CIK从-80 ℃低温冰箱中取出后放入37 ℃水浴锅内迅速融化,用完全培养基洗1遍,重悬于RPMI 1640培养基中,加入胎牛血清进行培养。
1.5CIK免疫表型和细胞内因子的检测取10例患者新鲜培养的外周血CIK(冻存前)或复苏4、24和72 h的CIK,重悬于RPMI 1640培养基中,加入PMA 50 μg/L和离子霉素750 μg/L,同时加入阻断剂布雷菲德菌素A(稀释1 000倍),置于37 ℃培养箱中孵育4~5 h。首先进行免疫表型检测,分别加入PE-CY7-CD3抗体、percp-CD8抗体、PE-CY7-CD4抗体200 μL避光15 min,多聚甲醛固定20 min。再用破膜剂破膜,将破膜后的CIK分别与PE-granzyme-B抗体、FITC-perforin抗体、APC-IFN-γ抗体共孵育30 min,上流式细胞仪检测。
1.6CIK活性的检测分别取5例患者复苏4、24和72 h的CIK,采用AnnexinV/PI双染试剂盒染色,然后上流式细胞仪检测细胞活性。
1.7统计学处理采用SPSS 16.0进行数据分析;冻存前及复苏后CIK免疫表型、IFN-γ和颗粒酶B表达水平的比较采用两独立样本t检验,穿孔素和细胞活性的比较采用单因素方差分析和LSD-t检验;检验水准α=0.05。
2 结果
2.1冻存前及复苏4h后CIK免疫表型和IFN-γ、颗粒酶B表达水平的比较冻存前及复苏4 h后, CD8+、CD4+T细胞比例及细胞内因子IFN-γ、颗粒酶-B的表达水平差异均无统计学意义,见表1。
2.2冻存前后CD8+T细胞穿孔素表达水平的变化冻存前及复苏4、24和72 h后,CD8+T细胞穿孔素表达水平分别为(35.97±7.12)%、(10.00±6.04)%、(17.60±3.92)%和(35.20±6.23)%,差异有统计学意义(F=47.480,P<0.001)。复苏72 h后细胞穿孔素表达水平恢复至冻存前水平。
2.3复苏后细胞活性的变化细胞活性检测结果见表2。复苏4 h后,死细胞比例较高;随着复苏时间的增加,活细胞比例逐渐增大,复苏72 h后活细胞比例接近100%,细胞活性恢复正常。
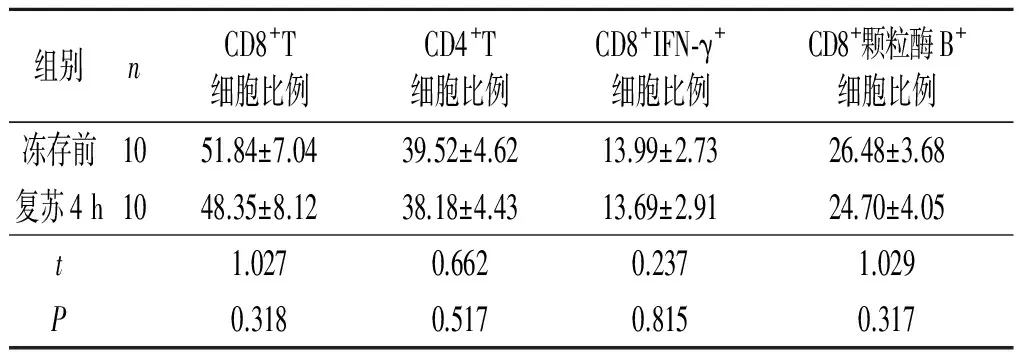
表1 冻存前及复苏4 h后CIK免疫表型和IFN-γ、颗粒酶B表达水平的比较 %

表2 复苏后CIK细胞活性检测结果 %
3 讨论
CIK细胞抗肿瘤机制主要通过释放细胞内因子激活机体免疫系统或直接裂解靶细胞实现。细胞的冻存与复苏是实验室处理细胞的常规方法,关于冻存对细胞功能的影响已有大量文献报道[5-6]。Francois等[7]将冻存的间充质干细胞(mesenchymal stem cell,MSC)与T细胞共孵育,检测T细胞的增殖能力,结果提示,冻存前MSC通过活化IDO(indoleamine2,3-dioxygenase)信号通路而抑制T细胞增殖,但是冻存后的MSC该抑制功能消失,他们推测主要原因为冻存使热激活蛋白活化进而下调IFN-γ对IDO的诱导表达;细胞复苏24 h后,MSC的功能恢复。Sallusto等[8]发现冻存过程中细胞发生内化作用,CD8+T细胞表面分子CD62L表达下调,因此初始性T细胞(CD45RA+CD62L+)和中心记忆性T细胞(CD45RO+CD62L+)减少,而效应性CD8+T细胞(CD45RA+CD62L-、CD45RO+CD62L-)增加。
采用流式细胞术检测细胞内因子[9]是通过体外多克隆激活剂(如PMA和离子霉素)或特定的抗原激活细胞,同时加入莫能霉素或布霉菲德菌素A阻断胞内高尔基体介导的蛋白质转运,抑制细胞因子释放到细胞外,使细胞因子在胞质内蓄积,经多聚甲醛固定和皂角苷破膜增加细胞膜的通透性后,加入相应抗体,用流式细胞仪检测不同抗体标记的细胞亚群。
该研究中作者观察了冻存前后CIK细胞内因子穿孔素、IFN-γ、颗粒酶B表达水平的变化。结果显示,冻存后CIK穿孔素表达水平显著降低,但随着复苏时间的延长,又逐渐恢复;而IFN-γ、颗粒酶B表达水平无明显变化。其他实验室已经研究过细胞毒杀伤性颗粒分泌细胞,包括CCR7+CD45RO+中心记忆性T细胞,CCR7-CD45RA-效应性T细胞,CCR7-CD45RA+效应性T细胞。上述细胞均能分泌IFN-γ,而穿孔素和颗粒酶主要由CCR7-CD45RA+效应性T细胞分泌[10-11]。不同亚型的T细胞可能对温度的敏感性不同,凋亡的可能性也不同。另外作者还发现在复苏一定时间后随着CIK活性的增加,穿孔素的表达水平也恢复,细胞可能由静息状态逐渐活化,细胞亚型也随着改变[12]。因此在下一步研究中作者将分析冻存对不同亚型细胞(CCR7/CD45RA/CD45RO)的影响,并探讨其分子机制。
[1]Wang Y,Bo J,Dai HR,et al.CIK cells from recurrent or refractory AML patients can be efficiently expanded in vitro and used for reduction of leukemic blasts in vivo[J].Exp Hematol,2013,41(3):241
[2]Krause DL,Wagner JK,Wildenauer A,et al.Intracellular monocytic cytokine levels in schizophrenia show an alteration of IL-6[J].Eur Arch Psychiatry Clin Neurosci,2012,262(5):393
[3]Radke L,López Hemmerling DA,Lubitz A,et al.Induced cytokine response of human PMBC-cultures: correlation of gene expression and secretion profiling and the effect of cryopreservation[J].Cell Immunol,2012,272(2):144
[4]Costantini A,Mancini S,Giuliodoro S,et al.Effects of cryopreservation on lymphocyte immunophenotype and function[J].J Immunol Methods,2003,278(1/2):145
[5]Hayden H,Friedl J,Dettke M,et al.Cryopreservation of monocytes is superior to cryopreservation of immature or semi-mature dendritic cells for dendritic cell-based immunotherapy[J].J Immunother,2009,32(6):638
[6]Kotsakis A,Harasymczuk M,Schilling B,et al.Myeloid-derived suppressor cell measurements in fresh and cryopreserved blood samples[J].J Immunol Methods,2012,381(1/2):14
[7]Francois M,Copland IB,Yuan S,et al.Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-γ licensing[J].Cytotherapy,2012,14(2):147
[8]Sallusto F,Lenig D,Förster R,et al.Two subsets of memory T lymphocytes with distinct homing potentials and effector functions[J].Nature,1999,401(6754):708
[9]Weren A,Bonnekoh B,Schraven B,et al.A novel flow cytometric assay focusing on perforin release mechanisms of cytotoxic T lymphocytes[J].J Immunol Methods,2004,289(1/2):17
[10]Sallusto F,Geginat J,Lanzavecchia A.Central memory and effector memory T cell subsets: function, generation, and maintenance[J].Annu Rev Immunol,2004,22:745
[11]Hamann D,Baars PA,Rep MH,et al.Phenotypic and functional separation of memory and effector human CD8+T cells[J].J Exp Med,1997,186(9):1407
[12]Rock MT,Yoder SM,Wright PF,et al.Differential regulation of granzyme and perforin in effector and memory T cells following smallpox immunization[J].J Immunol,2005,174(6):3757
(2013-05-22 收稿 责任编辑 王 曼)
Effects of cryopreservation on CIK immunophenotype and intracellular cytokine expression
WANGFei1,2),WANGLiping3),ZHANGZhen1,2),YUEDongli2,3),DUANXiufang2,3),ZHANGBin2,4),ZHANGYi1,2,3,5)
1)DepartmentofBioengineering,ZhengzhouUniversity,Zhengzhou450001 2)BiotherapyCenter,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 3)DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 4)MedicalSchool,NorthwesternUniversity,Chicago60611,USA5)InstituteofClinical-MedicineofHenanProvince,Zhengzhou450052
cytokine-induced killer cell;intracellular cytokine;cryopreservation; immunophenotype
Aim: To explore the effects of cryopreservation on cytokine-induced killer cell(CIK) immunophenotype and intracellular cytokine expression. Methods: Peripheral blood mononuclear cells from ten patients with cancer were isolated by Ficoll-Plaque density gradients and CIKs were obtained by incubating with appropriate cytokines. The secretion levels of perforin, granzyme-B and interferon-γ in CIK cryopreserved for 3 months and recovered for 4,24,and 72 h were detected by flow cytometry assay and intracellular staining, and cellular activity were detected by PI and AnnexinV staining. The fresh CIKs were the control. Results: There was no significant difference in the levels of granzyme-B or interferon-γ between fresh CIK and those recovered for 4 h(t=1.029,0.237,P>0.05). However, the level of perforin in fresh CIK, those recovered for 4,24,and 72 h cells were (35.97±7.12)%,(10.00±6.04)%,(17.60±3.92)% and (35.20±6.23)%, and there was significant difference(F=47.480,P<0.001);the expression level in perforin cryopreserved CIK decreased and gradually reached to the normal level with time.Cellular activity of CIK also recovered gradually(P<0.05).Conclusion: Cryopreservation might change the cell subtypes of CIK.
*国家自然科学基金资助项目 81171986,81271815;卫生部科研攻关基金项目 20110110001;河南省科技厅基础与前沿技术研究基金项目 112300410153,122300410155;河南省科技厅科技创新人才计划项目 124200510006;郑州大学第一附属医院院内创新团队基金项目
R392-33
10.3969/j.issn.1671-6825.2014.01.004

