肿瘤浸润淋巴细胞与结直肠癌预后的meta分析
梅祖兵 崔龙 李春波
目前,TNM分期是临床上制订结直肠癌治疗方案的主要依据,然而,此分期系统不能充分反映临床治疗和评估患者预后的情况。按照指南,TNM分期I期和低危II期患者术后无需接受辅助治疗就可以达到理论上的完全治愈,并长期存活(Benson et al,2013)。然而,约有10%的I期和20%的II期患者术后会发生复发转移。因此,临床上亟需其他预测预后的辅助指标来更精确分期,并为术后辅助治疗提供更多的依据。
肿瘤局部的免疫微环境在肿瘤的形成、生长、侵袭及转移过程中扮演着重要的角色。免疫细胞,特别是T淋巴细胞,在肿瘤微环境中起着调节作用[1-2]。1987年,Jass等[3]首次提出了免疫细胞的浸润是结直肠癌独立的预后因素,优于TNM分期系统。应用相关的分子生物学技术,如免疫组化及HE染色,大量文献阐述了免疫细胞类型(如CD3+/CD8+/FOXP3+T淋巴细胞)、细胞的密度以及免疫细胞浸润的部位与结直肠癌患者的预后相关[4-10],这种相关性已经在不同的肿瘤内得到了描述,如卵巢癌,乳腺癌等[11-14],但在结直肠癌患者中尚未得到明确的阐述。本研究根据T淋巴细胞亚型分类及浸润部位的不同进行分层分析,旨在系统评价肿瘤浸润淋巴细胞和结直肠癌的预后关系。
资料与方法
一、纳入标准
(1)关于总体评价淋巴细胞浸润及T淋巴细胞亚型(包括CD3+,CD8+,FoxP3+,CCR7+,CD45RO+,GRB+淋巴细胞亚型)与结直肠癌患者预后的研究;(2)应用免疫组化或HE染色方式确认各淋巴细胞浸润密度的高低;(3)结局指标为OS、CS、DFS或者报道原始数据;(4)研究的淋巴细胞浸润部位为肿瘤中心,肿瘤间质及肿瘤侵袭边缘。
二、方法
计算机检索Ovid MEDLINE(1946-2013)和EMBASE(1976-2013)数据库发表的文献,检索词制订根据MESH(Pubmed)及Emtree(Embase)主题词结合自由词并扩展下位词进行检索,应用PICO原则,包括结直肠癌,肿瘤浸润淋巴细胞,预后生存分析等。
文献提取数据为各个结局指标(OS,CS及DFS)的HR及95%CI,当原始文献中未提供HR信息,可以借助生存曲线提取相关数据[15-16]。_ENREF_19观察性研究的质量评价采用McShane及Hayes等[17-18]发明的自制量表进行。Meta分析采用Stata12.0软件。
结 果
一、文献检索结果
共检索2988篇文献,剔除重复文献,剩下2749篇文献;通过阅读文献题目和摘要,排除明显不相关的文献后,纳入70篇文献进行进一步阅读全文复筛,排除重复发表队列、数据不全文献,低质量小样本研究以及读者来信、综述类文献等,并补充手工检索纳入文献,最终纳入30篇文献,共计7840例患者。亚组分析显示:关于总体评价淋巴细胞浸润与结直肠癌患者预后的研究有12篇,T淋巴细胞亚型与结直肠癌患者预后的研究有18篇。
二、Meta分析结果
患者总体淋巴细胞浸润高的患者预后优于浸润低者,OS,CS和DFS的风险比分别为0.59,95% CI(0.48-0.72),0.40,95% CI(0.27-0.61)和0.72,95% CI(0.57-0.91)(图1)。根据淋巴细胞浸润部位及T淋巴细胞亚型分类进行分层分析表明:在肿瘤浸润中心,CD3+,CD8+和FoxP3+淋巴细胞浸润高的肿瘤患者的OS或CS显著优于浸润低的患者;在肿瘤间质,仅CD8+淋巴细胞浸润高的肿瘤患者的OS显著优于浸润低的患者;在肿瘤侵袭边缘,CD3+淋巴细胞浸润高的肿瘤患者的OS和DFS显著优于浸润低的患者。CCR7+淋巴细胞浸润高的肿瘤患者的OS显著优于浸润低的患者。
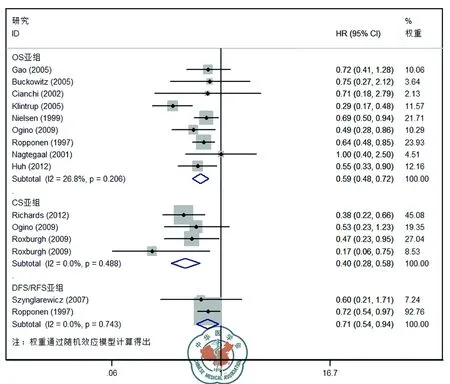
注:HR:风险比
三、偏倚分析
总体评价淋巴细胞浸润亚组中,报道OS结局指标的文献,漏斗图显示左右基本对称,并应用Egger’s检验(P=0.963)和Begg’s检验(P=1.00)结果一致,无显著发表偏倚。
讨 论
笔者对纳入的30篇观察性研究进行系统评价后发现,在结直肠癌中,总体评价淋巴细胞浸润密度高很可能是患者预后好的独立预测指标,各篇文献的结果报道较一致,敏感性分析也显示了结果的稳定性,亦无明显的发表偏倚存在。然而,按淋巴细胞浸润部位和浸润类型分类后合并的数据显示,各T淋巴细胞亚组浸润密度高并非是可靠的良好预后的预测指标。
免疫细胞浸润是肿瘤的一个共同特征,宿主的免疫反应对肿瘤的增殖,生长,侵袭,复发和转移有着重要的作用。研究已经证实免疫细胞浸润在不同的肿瘤和不同的个体间存在着差异,在肿瘤微环境的不同部位(包括肿瘤中心、间质和浸润边缘)存在着先天和过继性免疫细胞。多项研究表明肿瘤免疫细胞的浸润与其预后密切相关,包括患者的生存,肿瘤复发和转移等[7,13,19-20]。而且免疫细胞的不同亚型在不同的肿瘤内的分布也不同,以肿瘤中心和浸润边缘最为常见,不同的肿瘤淋巴细胞的浸润密度也各异,尤其是T淋巴细胞的浸润,这已经在不同的肿瘤里得到验证和患者预后密切相关,如乳腺癌、结直肠癌、前列腺癌、卵巢癌及胆囊癌等[7,13,21-23]。
本研究首次全面地评价了肿瘤浸润淋巴细胞与结直肠癌的预后关系,并以淋巴细胞亚型和浸润部位进行分层分别进行评价,这是以往meta分析所未涉及的内容[24-25]。我们研究的优势是检索较全面,选作分析的淋巴细胞为常见的T淋巴细胞亚型。然而,本研究基于观察性研究的特点,数据往往为不同的因素所干扰而产生不同程度的异质性,所以我们需慎重地解释评价结果。此外,只要符合纳入标准的研究,我们并未剔除研究质量相对较低的研究。而且由于每个亚组分析的研究数量较少也制约着我们对结果的解释。其中偏倚产生的原因可能有以下几点:(1)淋巴细胞浸润密度的高低的标准;(2)肿瘤局部免疫微环境中成份的复杂性,以及肿瘤分析和微卫星不稳定性等差异;(3)多种淋巴细胞亚型组合作为预测预后的指标,如CD8+/FOXP3+及CD3+/FoxP3+[10,26],其文献数量过少;(4)部分文献的数据因为缺失原始数据,仅从生存曲线上进行估算。为检测这些偏倚,我们联系了作者以获取研究的原始数据,并进行双人交叉提取数据。然而不能避免一些未发表的灰色文献或报道阴性结果的文献的遗漏,可能对最终研究的结果造成影响。
本研究虽然在一定程度上存在多种局限,但可以预测总体评价淋巴细胞浸润密度很可能是结直肠癌患者预后的可靠的预测指标,但对于T淋巴细胞各类亚型尚缺乏足够的数据支持它们是预测结直肠癌预后的可靠指标。未来的研究应着眼于高质量的前瞻性研究,并纳入患者全面的临床病理信息进行综合评价,并结合完善的随访策略,使得这项研究更加标准化。
[1] Li H,Fan X,Houghton J.Tumor microenvironment:the role of the tumor stroma in cancer.J Cell Biochem,2007,101(4):805-815.
[2] Liotta LA,Kohn EC.The microenvironment of the tumour-host interface.Nature,2001,411(6835):375-379.
[3] Jass JR.Lymphocytic infiltration and survival in rectal cancer.J Clin Pathol,1986,39(6):585-589.
[4] Chew A,Salama P,Robbshaw A,et al.SPARC,FOXP3,CD8 and CD45 correlation with disease recurrence and long-term disease-free survival in colorectal cancer.PloS one,2001,6(7):e22047.
[5] Chiba T,Ohtani H,Mizoi T,et al.Intraepithelial CD8+ T-cell-count becomes a prognostic factor after a longer follow-up period in human colorectal carcinoma:possible association with suppression of micrometastasis.Br J Cancer,2004,91(9):1711-1717.
[6] Correale P,Rotundo MS,Botta C,et al.Tumor infiltration by T lymphocytes expressing chemokine receptor 7(CCR7)is predictive of favorable outcome in patients with advanced colorectal carcinoma.Clin Cancer Res,2001,18(3):850-857.
[7] Galon J,Costes A,Sanchez-Cabo F,et al.Type,density,and location of immune cells within human colorectal tumors predict clinical outcome.Science,2006,313(5795):1960-1964.
[8] Naito Y,Saito K,Shiiba K,et al.CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer.Cancer Res,1998,58(16):3491-3494.
[9] Salama P,Phillips M,Grieu F,et al.Tumor-infiltrating FOXP3+ T regulatory cells show strong prognostic significance in colorectal cancer.J Clin Oncol,2009,27(2):186-192.
[10] Sinicrope FA,Rego RL,Ansell SM,et al.Intraepithelial effector(CD3+)/regulatory(FoxP3+)T-cell ratio predicts a clinical outcome of human colon carcinoma.Gastroenterology,2009,137(4):1270-1279.
[11] Liu S,Lachapelle J,Leung S,et al.CD8+ lymphocyte infiltration is an independent favorable prognostic indicator in basal-like breast cancer.Breast cancer research :BCR,2012,14(2):48.
[12] Mahmoud SM,Paish EC,Powe DG,et al.Tumor-infiltrating CD8+ lymphocytes predict clinical outcome in breast cancer.J Clin Oncol,2001,29(15):1949-1955.
[13] Sato E,Olson SH,Ahn J,et al.Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer.Proc Natl Acad Sci,2005,102(51):18538-18543.
[14] Tomsova M,Melichar B,Sedlakova I,et al.Prognostic significance of CD3+ tumor-infiltrating lymphocytes in ovarian carcinoma.Gynecol Oncol,2008,108(2):415-420.
[15] Parmar MK,Torri V,Stewart L.Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints.Stat Med,1998,17(24):2815-2834.
[16] Tierney JF,Stewart LA,Ghersi D,et al.Practical methods for incorporating summary time-to-event data into meta-analysis.Trials,2007,8:16.
[17] Mc Shane LM,Altman DG,Sauerbrei W,et al.REporting recommendations for tumour MARKer prognostic studies(REMARK).Br J Cancer,2005,93(4):387-391.
[18] Hayes DF,Bast RC,Desch CE,et al.Tumor marker utility grading system:a framework to evaluate clinical utility of tumor markers.J Natl Cancer Inst,1966,88(20):1456-1466.
[19] Pagès F,Kirilovsky A,Mlecnik B,et al.In situ cytotoxic and memory T cells predict outcome in patients with early-stage colorectal cancer.J Clin Oncol,2009,27(35):5944-5951.
[20] Nakano O,Sato M,Naito Y,et al.Proliferative Activity of Intratumoral CD8+ T-Lymphocytes As a Prognostic Factor in Human Renal Cell Carcinoma Clinicopathologic Demonstration of Antitumor Immunity.Cancer Res,2001,61(13):5132-5136.
[21] Seo AN,Lee HJ,Kim EJ,et al.Tumour-infiltrating CD8+ lymphocytes as an independent predictive factor for pathological complete response to primary systemic therapy in breast cancer.Br J Cancer,2013,109(10):2705-2713.
[22] Flammiger A,Bayer F,Cirugeda‐Kühnert A,et al.Intratumoral T but not B lymphocytes are related to clinical outcome in prostate cancer.Apmis,2012,120(11):,901-908.
[23] Goeppert B,Frauenschuh L,Zucknick M,et al.Prognostic impact of tumour-infiltrating immune cells on biliary tract cancer.Br J Cancer,2013,109(10):2665-2674.
[24] Gooden M,De Bock G,Leffers N,et al.The prognostic influence of tumour-infiltrating lymphocytes in cancer:a systematic review with meta-analysis.Br J Cancer,2011,105(1):93-103.
[25] Kost SE,Kakal JA,Nelson BH.The prognostic value of FoxP3+ tumor-infiltrating lymphocytes in cancer:a critical review of the literature.Clin Cancer Res,2012,18(11):3022-3029.
[26] Suzuki H,Chikazawa N,Tasaka T,et al.Intratumoral CD8(+)T/FOXP3(+)cell ratio is a predictive marker for survival in patients with colorectal cancer.Cancer Immunol Immunother,2011,59(5):653-661.

