替比夫定阻断乙肝母婴传播对妊娠结局的影响及安全性评价
高荷 杨宏伟 王玮
·论著·
替比夫定阻断乙肝母婴传播对妊娠结局的影响及安全性评价
高荷 杨宏伟 王玮
目的探讨替比夫定联合乙肝免疫球蛋白(HBIG)、乙肝疫苗阻断HBV母婴垂直传播对妊娠结局的影响及安全性。方法将2010年6月至2013年12月期间收治的妊娠合并乙肝患者112例随机分为观察组和对照组,每组56例。观察组采用孕末期口服替比夫定干预,对照组孕期未采用任何干预措施。2组分娩的新生儿均于出生24 h内注射HBIG,并于0、1、6月龄接种乙肝疫苗。检测2组分娩前ALT、HBV-DNA水平、妊娠结局及新生儿12月龄时乙肝血清标志物和发育情况。结果观察组分娩前ALT、HBV-DNA水平显著低于对照组,HBV母婴传播阻断率显著高于对照组(P<0.05);而2组不良妊娠发生率及新生儿发育状况比较差异无统计学意义(P>0.05)。结论抗病毒治疗联合出生后接种HBIG和乙肝疫苗的免疫策略能够有效阻断母婴垂直传播,对妊娠结局和新生儿发育无影响。
替比夫定;乙型肝炎;妊娠结局;安全性
慢性乙型病毒性肝炎(乙肝)是我国重点防治的传染病,是导致肝硬化和肝癌发病率高的主要原因。乙肝病毒(hepatitis B virus,HBV)的传播途径有经血、性接触及母婴垂直传播,而后者是HBV感染的主要途径,报道称我国有30%~50%的慢性HBV感染者经此途径形成[1]。因此,有效阻断母婴传播是预防乙肝的关键措施。目前,对高危新生儿出生后接种乙肝免疫球蛋白(HBIG)和乙肝疫苗的联合免疫程序被国内外普遍采用,但仍有5%~10%的新生儿出现免疫阻断失败[2,3]。研究表明,宫内感染多发生在妊娠末期,而母体高病毒载量是造成母婴阻断失败的主要危险因素[4]。现已证实,妊娠B级药物替比夫定对HBV具有强效抑制作用[3],但有关其对妊娠结局及安全性影响的研究尚不多见。本文通过对我科收治的妊娠合并HBV感染孕妇给予替比夫定治疗,观察其对妊娠结局及新生儿发育状况的影响。
1 资料与方法
1.1 一般资料 选取2010年6月至2013年12月期间我科住院分娩的HBV患者112例,其中HBsAg和HBeAg双阳性74例,HBsAg单阳性38例,均符合2010年版《慢性乙型肝炎防治指南》中的乙肝诊断标准[1]。孕妇年龄23~33岁,中位年龄27.7岁,所有患者均未接受任何抗病毒治疗,排除合并梅毒、疱疹或甲型、丙型、丁型、戊型肝炎病毒感染。随机分为观察组和对照组,每组56例。2组一般资料具有可比性。
1.2 方法
1.2.1 阻断方法:观察组:孕28周开始至产前口服替比夫定,0.6 g/次,1次/d;对照组:孕期未采用任何干预措施。2组分娩的婴儿均于出生后接受乙肝主被动联合免疫注射,即出生24 h内注射HBIG 200 U(200 U/瓶,石家庄以岭药业股份有限公司)及0、1、6月龄接种酵母重组乙肝疫苗10 μg(10 μg/0.5 ml,石家庄以岭药业股份有限公司)。
1.2.2 检测方法:所有孕妇于孕28周(抗病毒治疗)、新生儿于12月龄采集静脉血,采用酶联免疫吸附法(ELISA)检测HBV血清标志物,试剂盒由上海生工生物工程有限公司提供,严格参照说明书操作。采用荧光定量PCR法定量检测HBV-DNA,试剂盒由美国Promega公司提供。
1.2.3 观察指标:监测2组肝功能变化及HBV-DNA水平、妊娠并发症发生率及新生儿HBV血清标志物、生长发育状况。
1.3 母婴传播诊断标准 宫内感染:新生儿静脉血HBsAg和/或HBV-DNA阳性;阻断失败:持续至12月龄新生儿静脉血HBV-DNA阳性。
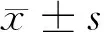
2 结果
2.1 2组肝功能及HBV-DNA水平比较 治疗前,2组孕妇ALT及HBV-DNA水平比较差异无统计学意义(P>0.05);分娩前,观察组孕妇ALT及HBV-DNA水平与治疗前比较显著降低(P<0.05),与对照组比较差异有统计学意义(P<0.05)。见表1。
表1 2组肝功能及HBV-DNA水平比较

组别时间ALT(U/L)HBV-DNA(Logcopies/ml)观察组治疗前33±68.0±1.2分娩前23±5*#3.1±0.5*#对照组治疗前33±77.7±1.0分娩前57±136.4±1.3
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05
2.2 2组妊娠结局比较 观察组未发生自然流产或实施人工流产,对照组有3例因肝功能异常实施人工流产,2组比较差异有统计学意义(P<0.05)。观察组剖宫产5例:先兆早产1例、胎膜早破2例、合并妊娠糖尿病2例,其中产后出血1例;对照组剖宫产6例:先兆早产1例、胎膜早破1例、胎儿宫内窘迫1例、合并妊娠糖尿病1例、妊娠高血压2例,其中产后出血2例,2组不良妊娠、产后出血比较差异无统计学意义(P>0.05)。见表2。

表2 2组妊娠结局比较 n=56,例(%)
注:与对照组比较,*P<0.05
2.3 2组HBV母婴传播情况比较 与对照组比较,观察组HBsAb阳性率显著升高(P<0.05),HBsAg、HBV-DNA阳性率显著降低(P<0.05)。见表3。

表3 2组HBV血清标志物及母婴阻断效果比较 n=56,例(%)
注:与对照组比较,*P<0.05
2.4 2组新生儿发育情况比较 2组新生儿在身长、头围、体重等方面比较,差异无统计学意义(P>0.05),均无先天性畸形,发育状况良好。见表4。
表4 2组新生儿发育情况比较
3 讨论
妊娠期间由于母体肝脏负荷加重促进了病毒复制过程,导致原有肝功能损害进一步加重,主要产生以下不利影响:(1)由于凝血因子、血小板及白细胞减少及肝脏对血管活性物质灭活减低,产妇发生产后出血、感染以及合并妊娠高血压和糖尿病的风险增加;(2)蛋白质等营养物质合成不足容易导致低体重儿、新生儿营养不良及新生儿窒息等[5]。因此,妊娠合并慢性HBV感染对母婴双方均造成严重危害,应采取有效措施阻断HBV母婴传播。研究显示,妊娠末期应用替比夫定能够明显抑制母体HBV,阻断HBV宫内感染,对高危新生儿具有显著保护作用,同时有助于母体肝功能改善,减少妊娠并发症发生[6]。
本研究显示,经替比夫定治疗后患者产前ALT及HBV-DNA水平显著下调,与对照组比较差异有统计学意义(P<0.05),说明抗病毒治疗对改善患者肝功能及预后有显著疗效。另外,应用替比夫后患者流产风险明显降低,同时妊娠不良事件发生率及产后出血几率与对照组比较并未增加,提示抗病毒治疗并不导致严重妊娠并发症发生。
国内外研究表明,高病毒载量是造成母婴阻断失败的主要危险因素[4]。本研究显示,经替比夫定治疗后HBsAg宫内感染率仅为1.8%,乙肝抗体阳转率高达98.2%,与未用替比夫定的患者比较差异有统计学差异(P<0.05),说明对HBV感染孕妇进行产前3个月的抗病毒治疗配合母婴主被动联合免疫可使母婴阻断成功率提高到98.2%。另外,反映新生儿发育状况的多项指标及Apgar评分与对照组比较差异无统计学意义(P>0.05),与范玲燕等[7]研究结果一致,一方面说明高病毒载量不是影响新生儿发育状况的关键因素,另一方面也说明替比夫定用于治疗妊娠合并乙肝安全性好。
总之,应用替比夫定治疗妊娠合并HBV感染对母婴双方均具有显著疗效,不仅能够最大限度的抑制HBV母婴垂直传播,且对母体和新生儿安全方面无不利影响。
1 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版).中国肝脏病杂志(电子版),2011,3:40-56.
2 Luo Z,Li L,Ruan B.Impact of the implementation of a vaccination strategy on hepatitis B virus infections in China over a 20-year period.Int J Infect Dis,2012,16:e82-e88.
3 Chen HL,Lin LH,Hu FC,et al.Effects of maternal screening and universal immunization to prevent mother-to-infant transmission of HBV.Gastroenterology,2012,142:773-781.
4 Singh AE,Plitt SS,Osiowy C,et al.Factors associated with vaccine failure and vertical transmission of hepatitis B among acohort of Canadian mothers and infants.J Viral Hepat,2011,18:468-473.
5 Sinha S,Kumar M.Pregnancy and chronic hepatitis B virus infection.Hepatol Res,2010,40:31-48.
6 Han GR,Cao MK,Zhao W,et al.A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection.J Hepatology,2011,55:1215-1221.
7 范玲燕,姜秀浓,万炯,等.替比夫定对乙型肝炎病毒母婴传播的阻断作用及安全性分析.医学研究杂志,2013,42:103-106.
10.3969/j.issn.1002-7386.2014.15.012
075000 河北省张家口市传染病医院消化科
R 714.255
A
1002-7386(2014)15-2274-02
2014-01-24)

