一株GPV的分离鉴定及致病性研究
饶桂波,邵洪泽,胡桂学,吴健敏*
(1.广西兽医研究所,广西 南宁 530001;2.吉林省兽医科学研究所,吉林 长春 130062;3.吉林农业大学,吉林 长春 130118)
一株GPV的分离鉴定及致病性研究
饶桂波1,邵洪泽2,胡桂学3*,吴健敏1*
(1.广西兽医研究所,广西 南宁 530001;2.吉林省兽医科学研究所,吉林 长春 130062;3.吉林农业大学,吉林 长春 130118)
为了确定导致吉林省某地区10日龄雏鹅发病的病原,从病死雏鹅的肝脏中分离到一株病毒,根据病毒的电镜照片,动物回归试验及PCR鉴定,确定为鹅细小病毒。PCR产物测序后经BLAST比对显示,分离毒株与NCBI收录的GPV VP3基因同源性均在92%以上,与GPV/CH/HLJ02/08 VP3基因的同源性最高,达99%。致病性研究表明,分离株的ELD50为10-6.5/0.2 mL,毒力较强,且该毒株能被GPV标准血清所中和。
鹅细小病毒;分离鉴定;致病性
小鹅瘟是由鹅细小病毒(Goose parvirus,GPV)引起的雏鹅的一种急性或亚急性的败血性传染病,病毒主要侵染鹅的肠部,患病鹅主要表现为出血性、纤维素性和渗出性肠炎,发病后期能形成肠内栓塞。该病毒主要侵害3周内的雏鹅和雏番鸭,具有传播快、死亡率高的特点,发病耐过的雏鹅和番鸭表现为生长发育迟缓[1]。1956年我国学者方定一首先发现了该病,十多年后许多欧洲国家发现该病并报道称为Derzsy's病,后确定该病的病原体为鹅细小病毒。自此以后许多国家都报道了鹅细小病毒病的发生和流行[2-3]。
2011年5月吉林省某养鹅场10日龄吉林白鹅大批死亡。询问得知雏鹅和种鹅均未接种过小鹅瘟疫苗或抗小鹅瘟血清。病鹅死前腹泻严重,粪便呈绿色,濒死期角弓反张。剖检见小肠内有栓子,切面轮层状。采集病料后经实验室诊断为鹅细小病毒病。
1 材料与方法
1.1 病料采集
无菌采集吉林省某地区送检的病死鹅肝脏。
1.2 试验鹅胚及雏鹅
无GPV母源抗体的鹅胚和10日龄雏鹅,购自吉林省农业科学院畜牧分院。
1.3 培养基的制备
按常规方法制普通琼脂平板、马丁琼脂平板、巧克力琼脂平板、麦康凯琼脂平板。
1.4 主要试剂
高免血清和GPV JLDA株由吉林省兽医科学研究所赠送;Taq DNA Polymerase、dNTPs、100 bp DNA Ladder等,购自宝生物公司。
1.5 PCR引物
根据GenBank上鹅细小病毒VP3基因设计合成引物,P1:5'-ATAAGCGCC TTTCACAGC-3';P2:5'-AAC GCA GGA TCA GAC GAA-3'
1.6 细菌的分离培养
取病死鹅的肝组织分别无菌接种LB普通琼脂平板、马丁琼脂平板、巧克力琼脂平板、麦康凯琼脂平板,37 ℃培养24 h,观察细菌生长情况。
1.7 病毒的分离培养
采集病死鹅肝脏,经常规处理后,经尿囊腔接种发育良好的12日龄鹅胚,0.2 mL/枚,10枚/组。对照组接种无菌生理盐水。37 ℃培养,每隔8h观察鹅胚生长情况。去除24 h内死亡的鹅胚,无菌收集24 ~120 h之间死亡鹅胚尿囊液,冷冻保存备用,并连续传5代。
1.8 雏鹅回归试验
检测无母源抗体的1日龄雏鹅,随机分为2组,10只/组。第1组肌肉接种分离毒株尿囊液;第2组接种生理盐水作对照组,0.2 mL/只。两组雏鹅均分别隔离饲养观察。
1.9 分离毒株电镜观察
取出现病变的鹅胚尿囊液,1 000 r/min 离心10 min,上清液置于铜网上,2%磷钨酸负染1~2 min,于JME2100EA Ⅲ(日本)透射电镜观察并照相。
1.10 PCR检测
以提取的分离毒和标准毒的核酸为模板,采用50 μL反应体系:在0.5 mL反应管中依次加10×Buffer 5 μL、2.5 mmol/L dNTPs 2 μL、灭菌双蒸水35 μL、2 U/μL Taq酶1 μL、20 pmol/μL上游引物、下游引物各1 μL、模板5 μL。PCR反应条件:95 ℃ 5 min;94℃ 30 s,63℃ 30 s,72℃ 40 s,30个循环;72 ℃ 10 min,4 ℃保存。扩增片段经琼脂糖凝胶鉴定后,送宝生物公司测序。
1.11 分离株ELD50 的测定
收获的稳定毒株作10倍梯度稀释后,经尿囊腔分别接种12日龄鹅胚,每个稀释度接种10枚,0.2 mL/枚,共10组。同时设无菌生理盐水对照组。接种后继续孵化,弃24 h内死亡的鹅胚。统计24 ~120 h内鹅胚死亡情况,按Reed-Muench法计算ELD50,并剖检死亡鹅胚观察病变情况。
1.12 雏鹅保护试验
取1日龄雏鹅40只,随机分为4组。第1组肌肉注射特异性高免血清,1 mL/只,24 h后用分离株尿囊液经肌肉注射攻毒,0.2 mL/只;第2组不注射特异性高免血清,24 h后同样用分离株尿囊液经肌肉注射攻毒,0.2 mL/只;第3组肌肉注射特异性高免血清,0.2 mL/只;第4组无菌生理盐水作对照组,0.2 mL/只。4组试验雏鹅均隔离饲养观察。
1.13 鹅胚中和试验
取12日龄鹅胚40枚,随机分为4组。第1组将收获的标准株尿囊液作1∶10稀释,与高免血清等体积混合后,37 ℃感作1 h;第2组将分离株传代尿囊液作1∶10稀释,与高免血清混合液37 ℃感作1 h;第3组为高免血清;第4组为无菌生理盐水对照组。各组鹅胚均经尿囊腔接种,0.2 mL/枚,接种后继续孵化,观察鹅胚死亡情况。
2 结 果
2.1 细菌分离培养结果
无菌取剖检的病死鹅肝脏,分别划线接种于制备好的各种培养上,进行细菌分离培养,结果均无细菌生长。
2.2 病毒分离培养结果
处理的病料取上清,无菌接种于鹅胚尿囊腔,0.2 mL/枚,结果表明,试验组鹅胚孵化至48~120 h全部死亡,对照组均未死亡,于120 h后4 ℃处死,试验结果如表1所示。

表1 病料接种鹅胚的试验结果Table 1 The experimental result of disease inoculation in goose embryos
表2 死亡鹅胚尿囊液经鹅胚接种盲传的结果Table 2 The result of death embryo allantoic fluid inoculated in goose by blind passage
取48~112 h死亡鹅胚的尿囊液,100倍稀释后,分别接种鹅胚,盲传5代。结果如表2所示,盲传至第3代后,鹅胚多于72~96 h内死亡。剖检112 h内死亡的鹅胚,见胚体、绒毛尿囊膜水肿,翼和爪末端有明显的出血点,胚头、眼两侧充血严重,喙部有点状出血。
2.3 雏鹅回归试验结果
试验组经肌肉接种分离毒株尿囊液,雏鹅的感染及死亡情况如表3所示,接种48 h后全部发病,240 h后9只死亡。患鹅表现为食欲不振,行动迟缓,呆立不稳,喜卧,排出灰白色或黄绿色稀粪并混有气泡。剖检3~4日龄病死鹅,全身呈败血变化,肝、肾肿大,胰腺肿大呈淡黄色,泄殖腔扩张。4~10日龄死亡雏鹅的小肠粘膜脱落,凝固,剖开回盲部见有灰白色栓子,质地坚硬。胆囊膨大充满胆汁,肝脏呈黄色,心冠状脂肪有针尖大小点状出血。对照组雏鹅健康,未出现临床症状。

表3 雏鹅攻毒回归试验结果Table 3 The result of regression test for Goslings attacked by virus
2.4 电镜观察结果
死亡鹅胚尿囊液进行磷钨酸负染后,电镜观察, 可见病毒粒子直径约20 nm,无囊膜,具有细小病毒的特征,如图1所示。
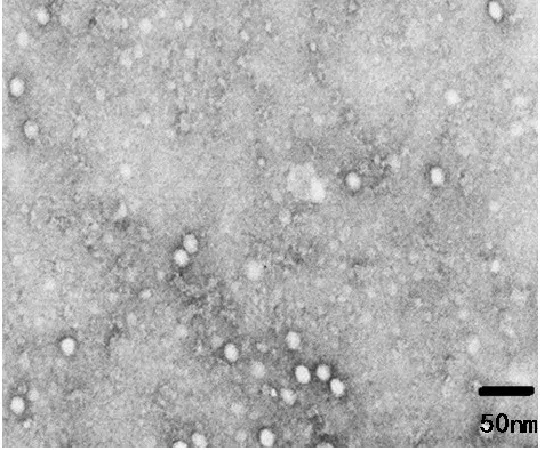
图1 电镜观察结果Fig.1 The result of the electronmicroscopy
2.5 PCR鉴定结果
PCR扩增产物电泳后,在紫外灯下观察到1条约430 bp的特异性条带,与预期的目的片段大小相符(图2)。
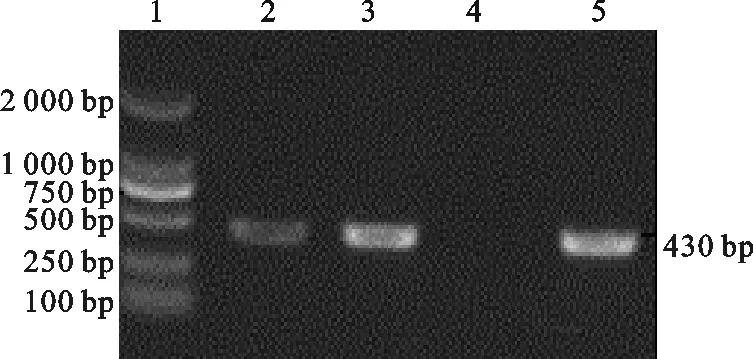
图2 PCR产物电泳结果1.DL2000 DNA Marker;2.病料;3.病毒尿囊液;4.阴性对照;5.阳性对照Fig.2 The results of electrophoresis of PCR products 1.DL2000 DNA Marker; 2.Diseased;3.Virus allantoic fluid;4.Negative control;5.Positive control
2.6 PCR产物测序结果分析
将PCR扩增片段的序列在GenBank中进行BLAST比对,与GPV VP3基因同源性均在92%以上。其中与2008年黑龙江分离的GPV/CH/HLJ02/08 VP3基因同源性最高达99%,与2004年法国分离的GPV D146/02 VP3基因同源性最低但是也能达到达92%。表明本试验分离毒株为鹅细小病毒,命名为GPV/CH/JLTP/05/11株。对近年来GenBank上录入的所有GPV基因序列进行比对,制作遗传进化树结果如图3所示。
遗传进化树分析显示目前流行的GPV毒株有两个关系较近的基因群,本研究分离毒株与GPV/CH/ HLJ02/08 VP3所在群关系较近。GPV/CH/JLTP/05/11株基因片段与黑龙江和吉林的地方株VP3序列比对发现,与GPV/CH/HLJ02/08(99%)关系较近,而与吉林省地方分离株型JLDA株(96%)的关系反而较远。对三个序列比较后,用DAMBE软件分析位点变化率,结果见图4,集中于351 nt处,为变异的高频位点。
2.7 分离株ELD50测定
取分离毒株尿囊液10倍梯度稀释后,接种于12日龄鹅胚,统计24 h~120 h内死亡情况,如表4所示,经Reed-Muench法计算ELD50,分离株的ELD50为10-6.5/0.2 mL。
2.8 雏鹅保护试验结果
雏鹅注射高免血清后,经肌肉接种分离株,结果发现,第1组攻毒后观察10 d全部存活,且无明显临床症状。不注射特异性高免血清第2组攻毒后观察10 d全部死亡,死前有肠炎症状,死后解剖有小鹅瘟特征性病变,如图5所示;仅注射特异性高免血清的第3组及注射无菌生理盐水的4组观察10 d全部存活,且无明显临床症状。
2.9 鹅胚中和试验结果
分离株尿囊液10倍稀释,与高免血清混合液感作后经尿囊腔接种12日龄鹅胚,结果发现各组鹅胚120 h全部存活,鹅胚无病变。
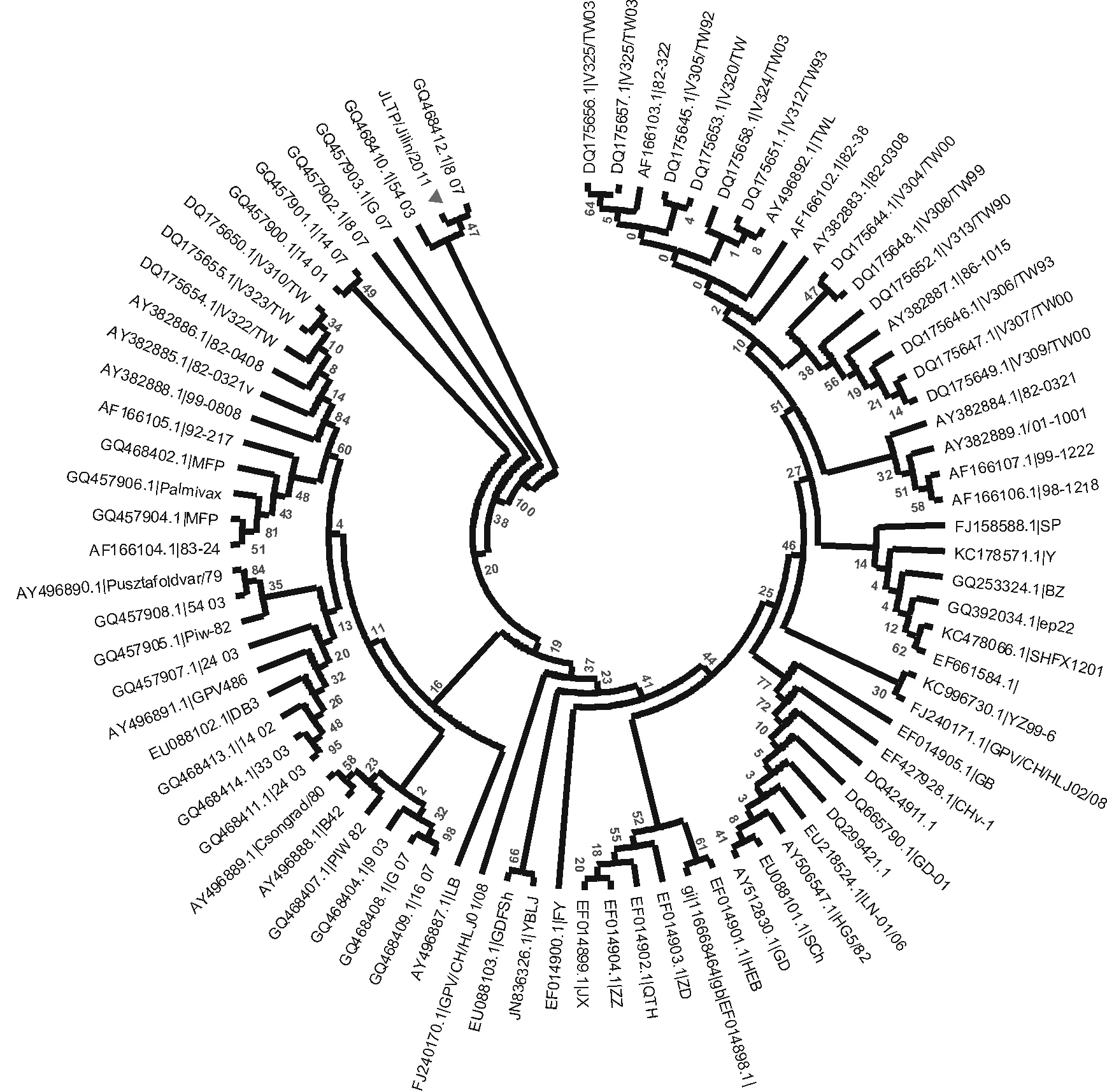
图3 JLTPVP3基因进化树分析结果Fig.3 The results of JLTP strain VP3 gen Phylogenetic analysis

表4 JLTP分离毒株ELD50测定结果Table 4 The determination results of ELD50 isolated from JLTP
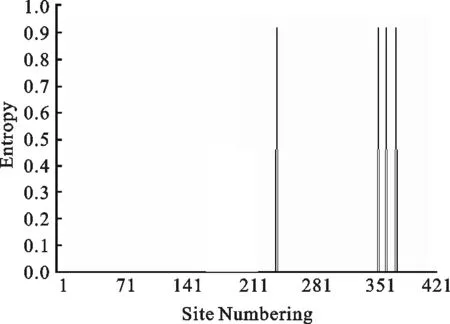
图4 位点变异率Fig.4 Substitution rates over sites

图5 病死雏鹅形成肠内栓塞物Fig.5 Intestinal embolus for dead goslings
3 讨 论
本试验经病毒分离、电镜负染尿囊液观察、动物回归试验、PCR检测、中和试验结果表明,所分离的病毒为GPV,由此确诊吉林某地发生的疫情为小鹅瘟。通过对所得的目的基因的Blast比较、遗传进化树分析结果表明:分离到的GPV与2008年分离的黑龙江度GPV/CH/HL J02/08 VP3基因同源性最高,达99%。而与吉林省兽医科学研究所2004年分离的地方株型JLDA株同源性相对较差,96%。产生这一差异这可能是由于近年吉林省养鹅效益好,导致养殖数量激增,从黑龙江省引种带入该毒株。因此提醒广大养鹅业户,应及时接种小鹅瘟疫苗或高免血清,防止本病流行的同时,注意引进雏鹅的检疫,以及科学化的饲养管理。
研究分离株的致病性,其ELD50为10-6.5/0.2 mL,毒力较强。分毒鹅胚尿囊液经盲传后,仅到第三代毒力已趋稳,这表明该毒株在吉林某地区应该存在一段时间了,且毒力有增强趋势。GPV仅有一个血清型[4],经鹅胚中和试验和雏鹅保护性试验发现,该毒株能被标准株高免血清中和,表明其血清型没有改变,但病毒基因分析有两个相近群,未来依然要加强病毒血清型的监测。
根据流行病学,结合临诊症状和特有的病理变化可对小鹅瘟进行初诊断,确诊需进行病毒分离,病毒中和试验、琼脂扩散试验和ELISA试验[5-7]检查血清中特异性抗体,从而判断未免疫鹅群感染过或正感染鹅细小病毒,而PCR检测技术更具有敏感性和特异性的特点,能够准确检测病原[8-10]。GPV的防控主要从管理、预防和治疗三个方面着手。目前的防治小鹅瘟的有效方法,一是接种疫苗,二是采用高免卵黄液或血清进行紧急预防和治疗。种鹅接种GPV疫苗后能产生中和抗体,并经卵黄传给雏鹅,使其获得天然被动免疫,从而抵抗GPV的侵袭。需要注意的是种鹅免疫GPV疫苗后,产生的母源抗体将会影响雏鹅活疫苗的免疫效果,应进行母源抗体检测,选择合适的时间进行GPV疫苗免疫。
[1]方定一,王永坤,郑玉美,等.小鹅瘟病原体及其特异性防治的研究[J].中国农业科学,1981(1):1-8.
[2]Kozdruń W,Wozniakowski G,Samorek-Salamonowicz E,et al.Viral infection in goose flocks in Poland[J].Polish Journal of Veterinary Sciences,2012,15(3):525-30.
[3]Irvine R,Ceeraz V,Cox B,et al.Goose parvovirus in Great Britain[J].Veterinary Record,2008,163(15): 461.
[4]Shien J H,Wang Y S,Chen C H,et al.Identification of sequence changes in live attenuated goose parvovirus vaccine strains developed in Asia and Europe[J].Avian Pathology,2008,37(5): 499-505.
[5]Fan J H,Zuo Y Z,Yang Z,et al.The development of an indirect ELISA for the detection of antibodies to goose parvovirus in blood serum [J].Letters in applied microbiology,2013,57(1):26-32.
[6]Yang J L,Cheng A C,Wang M S,et al.Development of a fluorescent quantitative real-time polymerase chain reaction assay for the detection of Goose parvovirus in vivo[J].Virology Journal,2009(6): 142.
[7]刘 菲,唐卫杰,程安春,等.抗鹅细小病毒卵黄IgG的制备及其间接ELISA检测方法的建立[J].中国兽医科学,2011,41(06):601-606.
[8]布日额,王君伟,吴金花,等.GPV 野毒株的分离及 PCR 检测方法的应用[J].中国预防兽医学报,2003,25(6): 469-472.
[9]Chen Z,Li C,Liu G,et al.Rapid diagnosis of goose viral infections by multiplex PCR [J].Journal of Virological Methods,2013,191(2):101-104.
[10]刘家森,姜 骞,司昌德,等.番鸭细小病毒与鹅细小病毒 PCR 鉴别诊断方法的建立[J].中国兽医科学,2007,37 (6): 469-472.
Isolation,IdentificationandPathogenicityofaStrainofGPV
RAO Gui-bo1,SHAO Hong-ze2,HU Gui-xue3*,WU Jian-min1*
(1.GuangxiVeterinaryResearchInstitute,NanningGuangxi,530001,China;2.JilinInstituteofVeterinaryScience,ChangchunJilin,130062,China; 3.JilinAgriculturalUniversity,ChangchunJilin,130118,China)
A strain of Goose parvirus isolated from the livers of dead goslings in an area of Jilin province was identified to be the pathogen of the 10-day-old goslings disease based on its electron micrograph,animal regression test and PCR results.A comparison through BLAST showed that the VP3 gene of the isolated strain had a homology of more than 92% with those of the GPV included in NCBI and a highest homology with those of GPV/CH/HLJ02/08,which was up to 99%.Pathogenicity research on it showed that its ELD50is 10-6.5/0.2 mL,a very strong virulence.And the strain can be neutralized by standard serum of the GPV.
goose parvirus; isolation and identification; pathogenicity
2013-08-15,
2013-09-24
饶桂波(1987-),男,安徽阜阳人,硕士,研究方向:动物病毒学。E-mail:raoguibo@126.com
*[通讯作者]吴健敏(1963-),女,福建福州人,博士,研究员,博士生导师,研究方向:分子病毒学与传染病学。E-mail:wu-jm20@163.com胡桂学(1963-),男,吉林长春人,博士,教授,博士生导师,研究方向:动物微生物学与免疫学。E-mail:huguixue901103@163.com
S811.6
A
1005-5228(2014)01-0049-05

