猪伪狂犬病毒gD蛋白的截短表达与PPA-ELISA抗体检测方法的建立
祖立闯,沈志强,*,郭广君,王金良,苗立中,董 林,吕素芳
(1.山东绿都生物科技有限公司,山东 滨州256600;2.山东省滨州畜牧兽医研究院,山东 滨州256600)
猪伪狂犬病(Pseudorabies,PR)是由猪伪狂犬病毒(Pseudorabies virus,PRV)引起猪的一种急性、热性传染病,主要以发热、脑脊髓炎、奇痒、呼吸和神经系统障碍为主要特征,临床上表现怀孕母猪流产、死胎、弱胎、木乃伊胎;新生仔猪发热、神经症状、麻痹、衰竭死亡,死亡率可达100%;成年猪多耐过而呈隐性感染,成为该病的主要传染源[1-2]。该病在世界范围内流行,给全球养猪业造成了巨大的经济损失[3-5],我国自1947年发现此病以来,现全国已有30多个省份发生流行,是严重危害我国养猪业的重要疫病之一[6]。该病的危害在于病毒侵入猪体后,可潜伏于三叉神经节或荐神经节造成潜伏感染,病毒的潜伏感染使病猪终身带毒并周期性向外排毒,给疾病的防治带来很大困难[7]。
PRV属疱疹病毒科(Herpesvifidae)a-疱疹病毒亚科(Alpha-herpesvirinae),在生物型上属于猪疱疹病毒I型(Suid herpesvirus-1,SHV-1)[8]。SHV-1基因大约编码50种结构蛋白,有11种为糖蛋白,其中gD是PRV的主要结构蛋白,它不但诱导体液免疫,而且诱导细胞免疫,同时是病毒粒子表面的病毒感染细胞的主要分子,在病毒吸附和侵入宿主细胞过程中发挥重要作用,为病毒复制的必需基因,是一种重要的中和抗原,也是保护性抗体的主要目标,能诱导较好的保护反应,抵抗PRV强毒株攻击[9-13]。因此gD被作为PRV特异性抗原研究的首选蛋白。本研究对gD基因进行了截短表达,以表达的重组蛋白为包被抗原,优化ELISA反应条件,建立了可检测PR血清抗体的间接ELISA诊断方法,并对现地采集的猪血清进行了检测。
1 材料和方法
1.1 病毒株、细胞、菌株与血清
猪伪狂犬病毒SA株、仓鼠肾细胞BHK-21、克隆菌株 DH5α、表达菌株 BL21(DE3)、表达载体pET30a(+)均由本实验室保存。猪伪狂犬病病毒(Pseudorabies virus,PRV)阳性及阴性血清、猪瘟病毒(Classical Swine Fever virus,CSFV)、猪细小病毒(Porcine parvovirus,PPV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome,PRRSV)、猪乙型脑炎病毒(Japanese encephalitis virus,JEV)、猪圆环病毒2型(Porcine circovirus type,PCV-2)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎 病 毒 (Transmissible gastroenteritis virus,TGEV)阳性血清均由本实验室保存。IDEXX gDELISA试剂盒检测为PR抗体阳性血清样品102份及阴性的血清样品共86份,由上海畜牧兽医总站惠赠。临床血清样品共316份由本实验室保存。
1.2 主要试剂
Ex Taq酶、pMD18-T克隆载体、T4DNA连接酶及其它限制性内切酶均购自宝生物工程(大连)有限公司;低分子量蛋白Marker、TEMED购自北京鼎国生物技术有限公司;蛋白酶K、质粒DNA提取试剂盒与胶回收试剂盒购自生工生物工程(上海)有限公司;辣根过氧化物酶标记葡萄球菌A蛋白(HRP-SPA)、TMB底物显色液购自天根生化科技(北京)有限公司。
1.3 病毒基因组DNA的提取
将PRV接种于BHK-21单层细胞,待细胞出现典型病变后,收获病毒,取病毒液535μL,加60 μL 10%SDS和5μL蛋白酶K(终浓度为200μg/mL),56℃水浴1h,分别用酚:氯仿:异戊醇、氯仿:异戊醇各抽提1次,上清加入异丙醇沉淀DNA,用75%乙醇洗涤2次,风干后加60μL灭菌去离子水,测定纯度及浓度后-20℃保存备用。
1.4 引物设计与合成
根据GenBank公布的PRV的SA毒株基因组序列(NC_006151),利用oligo6.2软件设计了扩增gD基因的一对 引物,P1 5'-ATAGGATCCGCGTACCCGTACACC GA-3';P2 5'-ATTCAAGCTTC CCAGGAGGCGATACCC-3'(划线部分表示引入的BamH I、HindIII酶切位点),引物由生工生物工程(上海)有限公司合成。
1.5 gD基因的PCR扩增与克隆
以提取的病毒基因组DNA为模板,用设计的引物PCR扩增gD基因,PCR反应条件为:95℃5 min预变性、95℃l min、60℃l min、72℃l min,共进行30个循环,72℃延伸10min,4℃终止反应。PCR产物纯化后与pMD18-T载体于4℃过夜连接,转化 DH5α大肠杆菌感受态细胞,PCR及BamH I/HindIII双酶切鉴定得到阳性重组质粒pMD18-T-gD,送生工生物工程(上海)有限公司进行序列测定。
1.6 gD基因表达载体的构建与鉴定
利用BamH I/HindIII双酶切pMD18-T-gD,回收目的片段,将其定向克隆到经BamH I/Hind III双酶切的pET30a表达载体中,转化感受态细菌DH5α,经PCR及酶切鉴定后获得重组表达载体pET30a-gD。鉴定阳性的克隆送生工生物工程(上海)有限公司测序,以验证其阅读框架。
1.7 pET30a-gD重组蛋白的表达与纯化
将pET30a-gD重组质粒转化BL21(DE3)感受态细胞,采用不同诱导剂浓度、不同时间、不同温度诱导pET30a-gD重组蛋白的表达,经SDS-PAGE电泳分析,确定最佳诱导剂浓度、诱导时间、诱导温度。以最佳条件诱导表达后,超声破碎细胞,12 000 r/min离心15min,分别收集上清及沉淀进行SDSPAGE分析,鉴定目的蛋白是以可溶性形式存在于上清中还是以包涵体形式存在于沉淀中。对以包涵体形式表达的重组蛋白用尿素对其进行变性处理,包涵体溶解后采用镍离子亲和层析法纯化,纯化蛋白透析复性,进行SDS-PAGE电泳分析。
1.8 gD重组蛋白的western blot活性检测
纯化后的重组蛋白经SDS-PAGE后,转印至硝酸纤维素膜,5%脱脂奶粉4℃封闭过夜,加PRV阳性血清(1∶100稀释)37℃作用1h,TBST缓冲液洗3次,加入兔抗猪IgG辣根过氧化物酶(HRP)标记抗体(1∶5000稀释)37℃作用50min,TBST缓冲液洗3次,在二氨基联苯胺(DAB)缓冲溶液中显色10min。
1.9 间接ELISA诊断方法的建立
1.9.1 PRV gD-PPA-ELISA反应条件的优化试验
在相同的反应条件下,分别将重组抗原以不同包被浓度与待检样品的不同稀释倍数、不同封闭液与不同封闭时间、二抗不同稀释倍数与不同作用时间组成方阵,经方阵滴定试验分别进行各组份的条件优化。原则是阳性血清 OD450nm≈1.0,阴性血清OD450nm<0.2,选取P/N值最大的各个组合。在相同反应条件下,与待检样品分别作用30min~120 min,底物分别显色5min~20min,选择阳性血清OD450nm≈1.0,阴性血清 OD450nm<0.2,P/N值最大的一抗、底物作用时间。
1.9.2 PRV gD-PPA-ELISA判断标准的确定试验判定标准采用Cut-Off值法,将经中和试验(NT)和IDEXX gD-ELISA试剂盒同时检测为PRV抗体阴性的52份猪血清样本,利用PRV gD-ELISA已优化的最佳条件检测,将OD450nm值转换成S/P值,计算出52份血清的S/P平均值(¯x)和标准差(SD),我们规定S/P(样本)≥¯x+3SD时为阳性,S/P(样本)<¯x+2SD时为阴性,当¯x+2SD≤S/P(样本)<¯x+3SD为可疑,需重新检测样本,重检时S/P值≥¯x+2SD时判为阳性,S/P值<¯x+2SD时为阴性。

1.9.3 特异性试验 以建立的判断标准与CSFV、PPV、PRRSV、JEV、PCV-2、PEDV、TGEV 阳性血清进行PRV gD-PPA-ELISA检测,同时设PRV标准阳、阴性血清对照,确定重组抗原与其它常见猪病阳性血清是否发生交叉反应。
1.9.4 敏感性试验 将PRV标准阳性对照血清按1∶50~1∶25600倍稀释,稀释度平行做4个重复,用建立的 PRV gD-PPA-ELISA 检测,测定OD450nm值,换算成S/P值,确定其抗体检出效价。
1.9.5 重复性试验 批内重复性试验,选取8份PR抗体水平不同的血清,在相同试验条件下,每份血清样本平行做8个重复,用PRV gD-PPA-ELISA检测,对检测结果进行统计学分析。批间重复性试验,选取8份PR抗体水平不同的血清,在相同试验条件下,在4个不同时间用PRV gD-PPA-ELISA检测,对检测结果进行统计学分析;在相同试验条件下,用4批不同时间纯化的重组抗原进行PRV gDPPA-ELISA检测,对检测结果进行统计学分析。
1.9.6 符合性试验 IDEXX gD-ELISA试剂盒检测结果为阳性和阴性的血清样本,再用PRV gDPPA-ELISA检测,以IDEXX试剂盒检测结果为标准,计算PRV gD-PPA-ELISA相对于进口试剂盒的符合率、敏感性、特异性。
1.1 0 应用试验
应用本研究建立的PRV gD-PPA-ELISA抗体检测方法检测了来自山东、河南、河北等地的316份血清样本,了解PRV血清抗体阳性率。
2 结 果
2.1 PCR扩增、克隆及重组表达质粒的鉴定
PCR扩增产物经过1%琼脂糖凝胶电泳,在位于约1 070bp处可见特异性DNA扩增带(图1),与预期大小相符。构建的pMD18-T-gD质粒经PCR及BamH I/HindIII双酶切鉴定后(图2),测序结果表明克隆序列与毒株完全相同。构建的pET30agD重组质粒经PCR及BamH I/HindIII双酶切鉴定后(图3),测序结果表明其阅读框正确。
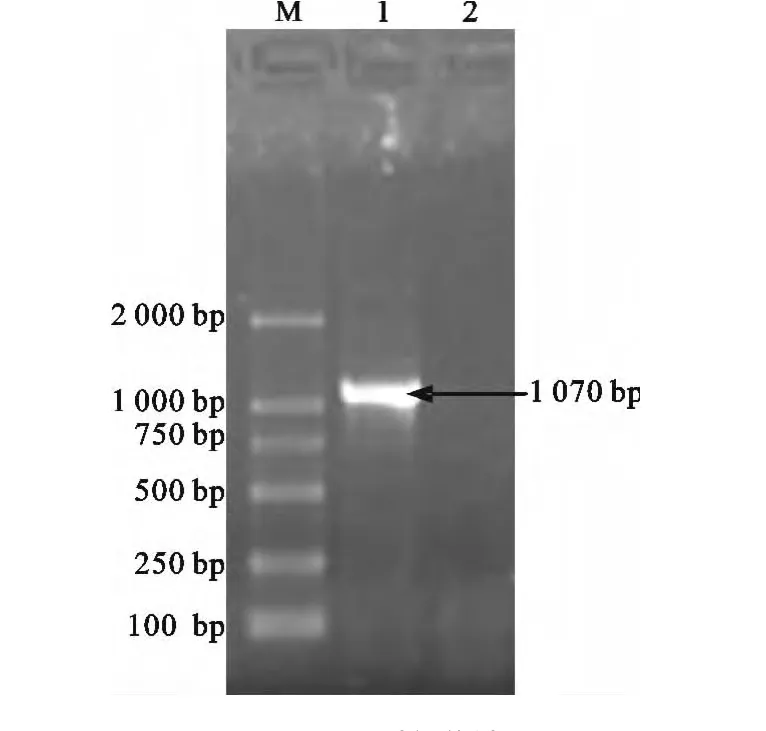
图1 PCR扩增结果Fig.1 Result of PCR Amplification
2.2 gD重组蛋白的表达与纯化

图2 重组质粒pMD18-T-gD鉴定Fig.2 Identification of recombinant cloning vector
以最佳条件(诱导温度为37℃、诱导剂浓度为1.0mmol/L、诱导时间为 5h)诱导表达,SDSPAGE表明所表达蛋白的分子量大小为50Ku,目的蛋白大部分是以包涵体形式表达的。包涵体经8M尿素变性后,采用镍离子亲和层析法纯化,纯化后的蛋白透析复性,Bradford法测定蛋白浓度为0.56mg/mL(图4)。
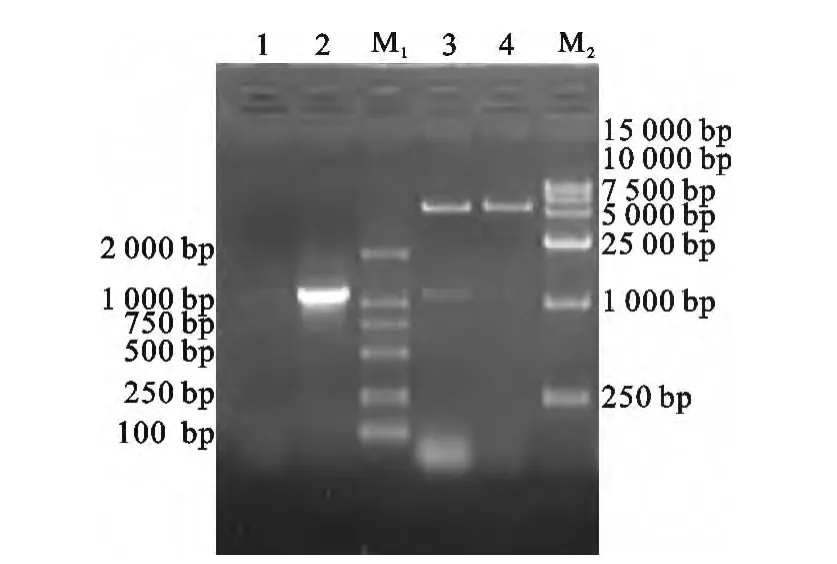
图3 重组表达载体pET30a-gD鉴定Fig.3 Identification of recombinant expression vector
2.3 gD重组蛋白的western blot活性鉴定
纯化后的蛋白经SDS-PAGE后,转印至硝酸纤维素膜上,与PRV阳性血清作用,结果该重组蛋白能与PRV标准阳性血清发生特异性反应,而空载体表达菌与PRV阳性血清没有反应(图5)。
2.4 PRV gD-PPA-ELISA相关条件确定试验结果
2.4.1 PRV gD-PPA-ELISA 最佳反应条件 由表1可知,重组抗原最佳包被浓度为5.6μg/mL;最佳封闭液为含1%BSA的PBST,最佳封闭时间为37℃作用2h;血清样本最佳稀释度为1∶100,最佳作用时间为37℃作用1h;二抗最佳工作浓度为1∶4000,最佳作用时间为37℃作用1h;底物最佳显色时间为37℃作用10min。
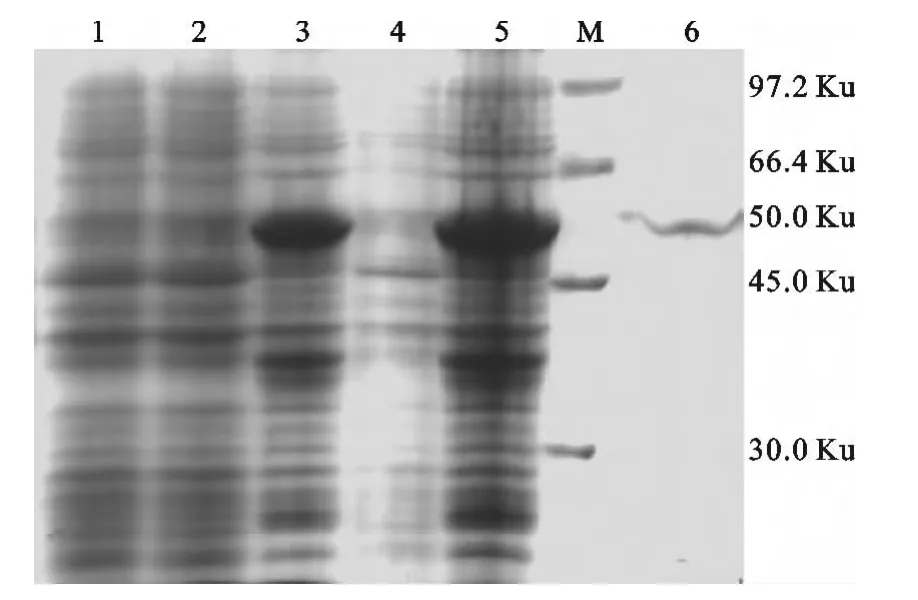
图4 重组蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of recombination protein
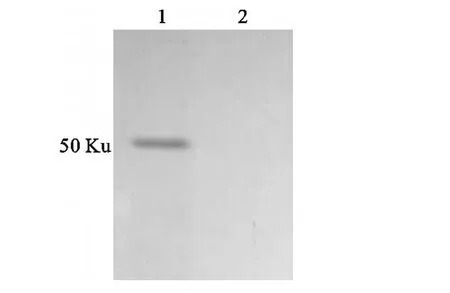
图5 表达产物的免疫印迹分析Fig.5 Western blotting of expressed products 1.纯
2.4.2 PRV gD-PPA-ELISA判定标准的确定 52份阴性血清样品,用PRV gD-PPA-ELISA检测后,将血清样本分成5组,以S/P值为横坐标,以各组样品数量为纵坐标,得到阴性血清样品S/P数值分布直方图(图6),这些样本的S/P值主要分布在0.05~0.20之间,占血清样本的90.38%,数据分布合理,可以作为制定判定标准的依据。计算得出52份阴性血清S/P平均值和标准差分别为¯x=0.148与SD=0.049。得出PRV gD-ELISA阴阳性判断标准:即当S/P(样本)≥0.295时判为阳性;当S/P(样本)<0.246时判为阴性;当0.246≤S/P(样本)<0.295时判为可疑。对可疑样本须重新检测,重检时,S/P(样本)≥0.246为阳性。

表1 PRV gD-PPA-ELISA反应条件试验Table 1 Test of PRV gD-PPA-ELISA response conditions
2.5 特异性试验结果
重组抗原与常见的CSFV、PPV、PRRSV、JEV、PCV-2、PEDV、TGEV 7种猪病阳性血清反应的S/P值均低于0.246(见表2),呈阴性反应。该结果表明重组蛋白与常见猪病的阳性血清不发生交叉反应,显示出了很好的特异性。
2.6 敏感性试验结果
检测PRV标准阳性对照血清,当血清稀释至1 2800倍时,检测结果仍为阳性(图7),证明所建立的方法具有较好的敏感性。

表2 交叉反应试验结果Table 2 Result of cross-reaction test
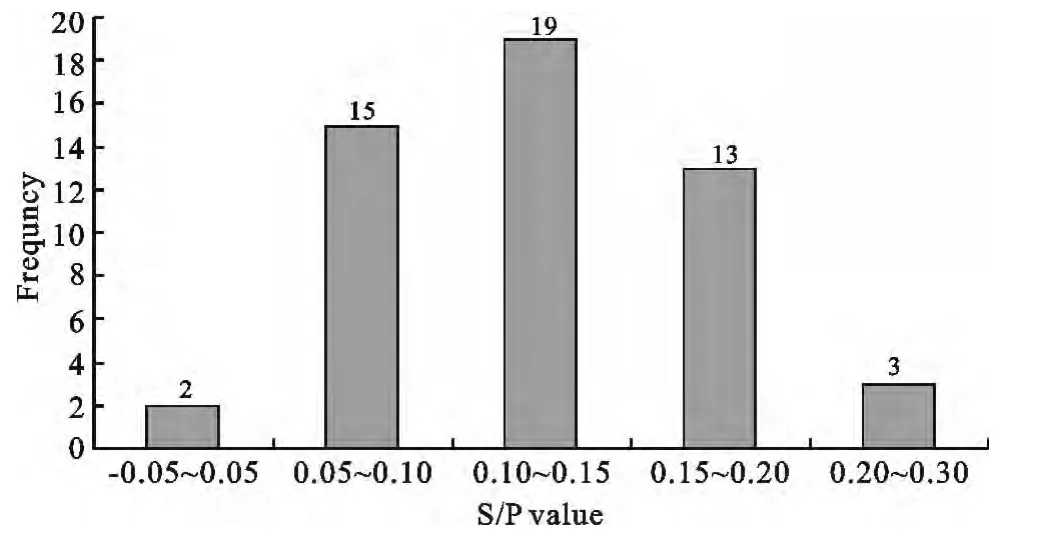
图6 阴性血清样品S/P值分布图Fig.6 Distribution of S/P value of negative serum samples
2.7 重复性试验结果
批内重复性试验变异系数小于5%(见表3),批间重复性试验变异系数小于10%(见表4)。说明PRV gD-PPA-ELISA方法具有良好的重复性。
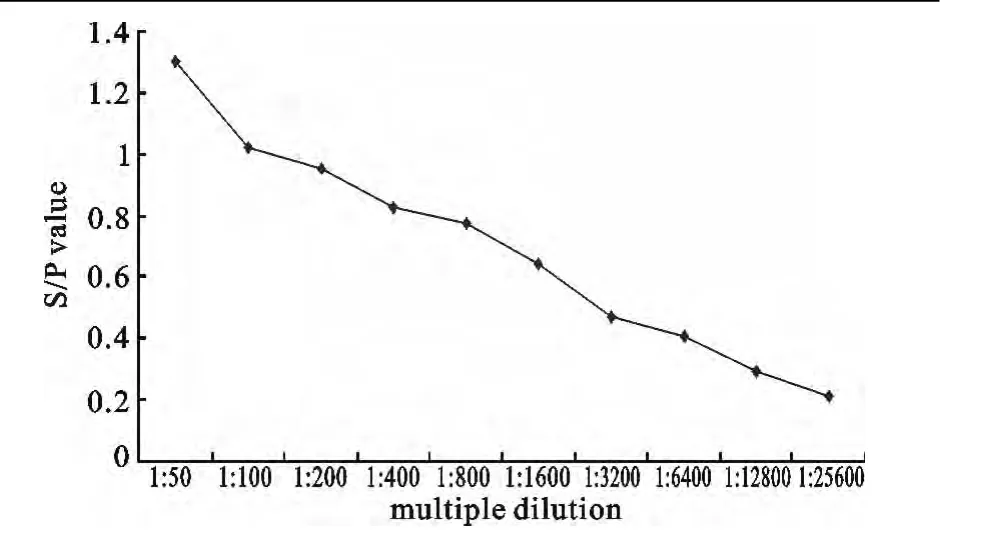
图7 图7PRV gD-PPA-ELISA敏感性试验Fig.7 Sensitivity of PRV gD-PPA-ELISA
2.8 符合性试验结果
IDEXX gD-ELISA试剂盒检测结果为阳性的102份血清样本,PRV gD-PPA-ELISA检出阳性97份,阴性5份;IDEXX gD-ELISA试剂盒检测结果为阴性的86份血清样本,gD-PPA-ELISA检出阴性76份,阳性10份。PRV gD-PPA-ELISA相对于进口试剂盒的符合率为92.0%,敏感性为95.1%,特异性为88.1%。
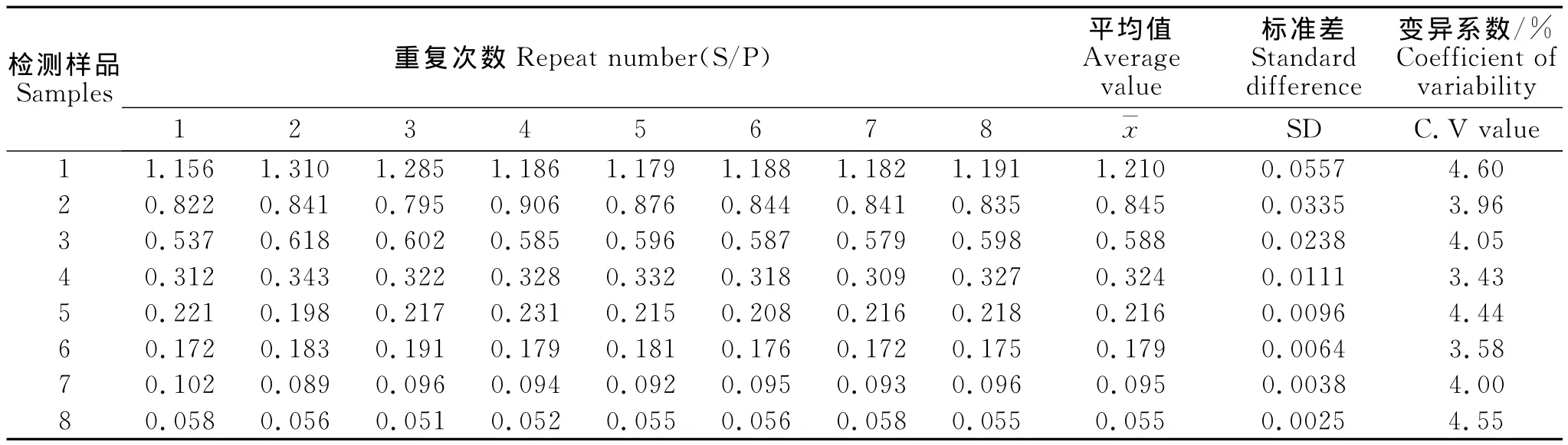
表3 批内重复性试验结果Table 3 Intro-batch repetition test
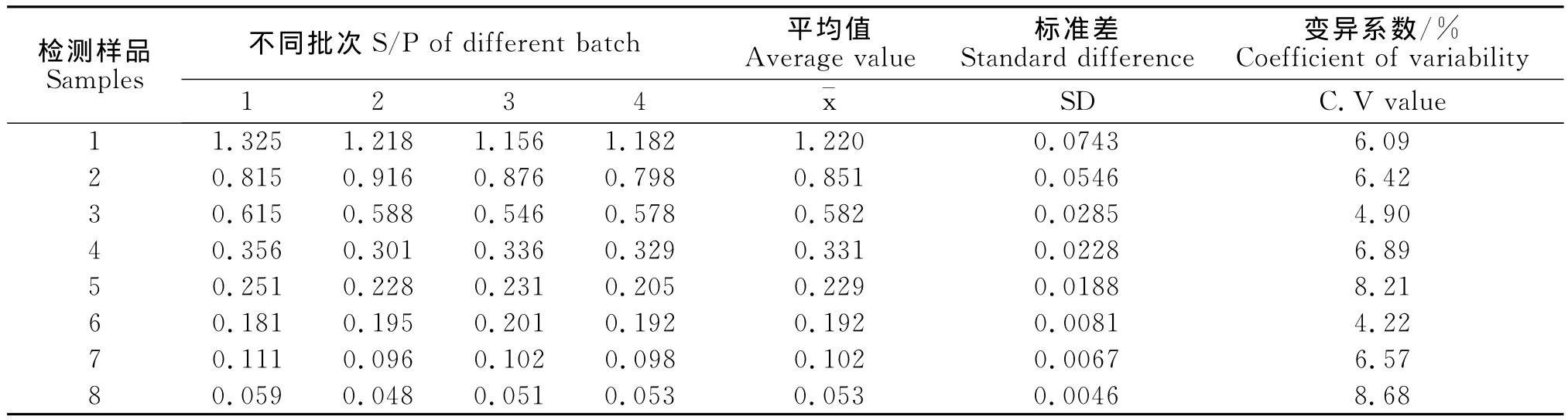
表4 批间重复性试验结果Table 4 Inter-batch repetition test
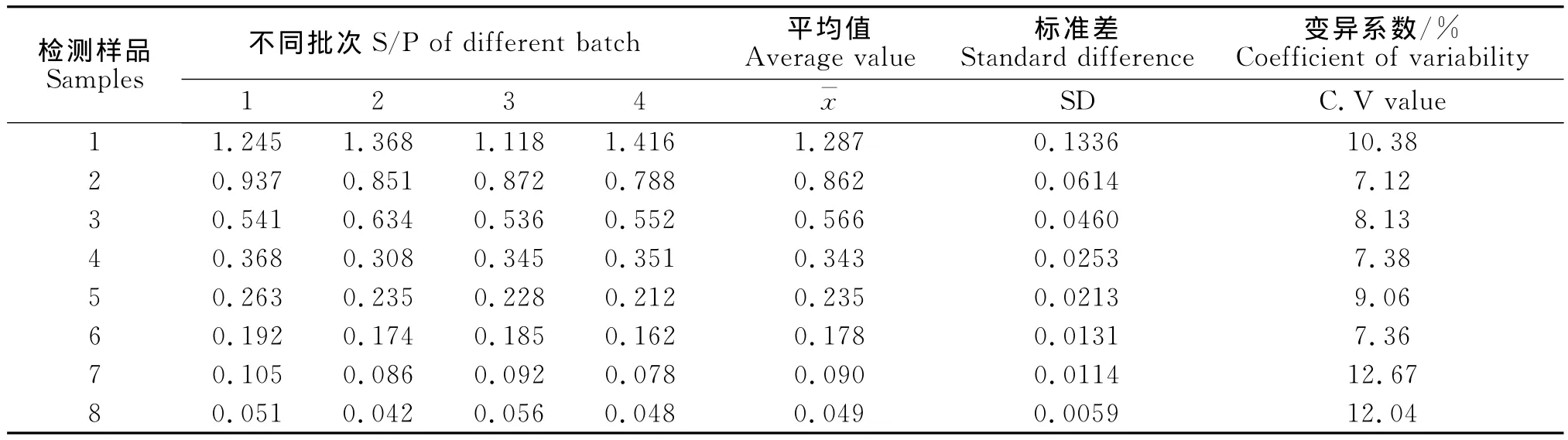
表5 不同批次重组抗原批间重复性试验结果Table 5 The recombinant antigens of inter-batch repetition test of different batches

表6 PRV gD-PPA-ELISA与IDEXX试剂盒相关性试验结果Table 6 Comparison between gD-PPA-ELISA and IDEXX Kit for detecting field samples
2.9 现地应用试验结果
应用本试验研制的PRV gD-PPA-ELISA抗体检测试剂盒检测了来自山东、河南、河北等地的316份血清样本,检出阳性258份,阴性58份,血清抗体阳性率为81.6%。
3 讨 论
目前,国内外的PRV诊断试剂普遍使用全病毒、gE、gB及gD作为诊断抗原,全病毒抗原由于受病毒培养和纯化等方面的技术限制,存在纯度有限、稳定性差、不易大批生产、容易散毒等缺点。gE是PRV的非必需蛋白,目前PRV疫苗多为gE基因缺失疫苗,用该蛋白作为血清学诊断抗原无法进行疫苗免疫水平抗体监测。gB蛋白是PRV蛋白中最保守的蛋白,该蛋白与疱疹病毒科其它疱疹病毒具有免疫交叉反应。而gD糖蛋白是PRV成熟的病毒粒子囊膜表面的主要糖蛋白之一,也是PRV主要的免疫原性蛋白之一,它刺激机体产生的抗gD的抗体具有中和保护能力,是制备血清学诊断抗原及亚单位疫苗的首选蛋白。表达外源蛋白的系统虽然较多,但大肠杆菌表达系统具有培养方便、操作简单、成本低廉、表达量大、易于纯化、易于工业化批量生产等优点,是实验室获取重组蛋白的一种重要工具。由于pET30a原核表达载体所带的融合标签小,重组蛋白折叠时不易掩盖被研究蛋白的表位,能够保持蛋白原有的反应性。且pET30a原核表达载体的表达产物氨基端带有6个his组氨酸融合标签,可以利用固定化金属离子亲和层析法纯化,纯化过程简单,易于大量制备。因此本试验利用pET30a原核表达载体,表达了PRVgD蛋白,经免疫印迹试验证实所截短表达的gD蛋白可与PRV阳性血清发生较强的反应,说明重组gD蛋白具有良好的反应性与特异性。猪伪狂犬的诊断方法较多,主要包括病毒的分离与鉴定、血清学及分子生物学检测方法,其中血清学检测方法是检测PRV血清抗体的重要手段之一,在PRV的早期检测、流行病学调查和监测等方面发挥着重要的作用,也是免疫猪群抗体水平监测的主要方法。对于PRV的血清学诊断,OIE推荐使用病毒中和试验,病毒中和试验虽然准确性高,但存在试验周期长、操作繁琐和不适于大批量样品检测等缺点。ELISA诊断方法具有敏感性和特异性强、操作简单、检测快速、高通量、无辐射、价格低廉等特点,是当前动物传染病检疫、流行病学调查和免疫监测广泛采用的血清学诊断技术。本研究以原核表达的重组gD蛋白作为包被抗原建立的间接ELISA诊断方法具有很好的敏感性和特异性,显示出了良好的应用前景。本实验室预期将其组装成试剂盒,为我国PRV疫苗免疫水平抗体监测和流行病学调查等提供一种简便、快速的血清学检测方法。
[1] Rock D L,Hagemoser W A,Osorio F A,et al.Transcription from the pseudo rabies virus genome during latent infection[J].Arch Virol,1988;98(1,2):99-106.
[2] 郭广君,吕素芳,肖跃强,等.猪伪狂犬病病毒检测方法研究进展[J].动物医学进展,2011,32(12):84-88.
[3] Muller T,Klupp B G,Freuling C,et al.Characterization of pseudo rabies virus of wild boar origin from Europe[J].Epidemiol Infect,2010,138(11):1 590-1 600.
[4] Wilson S,Doster A R,Hoffman J D,et al.First record of Pseudo rabies in feral swine in Nebraska[J].J Wildl Dis.2009,45(3):874-876.
[5] Fonseca A A Jr,Camargos M F,de Oliveira A M,et al.Molecular epidemiology of Brazilian pseudo rabies viral isolates[J].Vet Microbiol,2010,41(3,4):238-245.
[6] 孙圣福,陈 静,马慧玲,等.不同日龄猪伪狂犬抗体跟踪监测与分析[J].中国畜牧兽医,2011,38(4):232-233.
[7] 刘 涛,王 瑞,曲哲会,等.信阳地区猪瘟与伪狂犬病免疫状况血清学调查[J].黑龙江畜牧兽医,2012(11):79-80.
[8] Fonseca A A Jr,Heinemann M B,Leite R C,et al.A comparative analysis of envelope and tegument proteins of suid herpesvirus 1,bovine herpesvirus 1and bovine herpesvirus 5[J].Arch Virol,2010,155(10):1 687-1 692.
[9] Ching T H,Spear P G,Struyf F,et al.Glycoprotein D-independent spread of pseudo rabies virus infection in cultured peripheral nervous system neurons in a compartmented system[J].J Virol,2007,81(19):10 742-10 757.
[10] Van Rooij E M,Rijsewijk F A,Moonen-Leusen H W,et al.Comparison of different prime-boost regimes with DNA and recombinant orf virus based vaccines expressing glycoprotein D of pseudo rabies virus in pigs[J].Vaccine,2010,28(7):1 808-1 813.
[11] 马凤龙,王文成,向 华,等.猪伪狂犬病病毒LY株gD基因的克隆与核酸疫苗研究[J].中国兽医学报,2008,28(4):412-416.
[12] 徐志文,郭万柱,许雁峰,等.猪伪狂犬病病毒gD基因的生物信息学分析[J].中国兽医学报,2009,29(ll):1 382-1 389.
[13] 曾显成,吴异健,陈家祥,等.猪伪狂犬病病毒FZ株的分离鉴定及gD基因序列分析[J].福建农林大学学报:自然科学版,2011,40(5):501-510.

