羧甲基壳聚糖温敏凝胶对NIH3T3细胞增殖、骨化分化的影响*
陈乃玲,穆 玉,李明珠,孙竹梅,徐宝珍
1)河北联合大学口腔医学院口腔中心实验室 唐山 063000 2)河北联合大学冀唐学院医学实验中心 唐山 063000 3)厦门市口腔医院牙体牙髓科 厦门361000 4)河北联合大学护理与康复学院 唐山 063000 5)河北联合大学附属医院放疗科 唐山 063000
羧甲基壳聚糖温敏凝胶对NIH3T3细胞增殖、骨化分化的影响*
陈乃玲1)△,穆 玉2),李明珠3),孙竹梅4),徐宝珍5)
1)河北联合大学口腔医学院口腔中心实验室 唐山 063000 2)河北联合大学冀唐学院医学实验中心 唐山 063000 3)厦门市口腔医院牙体牙髓科 厦门361000 4)河北联合大学护理与康复学院 唐山 063000 5)河北联合大学附属医院放疗科 唐山 063000
△女,1964年10月生,大专,实验师,研究方向:口腔基础和临床教学,E-mail:chennailing158@126.com
羧甲基壳聚糖;温敏性水凝胶;NIH3T3细胞;细胞增殖;细胞分化
目的:探讨羧甲基壳聚糖温敏凝胶对NIH3T3细胞增殖、骨化分化的影响。方法采用MTT法和ALP法检测20、100、150、200、500 g/L的羧甲基壳聚糖温敏凝胶浸提液对体外培养NIH3T3细胞24、48和72 h后细胞增殖、骨化分化的影响。结果2种测定方法均显示培养24、48和72 h后各实验组细胞的OD值高于对照组(增殖:F组别=113.961,F时间=429.535,F交互=7.304,P均<0.001;骨化分化:F组别=57.043,F时间=3 177.618,F交互=12.827,P均<0.001),其中150 g/L羧甲基壳聚糖温敏凝胶浸提液对细胞的促进增殖和骨化分化效果最佳。结论羧甲基壳聚糖温敏凝胶对NIH3T3细胞的增殖及骨化分化均具有一定的促进作用。
随着牙周病发病率逐年升高,牙周病的治疗成为口腔临床治疗中的重要部分,其治疗的最终目标是获得牙周组织再生。近年来对羧甲基壳聚糖的研究日趋成熟,但是其能否促进牙周膜成纤维细胞的附着和增殖,尤其是促进其在重度牙周炎患牙病变牙根面上的附着和增殖及向成骨方面分化,目前还没有明确的实验证据。作者采用MTT法观察羧甲基壳聚糖温敏凝胶对NIH3T3细胞增殖的影响,并通过测定细胞碱性磷酸酶(ALP)活力变化(其可反映其对细胞骨向分化能力的影响),了解羧甲基壳聚糖温敏凝胶用于牙周组织再生的可行性。
1 材料与方法
1.1细胞株、主要仪器和设备小鼠胚胎成纤维细胞NIH3T3(天津赛尔生物技术有限公司),DMEM细胞培养基(高糖型)、胎牛血清(FBS)、胰蛋白酶(天津血液研究所),ALP试剂盒(上海达豪生物科技有限公司),四甲基偶氮唑盐(MTT,美国Sigma公司);CO2饱和湿度细胞培养箱(3336S/N307152-548,Forma Sicentific),倒置显微镜(DIAPHOT-TMID,Nikon公司),高速低温离心机(德国Sigma公司);NovapathTM全自动酶标仪(RC-232C,日本BIO-RAD公司)。
1.2NIH3T3细胞增殖的MTT法测定复苏NIH3T3细胞,2.5 g/L胰蛋白酶消化,倒置显微镜下见细胞缩小变圆脱落后,加入含体积分数10% FBS的完全培养基终止消化,10 000 r/min离心5 min后弃上清,加入含体积分数10% FBS的完全培养基,吹打混匀后以1×105mL-1的密度接种于3块96孔培养板中,每块板随机分为5个实验组和1个对照组,每组选用6个孔,每孔100 μL,在37 ℃、体积分数5% CO2孵箱中培养24 h。贴壁良好后,弃净孔内液体,无血清DMEM洗涤3次。实验组各孔分别加入浸提液(课题组在前期试验中用羧甲基壳聚糖与β-甘油磷酸钠互配,制备出在室温下液体、在37 ℃发生凝胶化的羧甲基壳聚糖温敏凝胶[1],将制备好的羧甲基壳聚糖温敏凝胶用含体积分数10% FBS的DMEM完全培养基配制成终质量浓度分别为20、100、150、200、500 g/L的羧甲基壳聚糖温敏凝胶浸提液200 μL),对照组只加含体积分数10% FBS的DMEM完全培养基进行培养,再放入37 ℃、体积分数5% CO2孵箱中培养,孔板周围剩余孔内加入PBS缓冲液。在培养24、48和72 h后各取出一块96孔板,避光条件下每孔加入5 g/L的MTT 20 μL,继续培养4 h后吸去孔内培养液,再将每孔内加入150 μL DMSO,振荡10 min,用酶标仪在490 nm波长下测光密度(OD)值。
1.3NIH3T3细胞ALP活性测定细胞分组及培养同1.2。分别于24、48和72 h后各取出一块培养板,弃孔内液体,用无血清DMEM洗涤后吸弃培养液,加入100 μL Triton X-100,置4 ℃冰箱过夜。倒置显微镜下观察已无完整细胞结构后,振荡混匀,取上述各孔液体各50 μL,空白对照选用50 μL双蒸水,转入另一96孔板,按ALP试剂盒说明依次按比例加入缓冲液、基质液,37 ℃水浴15 min,显色剂显色,在酶联仪上于405 nm波长下测OD值。
1.4统计学处理采用SPSS 17.0进行分析,应用6×3析因设计的方差分析比较各组细胞培养不同时间后细胞增殖及细胞ALP活性的变化,检验水准α=0.05。
2 结果
2.1各组细胞培养不同时间后细胞增殖的变化NIH3T3细胞复苏后,倒置显微镜下可见细胞形态为典型的长梭形或不规则三角形,胞体较大,可见细胞突,细胞核亦较大较明显,细胞均匀贴壁生长于瓶底。各组细胞培养不同时间后细胞增殖的变化见表1。
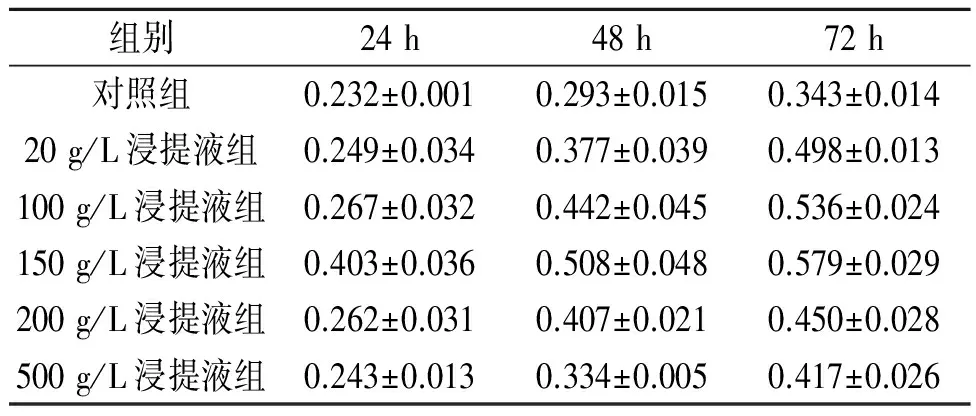
表1 各组细胞培养不同时间后细胞增殖的变化(n=6)
F组别=113.961,F时间=429.535,F交互=7.304,P均<0.001。
2.2各组细胞培养不同时间后细胞ALP活性测定结果见表2。

表2 各组细胞培养不同时间后细胞ALP活性测定结果(n=6)
F组别=57.043,F时间=3 177.618,F交互=12.827,P均<0.001。
3 讨论
羧甲基壳聚糖是壳聚糖羧甲基化后的新型衍生物,除了具有良好的生物相容性和生物可降解性外,还有广谱抗菌、抗感染和很强的凝血作用,具有促进伤口愈合、消炎止痛、增强免疫等多种生理活性作用,也有促进成骨细胞分化的作用[2-5]。庄昭霞等[6]将壳聚糖与羧甲基壳聚糖调制成复合膜,配制浸提液后证明其对牙周膜细胞具有良好促进增殖和分化的作用;另有学者[7]在对NIH3T3细胞和牙周膜成纤维细胞的试验中发现,羧甲基壳聚糖可有效促进成纤维细胞的增殖和向成骨方向分化。但其能否促进牙周组织细胞在重度牙周炎患牙的病变牙根面上附着和增殖,从而促进牙周组织再生,需要进一步实验证实。
温敏凝胶具有临界相转变温度,能因环境温度的改变而发生可逆的膨胀、收缩,从而来控制药物的释放,成为近年来研究的新热点[8]。目前,对温敏性壳聚糖凝胶的研究较多,有关羧甲基壳聚糖温敏性水凝胶的研究近年来报道甚少。课题组在前期试验中用羧甲基壳聚糖与β-甘油磷酸钠互配,制备出在室温下液体、在37 ℃发生凝胶化的羧甲基壳聚糖温敏凝胶。研究[9]已证实羧甲基壳聚糖温敏凝胶具有良好的组织相容性,羧甲基壳聚糖温敏凝胶除了拥有羧甲基壳聚糖的生物学优点之外,还因为温敏凝胶系统具有温度转变性,可以通过注射的方式将其放置于需要的部位,载药凝胶可以缓慢持续地释放药物,长时间与作用部位发生紧密接触,提高药物的生物利用度,减少给药次数,增加药物疗效[10]。
该实验通过观察羧甲基壳聚糖温敏凝胶对NIH3T3细胞增殖、分化能力的影响,肯定了羧甲基壳聚糖温敏凝胶的生物学作用,提示羧甲基壳聚糖温敏凝胶在牙周组织再生领域具有远大的应用前景,为牙周组织再生的研究提供充分而有利的依据,并指导临床治疗。但该研究也存在一定的不足,仅仅体外观察了羧甲基壳聚糖温敏凝胶作用24、48、72 h时的细胞增殖、分化情况,延长作用时间后是否依然能促进细胞增殖则有待于进一步实验研究。
[1]彭伟,穆玉.羧甲基壳聚糖温敏凝胶的制备及其毒性实验[J].中国组织工程研究与临床康复,2010,14(51):9591
[2]蒋挺大.甲壳素[M].北京:化学工业出版社,2003:301
[3]潘仕荣,陈浩凡,莫家聪,等.羧甲基壳聚糖用作防止术后粘连的研究[J].中国生物医学工程学报,2006,25(3):277
[4]吴奕光,韦少慧,郑宗坤,等.低取代6-0-羧甲基壳聚糖结构及其抗菌和促进皮肤创面愈合的研究[J].中国生物医学工程学报,2006,25(5):613
[5]张永军,高继红,薛毅,等.羧甲基壳聚糖在阻生齿拔牙创中的应用研究[J].中国医药指南,2008,6(5):14
[6]庄昭霞,林志勇,曹金芳.壳聚糖-羧甲基壳聚糖膜的生物相容性研究[J].上海口腔医学,2003,12(5):362
[7]李岩.甲壳素及衍生物对NIH3T3细胞和人牙周膜细胞增殖的影响[D].石家庄:河北医科大学,2005.
[8]Rossi S,Marciello M,Bonferoni MC,et al.Thermally sensitive gels based on chitosan derivatives for the treatment of oral mucositis[J].Eur J Pharm Biopharm,2010,74(2):248
[9]穆玉,陈乃玲,彭伟,等.羧甲基壳聚糖温敏凝胶对小鼠L929细胞增殖的影响[J].天津医药,2012,40(4):363
[10]林友文,方圆圆,孟晓丹.壳聚糖凝胶的温敏性及其药物缓释性能研究[J].福建医科大学学报,2009,43(1):37
(2013-10-23收稿 责任编辑赵秋民)
Effects of carboxymethyl chitosan thermosensitive hydrogel on the proliferation and ossification differentiation of NIH3T3 cells
CHENNailing1),MUYu2),LIMingzhu3),SUNZhumei4),XUBaozhen5)
1)CenterLaboratoryofStomatology,CollegeofStomatology,HebeiUnitedUniversity,Tangshan063000 2)MedicalResearchCenter,JitangCollege,HebeiUnitedUniversity,Tangshan063000 3)DepartmentofEndodontics,XiamenStomatologicalHospital,Xiamen,361000 4)CollegeofNursingandRehabilitation,HebeiUnitedUniversity,Tangshan063000 5)DepartmentofRadiotherapy,AffiliatedHospital,HebeiUnitedUniversity,Tangshan063000
carboxymethyl chitosan;themosensitive hydrogel;NIH3T3 cell;proliferation;diferentiation
Aim: To explore the effects of carboxymethyl chitosan thermosensitive hydrogel on NIH3T3 cell proliferation and ossification differentiation. Methods: MTT method and ALP method were used to test the effects of 20, 100, 150, 200, 500 g/L carboxymethyl chitosan thermosensitive hydrogel leaching liquors on NIH3T3 cell proliferation and ossification differentiation which was cultured in vivo for 24, 48 and 72 h. Results: Both methods showed thatODvalues of various experimental groups cultured for 24, 48 and 72 h were higher than that of the control group (proliferation:Fgroup=113.961,Ftime=429.535,Finteraction=7.304,P<0.001; ossification differentiation:Fgroup=57.043,Ftime=3 177.618,Finteraction=12.827,P<0.001); 150 g/L carboxymethyl chitosan thermosensitive hydrogel leaching liquor had the best cell proliferation and ossification differentiation effects. Conclusion: Carboxymethyl chitosan thermosensitive hydrogel can promote NIH3T3 cell proliferation and ossification differentiation.
10.13705/j.issn.1671-6825.2014.04.027
*唐山市科技计划项目 13130276z
R781.3

