依达拉奉在全麻后高氧性肺损伤中的临床应用价值
李琼灿,方 懿,姜 英,刘绍明
(湖南省长沙市中心医院 麻醉科,湖南 长沙,410006)
全身麻醉过程中有许多因素会引起机体氧自由基的增多,尤其是在长时间吸入高浓度甚至纯氧的时候[1],而且多种疾病以及手术刺激与机体的氧自由基存在相关性,而清除机体产生的过多的氧自由基可以减轻其对人体的损伤。由于麻醉药物的固有药理特性,对呼吸及循环功能均存在显著的抑制作用,给药后麻醉医师的重点往往偏向于保证患者的氧气供应,而忽略了高浓度氧所引起的危害,且全身麻醉使用肌松药物后必须进行气管插管并连接麻醉机控制呼吸,但国内许多手术室暂无中心压缩空气的供给,而不得不使用纯氧吸入[2]。本研究使用依达拉奉预防和治疗长时间接受纯氧麻醉后发生的高氧性肺损伤,现报告如下。
1 资料与方法
1.1 一般资料
选择2010年1月—2013年8月本院气管插管全身麻醉下完成手术且麻醉时间超过8 h者80例。排除术前合并肺功能损伤、开胸手术单肺通气、术前存在肺部感染及患者或其家属签字拒绝入组者。按照数字随机法将所有患者均分为2组。观察组中男23例,女17例,年龄18~49岁,平均(35.6±3.9)岁;吸烟史者21例,吸烟时间5~32年,平均(15.9±3.5)年;麻醉机使用时间8~15 h,平均(10.6±1.5) h; 术后进入重症监护室呼吸机使用时间1~4 h,平均(1.9±0.5) h。对照组中男24例,女16例,年龄18~50岁,平均(36.7±3.8)岁;吸烟史者22例,吸烟时间5~33年,平均(15.8±3.4)年;麻醉机使用时间8~14.5 h,平均(10.5±1.6) h; 术后进入重症监护室呼吸机使用时间1~4 h,平均(1.8±0.5) h。2组性别、年龄吸烟史、吸烟时间、麻醉机使用时间及呼吸机使用时间比较差异无统计学意义(P>0.05)。
1.2 方法
所有患者均签署知情同意书,并申报医院伦理委员会批准,麻醉监测步骤:使用芬太尼、丙泊酚、顺式阿曲库铵静脉诱导气管插管,术中以丙泊酚、顺式阿曲库铵、瑞芬太尼联合泵入维持麻醉深度,麻醉机下吸入纯氧行机械通气,进入ICU后使用呼吸机行机械通气,2组患者呼吸机吸入氧浓度均选择为30%,其中观察组在患者进入手术室及进入ICU时均即刻静脉滴注依达拉奉30 mg,对照组则未行特殊处理。
1.3 观察指标
在2组经ICU治疗后拔管时使用分光光度法测定丙二醛(MDA)、酶速率法测定超氧化物歧化酶(SOD),比色法检测谷光甘肽过氧化物酶(GSH-px)水平变化,并观察麻醉时、手术结束时、进入ICU时、拔管时各时间点2组麻醉机和呼吸机显示的气道峰压(Ppeak)、气道平台压变化(Pplat)及肺泡-动脉血氧分压差变化(PA-aO2)。
2 结 果
观察组拔管时MDA显著低于对照组(P<0.05),SOD和GSH-px则显著高于对照组(P<0.05)。见表1。手术结束时、进入ICU时及拔管时观察组Ppeak 、Pplat和PA-aO2均显著低于对照组(P<0.05)。见表2。
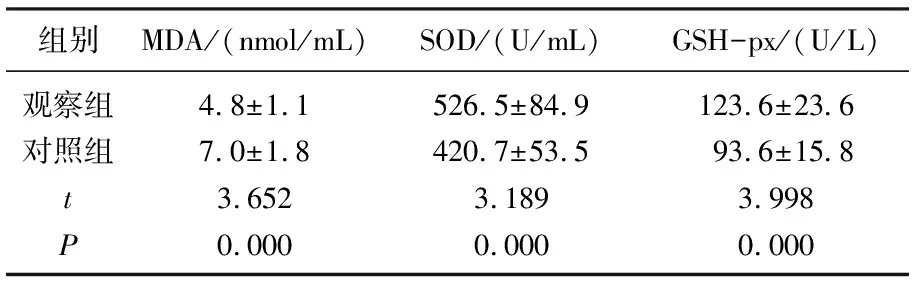
表1 2组患者拔管时MDA、SOD及GSH-px水平变化
3 讨 论
高氧性肺损伤主要是因为长时间的吸入高浓度的氧导致肺组织中吞噬细胞激活而释放炎症性细胞因子,并激活多型核粒细胞,而细胞膜表面烟酰胺腺嘌呤二核苷酸氧化酶会将机体游离的氧离子还原为过氧化阴离子,导致氧自由基的增多,出现对肺组织生物膜的攻击,引起肺功能紊乱[3]。当机体细胞尤其是细胞膜受到氧自由基的攻击出现损伤时,其中的氧自由基能与脂类物质直接结合,并夺取脂类膜上的一个氢原子而形成脂基因,在长时间存在高氧吸入的情况下导致脂质过氧化反应,引起脂肪酸链的断裂,而影响到细胞膜的流动性及通透性[4]。大量研究[5-6]提示,吸入高浓度氧后,肺是最先也是最严重的受影响器官,因为肺内的氧分压水平明显高于其他组织。基础研究提示,吸入纯氧后8 h大鼠肺组织超微结构的内皮细胞及肺上皮细胞的形态和功能均发生改变,出现大量的氧自由基,引起细胞内的抗氧化酶活性异常,细胞膜的脂质过氧化,出现肺血管内皮细胞、气道上皮细胞的过氧化损伤,临床主要表现为肺水肿、气道压增高甚至支气管的痉挛。还有研究发现长时间吸入高浓度氧后导致的DNA发生断裂,破坏了蛋白质的一级结构亦是氧自由基引起肺组织损伤的机制。
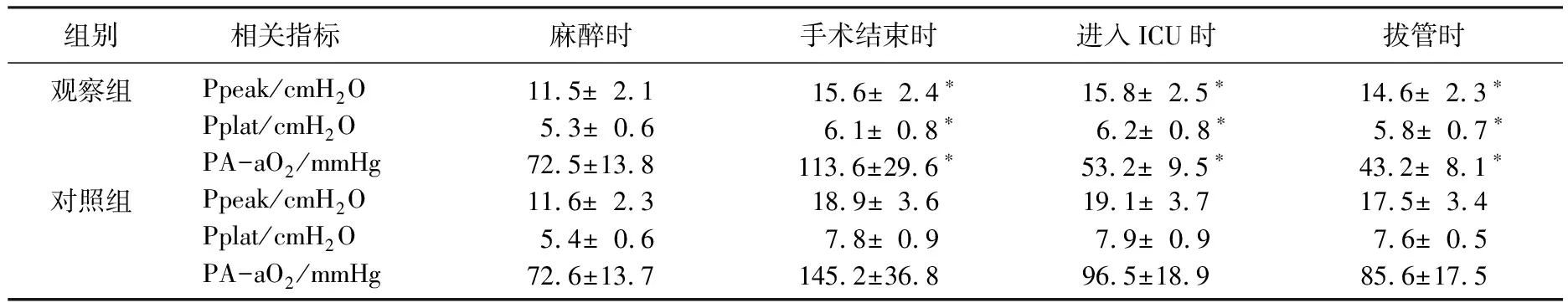
表2 2组治疗期间Ppeak、Pplat及PA-aO2比较
Turanlahti等[7]通过大量的动物实验后认为暴露于高氧(>95%)6 h后,肺组织内的蛋白结构及脂质膜均会出现不可逆的氧自由基介导的损害,如果吸入氧的压力超过0.3 MPa或者延长常压下吸入高浓度氧的时间均会导致高氧性肺损伤。鉴于麻醉科所吸入的氧气均为纯氧,一旦手术时间较长,势必会对患者的肺功能造成一定的损伤,所以本研究提出通过药物干预以减少氧自由基对肺组织的影响。本研究观察组使用依达拉奉进行干预,并检测拔管时MDA、SOD及GSH-px水平变化,发现观察组MDA显著低于对照组,可能是依达拉奉治疗后的抗脂质过氧化作用,减少了肺透明膜的形成,增强细胞生物膜的稳定性,缓解了肺组织的水肿,从而是氧化应激的标志物丙二醛显著的降低有关。同时,观察组SOD及GSH-px水平均高于对照组,反映了机体清除氧自由基能力的增强,可能是使用依达拉奉后阻止细胞内外蛋白质遭受氧自由基的破坏,提高机体抗氧化的能力,减轻氧自由基对糖类及蛋白质的损伤程度,维持机体基本的能量代谢有关[8]。对于肺部呼吸功能的监测发现,手术结束时、进入ICU时及拔管时观察组Ppeak、Pplat和PA-aO2均显著低于对照组,可能与使用依达拉奉后减轻了肺组织的水肿以及肺泡膜的脂质受损严重测定有关,而PA-aO2的降低则其对于减轻肺的氧合功能障碍,改善肺功能有效。
[1]Kikuchi K,Takeshige N,Miura N,et al.Beyond free radical scavenging: Beneficial effects of edaravone (Radicut) in various diseases (Review)[J].Exp Ther Med,2012,3(1): 3.
[2]施梦,王宜青,庞烈文,等.依达拉奉对大鼠急性肺损伤的干预作用[J].中华胸心血管外科杂志,2009,25(6): 402.
[3]帅训军,于洋,艾登斌,等.不同麻醉下依达拉奉对开胸手术单肺通气患者炎性反应的影响[J].中华麻醉学杂志,2010,30(1): 113.
[4]Reyes Y A,Shimoyama T,Akamatsu H.MCI-186 (edaravone),a free radical scavenger,attenuates ischemia-reperfusion injury and activation of phospholipase A(2) in an isolated rat lung model after 18 h of cold preservation[J].Eur J Cardiothorac Surg,2006,29(3): 304.
[5]Fukumoto Y,Yabuki A,Sakata R.Inhibitory effects of edaravone on the production of tumor necrosis factor-alpha in the isolated heart undergoing ischemia and reperfusion[J].Heart?Vessels,2006,21(2): 108.
[6]Yury A.Bellido Reyes,Takehiko Shimoyama,et al.MCI-186 (edaravone),a free radical scavenger,attenuates ischemia reperfusion injury and activation of phospholipase A2 in an isolated rat lung model after 18 h of cold preservation[J].Eur J Cardiothorac Surg,2006,29(3): 304.
[7]Turanlahti M,Pesonen E,Lassus P,et al.Nitric oxide and hyperoxia in oxidative lung injury[J].Acta Paediatr,2000,89(13): 966.
[8]柳娟,张忱,张永谦,等.依达拉奉对单肺通气患者肺组织氧化应激反应的影响[J].中华麻醉学杂志,2011,30(7): 789.

